紫外辐射对菹草成株表型可塑性及石芽的影响
王锦旗, 刘 燕, 薛 艳, 郑有飞, 吴芳芳
1 南京信息工程大学应用气象学院, 南京 210044 2 江苏省环境演变与生态建设重点实验室, 南京 210023 3 南京信息工程大学环境科学与工程学院, 南京 210044 4 南京信息工程大学大气物理学院, 南京 210044
紫外辐射对菹草成株表型可塑性及石芽的影响
王锦旗1,2,*, 刘 燕3, 薛 艳3, 郑有飞4, 吴芳芳1
1 南京信息工程大学应用气象学院, 南京 210044 2 江苏省环境演变与生态建设重点实验室, 南京 210023 3 南京信息工程大学环境科学与工程学院, 南京 210044 4 南京信息工程大学大气物理学院, 南京 210044
菹草衰亡的原因一直是水体生态修复的研究热点,已有的研究认为强光照是促进菹草衰亡的关键因素,强光照中对动植物有害波段主要为UV-B波段,为此分别将菹草成株置于50、100、150、200 μW/cm2剂量的UV-B辐射下,每日持续辐射6h(9:00—15:00),对照组接受的UV-B剂量为0,仅接受UV-A和光合有效辐射,监测菹草生长、形态状况、石芽形成及萌发等指标。结果表明,高剂量UV-B辐射能促进菹草成株的衰亡进程,即使暴露在低剂量UV-B辐射条件下,植株仍然衰亡;植株株高、节间距、叶面积、单株鲜重都受到UV-B辐射的抑制,且随UV-B辐射剂量增加,各项指标明显下降;UV-B辐射对菹草成株形成的石芽数量无显著影响,但形成的石芽随辐射剂量增加变态率增高,长度增加,宽度减少,石芽重量减轻,下一个生长季萌发率降低,萌发出二苗的比率降低,萌发苗各项生长指标随辐射剂量增加逐渐降低。因此,春末夏初UV-B辐射增强可能是导致菹草大批衰亡的重要原因。
UV-B辐射; 表型可塑性; 株高; 叶面积; 石芽
菹草(Potamogetoncrispus)是眼子菜科多年生沉水草本植物,是一种典型的秋季萌发、越冬生长的沉水植物,主要分布在水流缓慢或静水的河流、小溪、池塘、淡水湖泊等水域,水体pH值中性左右,常和数种眼子菜、轮藻、角果藻及金鱼藻等混生一处[1]。其生长水深一般不超过1.8 m,部分深水水域株高可达4 m[2]。菹草作为冬春季沉水植物的优势种,对水体中的氮、磷等营养盐有吸收作用,在净化水质、改善水环境质量、提高水体透明度、抑制藻类生长等方面均有显著作用[3],在维持水生生态系统的平衡与健康有重要意义[4]。野外菹草生长特性主要表现为春季生长迅速、夏初死亡,其衰亡的原因一直是很多学者研究的重点,国内外众多学者分别提出各自的观点,很多水体在生态修复过程中也尝试了多种方式推迟菹草衰亡时间,但均因衰亡机理不明,未能起到显著效果。
关于菹草夏初衰亡的原因,以往的研究认为其夏季衰亡的主要原因是水温过高[5-6]、营养盐不足[7],另有研究认为不良光照[8]。最新的研究认为强光照是造成冬春季的沉水植物夏季大量衰亡的真实原因,在菹草生长早期,光照一般不会对水下菹草的生长产生抑制;而到后期,强日照的日子增多,菹草经春季快速生长已到达水表,水表强烈的光照条件将对菹草生长、生存产生剧烈抑制作用,进而促进菹草衰亡[9]。那么强光照中到底是什么波段真正起作用的呢?对比江苏省水环境中试平台温室内外光照差异不难发现,温室内外光照差异不大,但紫外辐射明显减弱,尤其以UV-B减少明显,根据测量,温室内光合有效辐射为室外的80%—85%,UV-B透过率仅为2%—5%,UV-A透过率60%—70%。且在很多陆上植物实验也发现,UV-B具有明显抑制植物生长的作用。
因此,研究紫外辐射尤其是UV-B辐射对菹草衰亡的影响,对研究其夏初衰亡的真实原因,实现对其良好的生态管理,发挥菹草在生态修复中的优势作用,在水体生态修复过程中就显得尤其重要。
1 材料与方法
1.1 实验设计
实验地点选择在江苏省环境工程重点实验室水环境生态修复中试平台(32.11°N, 118.91°E)玻璃温室内。菹草成株采集于江苏省宿迁市沭阳县新河镇河流中,种植时植株已进入对数生长期,叶片已泛红,进入繁殖期。2012年4月15日将采集的菹草成株种植于上口直径18 cm,下口直径12.5 cm,高15 cm的花盆中,每个花盆种植约15—20株(分枝)。为减少底泥带来的营养盐差异,在花盆底部预先铺设少量泥土加碎石细沙以固着菹草植株根部。将上述种植好植株的花盆置于上口直径64 cm,高72 cm,下底直径52 cm的白色塑料桶中,桶容量为200 L,具体见图1。

图1 实验灯管、支架示意图Fig.1 Schematic diagram of the lamp, bracket
水桶正上方用120 cm不锈钢支架悬挂UV-B灯管。UV-B灯管采用南京华强特种光源厂生产的纯UV-B灯管(40 W,主峰313 nm),通过调节高度,实现所需剂量,以及保证各组光照基本一致,为减少灯罩的影响,灯管挂置方向为东西向。对照组水桶上方用125 μm聚酯薄膜(上海特翔电器绝缘材料有限公司)以过滤温室中少量的UV-B,使对照组水桶仅接受UV-A和光合有效辐射(PAR)。为防止各水桶间UV-B相互干扰,用125 μm聚酯薄膜相互隔离。
1.2 UV-B剂量设定
根据2004年及2008年南京地区4月及8月的UV-B剂量日均值作为参考,设定4个梯度UV-B剂量,对照组为0 μW/cm2,其余组水面处设定剂量分别为50、100、150、200 μW/cm2,分别记作R0、R50、R100、R150、R200,每组分别设3组平行对照。因同等功率的灯管,粗灯管发出的UV-B剂量要强于细灯管,为保证各组接受太阳光照基本一致,对照组通过调节聚酯薄膜层数及倾斜方向,50 μW/cm2、100 μW/cm2处理使用细UV-B灯管(直径14 mm),150、200 μW/cm2使用粗UV-B灯管(直径26 mm),使各处理组接受可见光基本一致。由于实验水体为自来水加人工配置营养液,故UV-B透过性较高,UV-B可透射至水底。以150 μW/cm2为例,水体表层UV-B强度为水面以上62.4%,10 cm为水体表层的54.0%,20 cm为30.5%, 30 cm仅为10.1%,40 cm、50 cm、60 cm处分别仅为水体表层的3.5%、1.4%、0.7%。
为防止UV-B对植株造成急性伤害,通过数字定时器控制照射时间,分别从低剂量短期辐射缓慢递增,最终调整到设定剂量,最终每日持续照射6 h(9:00—15:00)。
1.3 监测指标及方法
植株形态学指标如下:株高、节间距(测定第10—15个节的长度)、叶长、叶宽,并计算叶面积(叶面积=0.87×长×宽-0.2l(P<0.05)[10-11])、单株鲜重。石芽(无性繁殖体)形态:测定石芽的重量,长度及宽度,及长/宽比,长度及宽度测量方法如图2;石芽萌发及萌发苗生长状况:测定石芽的萌发率,二苗率(能萌发出二苗的石芽占总数的百分比),萌发苗的高度,叶片数、叶长、叶宽。

图2 菹草石芽测定方法示意图 Fig.2 Schematic diagram of determination method about Potamogeton crispus turion
1.4 数据分析
试验数据用Excel 软件进行统计分析及图表制作。
2 结果与分析
2.1 生长状况
从第7天开始,R100-R200组高出及接近水面部分植株叶片出现不同程度漂白死亡现象,而水下部分生长良好,各组随辐射剂量增加伤害程度增加;第16天,R150和R200组部分植株腐烂,植株根部与根系仍连接在一起,尚未断裂;第22天,R0、R50、R100组植株出现衰亡特征,断枝增多,均于根部断裂漂浮于水面上,与野外菹草衰亡特征一致,但仍少量植株未出现断根现象,第23天,据统计,3个平行处理组中,R0组存6株生长良好,其余断枝,R50组仅存2株,其余为断枝,R100存7株;第31天,R150及R200组,根部腐烂植株全部死亡腐烂,而R100组,部分植株生长状况良好,生长状况好于对照组与R50组,且水下有新分枝产生。
2.2 形态指标
2.2.1 株高
由图3可知,经16 d的辐射后,各组高度出现显著规律性,其中R0组开始为64.1 cm,开始至第24天株高持续增加,第24天增至70.6 cm,较开始时增加10.1%,第31天降至55.3 cm,较开始低13.7%,较高度最高的第24天降低21.6%;R50组开始高度为63.4 cm,第16天较开始增加0.9%,后持续降低,至第21天,降至54.3 cm,较开始低14.4%;R100组开始至第31天株高持续降低,第31天降至53.3 cm,较开始低12.8%;R150、R200组开始至第24天,高度持续降低,第24天分别较开始低22.6%、24.1%。
第16天,R0、R50组株高略有增加,分别较开始增加2.1%、0.9%,R100—R200组株高度基本一致,且较开始出现降低趋势,但差异不显著(P>0.5),分别较开始低1.6%、8.3%、2.0%,R50—R200组高度均低于R0组,分别较R0低2.2%、8.1%、8.3%、8.3%;第24天,R0组植株仍持续增高,各组较开始差异显著(P<0.05),R50—R200组随辐射剂量增加降低越显著,R50—R200分别较R0组低21.4%、22.9%、28.2%、34.1%;第31天,R150、R200组植株死亡,R0—R100组植株仍持续生长,但均较开始有所降低,较第24天降低显著(P<0.05)。
2.2.2 节间距
由图4可知,经16 d辐射后,R50—R200组节间距较开始差异显著(P<0.05),较R0组分别低59.5%、71.65%、77.4%、71.6%。第24天,植株全部进入衰老期,包括R0在内的各组均下降,较开始差异不显著(P>0.05),R50高出R0组3.8%、R100组低于R0组8.0%,R150—R200组降低更明显,分别较R0低38.7%、36.3%。第31天,R0—R100较开始差异显著(P<0.05),R50、R100组与R0组差异较小。
阿里听到阿东的声音,惊起抬头,立马呜呜地哭了开来。从他喉咙里发出的哀号有着万分的委屈。阿东上前解着阿里身上的绳子,搂着他说:“你莫怕,我回来了。你莫怕。”阿东的眼泪,滴在阿里的手背上。
R0组第16天较开始增加11.5%,第24天植株露出水面后,较开始低65.8%,第31天进入衰亡期后,较开始低80.6%;R50组自开始后节间距持续降低,第14天、第24天、第31天分别较开始低54.8%、64.5%、79.9%;R100组,第16天—24天,节间距一致,均较开始低71.5%,第31天较开始低83.9%;R150、R200自开始至第24天,节间距持续下降,分别较开始低81.2%、79.2%。

图3 UV-B对菹草成株株高的影响 Fig.3 Plant height of Potamogeton crispus affected by UV-B radiation* R0、R50、R100、R150、R200代表处理组水面处接受到UV-B剂量分别为0、50、100、150、200 μW/cm2

图4 UV-B对菹草成株节间距的影响 Fig.4 Internodal length of Potamogeton crispus affected by UV-B radiation
2.2.3 叶面积
叶面积变化如图5所示,R0组开始至第16天增加13.0%,后持续减小,第31天较开始低55.6%。R50—R200组开始至第24天后叶面积减小显著(P<0.05),第24天,较开始分别低45.1%、61.5%、59.7%、58.1%。第31天,R0—R150组较开始降低均显著(P<0.05),分别较开始低63.7%、68.4%、76.4%。
第16天,R50—R200组较R0组随剂量增加,减小越多,分别较R0组低32.7%、39.3%、47.8%、57.7%,第24天,此格局继续维持,但差异缩小。第31天,R50、R100组较R0差异较第24天有所增加,分别较R0低12.9%、11.7%。
2.2.4 单株重量
各组单株重量见图6,第16天至第31天均呈下降趋势,第16天,R50—R200组随剂量增加,较R0组降低率依次增加,分别为18.9%、22.7%、30.9%、30.9%。第24天,各组较第16天均有降低,R0—R200组分别较第16天低15.5%、23.3%、38.4%、35.0%、43.6%,但差异不显著(P>0.05),R50—R200组较R0组降低率增大,分别较R0低26.4%、43.6%、46.9%、53.9%。第31天,各组重量均降低,R0—R100组分别较第16天低42.0%、44.0%、39.3%(P>0.05),R50、R100分别较R0组低21.8%、19.2%。

图5 UV-B对菹草成株叶面积的影响 Fig.5 Leaf area of Potamogeton crispus affected by UV-B radiation
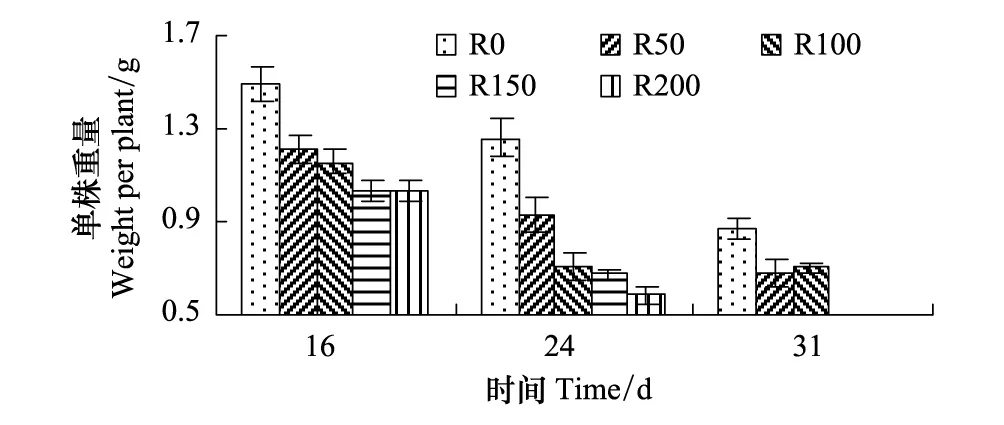
图6 UV-B对菹草成株单株重量的影响 Fig.6 Weight per plant of Potamogeton crispus affected by UV-B radiation
2.3 石芽形成及萌发苗生长状况
2.3.1 对石芽形成的影响
(1) 石芽形成数目及重量
UV-B对菹草成株形成的石芽数目无显著差异,各组形成的石芽数目基本相仿,最高为R150,3个平行组共收获15粒,其余组都为11或13粒。单个石芽重量由图8可见,其中R0组较R50与R100略低,4个辐射组随辐射剂量增大,单个石芽重量逐渐减少,其中R50最高,R200最轻,R50较R200高380.7%。
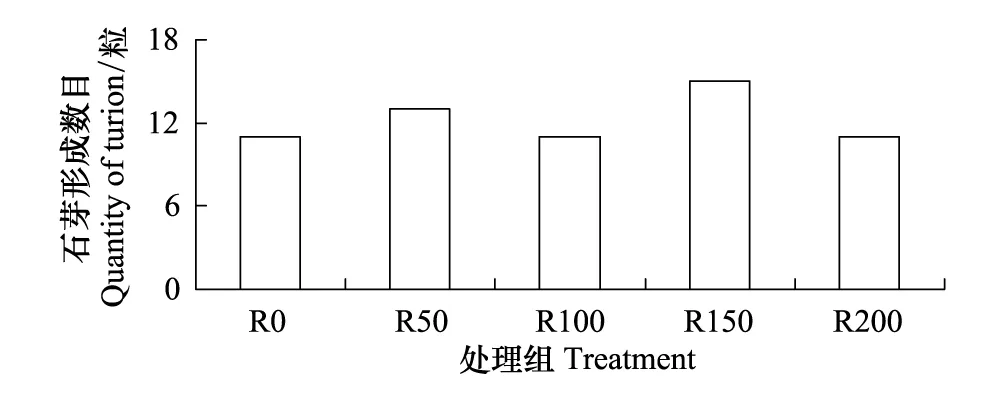
图7 UV-B辐射对成株石芽形成数目的影响 Fig.7 Number of turion of Potamogeton crispus affected by UV-B radiation

图8 UV-B辐射对成株形成石芽重量的影响 Fig.8 Weight of turion of Potamogeton crispus affected by UV-B radiation
(2) 对石芽形状的影响

图9 UV-B辐射对成株形成石芽形态指标的影响 Fig.9 Turion morphology of of Potamogeton crispus affected by UV-B radiation
由图9可见,随UV-B辐射剂量增大,菹草石芽长度增加,其中R0最低,仅1.61 cm,R200组最高,为2.42 cm,较R0高50.4%;宽度呈逐渐下降趋势,其中对照组R0最高,为1.10 cm,R200最低,为0.59 cm,R0较R200高86.4%,其中长/宽比R0—R100基本相当,R150与R200呈逐渐升高趋势,反映出石芽变异程度逐渐加剧。
2.3.2 石芽萌发率及萌发苗生长
石芽自8月底陆续萌发,10月份最多,至10月底萌发完毕,由于萌发苗最初生长基本依赖石芽的营养状况,故萌发苗的生长情况能充分反应石芽的形成状况。R0及R50、R100处理叶片翠绿,R150萌发苗发黄,多黄色斑点,R200处理组叶片全部发黄,呈营养不良状。
从石芽萌发状况来看,正常形状石芽萌发率较高,且能萌发出二苗至三苗,个别能萌发出四苗;变态石芽萌发率低,且萌发苗生长状况较差。其中R0—R100组萌发率达100%,R150、R200低于75.0%;石芽能萌发出2苗百分率,随辐射剂量增加逐渐下降,其中R0和R50可达到100%,而R200仅能达18.2%。
形成的石芽萌发苗株高与叶片数以R50最高,R0其次,R50—R200逐渐递减,R50株高与叶片数分别较R200高198.97%、100.00%;叶长、叶宽、叶面积以R0最大,R0—R200逐渐递减,3个指标R0较R200分别高32.67%、81.03%、457.51%。
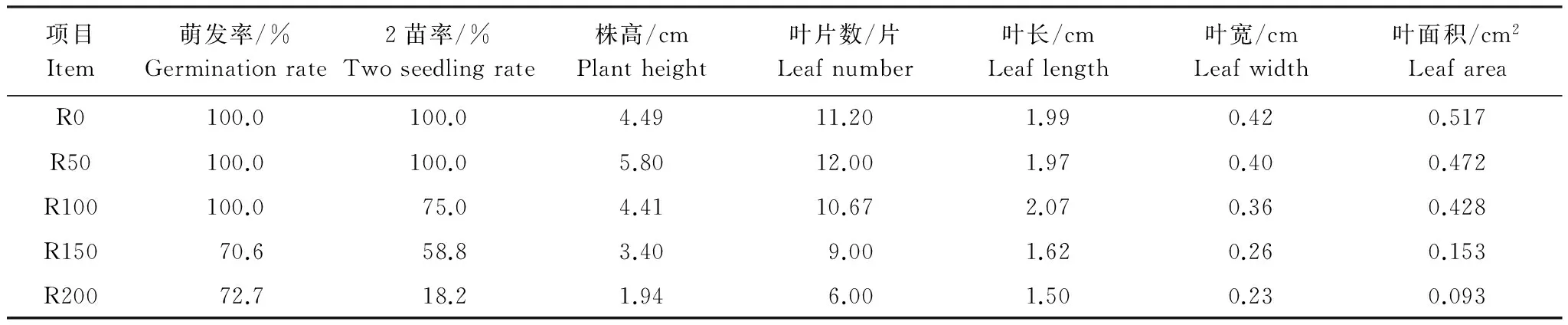
表1 形成石芽萌发率及萌发苗的生长指标
3 讨论
3.1 生长状况
研究发现,入射UV-B衰减到10%深度在南极周围的白令豪生海深度可达9 m,而在世界上最洁净的马尾藻海深度可达19.8 m[12],在北冰洋的清澈水域,可到达30 m,在南极水域甚至达到60—70 m[13]。在一些清洁湖泊中可达水下几米,甚至十几米[12]。国内张运林等人的研究表明:长江中下游湖泊中UV-B穿透深度最大分别可达2.17 m,在这些湖泊中对生物有害的紫外辐射基本上能到达湖底,其中增强的UV-B辐射不仅影响到水体里的生物,而且可能对底栖生物造成伤害[14],UV-B辐射在水体中呈指数衰减,其衰减模式符合公式:Ed=E0e-kd,式中E0为入射的UV-B强度,k为衰减系数,d为水深[15-16]。由此可见,同样水体中,入射UV-B辐射剂量越大,向水下渗透较低剂量要越多,水下同一深度接受到UV-B强度则越高,UV-B辐射对菹草的伤害就越大。因辐射自植株顶部向下,故辐射剂量越大,植株从顶端向下受到伤害的越深,在持续辐射下,植株顶端叶片受到伤害最大。因菹草生物量主要集中在植株顶端,故随辐射剂量增加,植株顶端受到伤害越大,植株各项生理机能迅速最为下降,植株生长就受到一定程度的限制,故受到UV-B持续辐射后,150 μW/cm2及200 μW/cm2处理组仅24 d处理后,植株便全部衰亡,随之腐烂。
3.2 对菹草形态指标的影响
菹草与其他克隆植物一样在不同环境条件下,其遗传特性(构件大小和生长结构)将会对环境做出相应的反应,从而在形态、生理、生物量等方面表现出一定可塑性,即表型可塑性(Phenotypic plasticity)[17],也称之为形态可塑性(Morphological plasticity)[18],同样菹草的克隆分枝有较强的适应性[19],并通过表型可塑性以适应变化的环境[20]。例如菹草在不同营养盐条件下,植株的株高、叶面积均产生不同的变化以适应环境的变化[21-22]。根据大量UV-B对陆生植物的影响研究发现,UV-B辐射能显著抑制植株生长,使植株出现矮化现象[23],除了在植株高度上有所反应外,因植株高度降低,UV-B处理还使植株节间距大为缩短,叶面积降低[24]。
在UV-B对菹草辐射实验中,菹草植株一旦接近水面,UV-B对其伤害增加,植株开始褪绿、白化,尤其在实验初始阶段,表现较出突出,因实验水体为清澈的自来水,UV-B在水体中穿透能力较自然水体要高,故随辐射剂量的增加,穿透深度增加,水下植株受到伤害程度增加,故在株高上表现出随辐射剂量增加株高依次降低的现象,但对菹草成株而言,因植株从野外采集,在野外经历过短期弱自然紫外辐射适应过程,故在实验室内对UV-B表现出一定适应能力,在16 d后,辐射处理组随株高有所降低,但区别不显著,当辐射持续进行时,第24天,形态的可塑性逐渐凸显,随剂量增加株高依次降低。
由于高剂量UV-B辐射向水下渗透较低剂量要多,故当植株顶端受到伤害时,植株各项生理机能迅速下降,植株在株高受到UV-B辐射抑制的同时,植株失去向上伸展空间,节间距也大为缩短,而对成株来说,对照组因株高稳定,向上发展缓慢,故节间距基本无变化,4个辐射处理组,向上拓展受到抑制后,节间距开始缩短;与节间距缩短相同,UV-B辐射还能对叶片的形态产生影响,植株通过减少叶面积以应对UV-B的辐射,故各组叶长、叶宽、叶面积均小于对照组,且随辐射时间延长表现越明显,特别在急性伤害时期表现更为典型,石芽的形成后,植株逐渐衰老,包括对照组在内各组叶面积也均慢慢降低,故第24天各组上述三指标大体相当,随着辐射时间延长,高剂量组R150及R200无法抵御UV-B辐射,叶面积持续降低至无法支撑植株生长,继而全部死亡。而低剂量组叶片也持续萎缩,故植株根部逐渐断裂。
由上述分析可知,因植株随辐射剂量增加伤害增加,植株高度、节间距受到抑制,植株叶片萎缩,故植株最终的鲜重随辐射剂量增加而递减。
3.3 对石芽形成及萌发的影响
菹草的立枝、侧枝的顶端4—10节在一定条件下可发生变态,茎粗硬而节间短,叶短阔而厚硬,这种变态茎上的侧芽可萌发形成新的植株,具有很强的繁殖能力,是菹草繁殖的最重要形式[25]。这种变态器官早期的文献称为鳞枝、殖芽,现大部分科研人员称其为石芽。李永函早在20世纪80年代就研究菹草石芽的形成状况,其研究结果认为,不良生境能促进菹草石芽的形成,尤其是夏初的强光照能促进石芽的形成[26]。苏胜齐的研究也表明强光照能促进菹草石芽的形成[27]。
在我国南方大部分水体观测的结果显示,水体中石芽大量形成的时期为夏初5月,而5月正是南京地区强光照中UV-B剂量为最高时期[28],由此可推断,UV-B辐射可能是菹草石芽形成的关键性因素,由于生长期大部分在野外完成,进入室内各组植株株数基本相同,植株储存的营养物质基本相当,所以即使UV-B剂量增加,植株形成石芽的数量也基本相当。且从石芽形成过程可知,石芽是茎、叶变态而成,由于UV-B剂量增加,菹草叶长、叶宽、叶面积逐渐减小,故形成石芽的宽度减少,而植株为完成石芽形成过程,通过增加石芽长度来弥补宽度的损失,故形成石芽随剂量增加,长/宽比也随之增加,但由于石芽过于细长,单个石芽重量均随长/宽比加大而依次降低。
有研究表明,重量大的石芽萌发率和萌发幼苗数保持较高水平,石芽重量和萌发结束时幼苗数目之间呈显著的线性正相关(P<0.05)[29],本研究也证实上述观点,经UV-B辐射后,随辐射剂量增加,形成石芽重量均逐渐降低。因菹草石芽萌发率、萌发幼苗数,以及萌发苗初期的生长完全依赖于石芽形成阶段储存的营养物质,石芽重量轻,变态率增加,所存储的营养物质势必减少,在下一个生长季时,体积大、重量大的石芽萌发率较高,且因存储营养物质较多,能萌发出2苗,甚至3、4苗,而变态严重的石芽因储存营养物质较少,萌发率降低,萌发苗的生长也受到限制,故造成UV-B辐射下形成的石芽萌发率随辐射剂量增加而降低,二苗率也随之降低,萌发苗各项生长指标也随之降低。
4 结论
(1)高剂量UV-B辐射加速进菹草植株衰亡速度,即使暴露在低剂量UV-B辐射条件下,植株仍然衰亡。菹草植株在株高、节间距、叶面积都受到UV-B辐射的抑制,且随UV-B辐射剂量增加,各项指标明显下降。
(2)UV-B辐射对形成石芽的数量无影响,形成的石芽随辐射剂量增加变态率增高,长度增加、宽度减少,重量减轻,下一个生长季萌发率降低,二苗率降低,萌发苗各项生长指标随辐射剂量增加逐渐降低。
致谢:感谢南京师范大学地理科学学院王国祥教授提供实验场地。
[1] Kunii H. Life cycle and growth ofPotamogetoncrispusL. in a shallow pond, ojaga-ike. The Botanical Magazine, 1982, 95(2): 109-124.
[2] Sivaci A, Elmas E, GümüF, Sivaci E R. Removal of cadmium byMyriophyllumheterophyllummichx. andPotamogetoncrispusL. and its effect on pigments and total phenolic compounds. Archives of Environment Contamination and Toxicology, 2008, 54(4): 612-618.
[3] Zhang M, Cao T, Ni L Y, Xie P, Li Z Q. Carbon, nitrogen and antioxidant enzyme responses ofPotamogetoncrispusto both low light and high nutrient stresses. Environmental and Experimental Botany, 2010, 68 (1): 44-50.
[4] 金送笛, 李永函, 倪彩虹, 王斌. 菹草对水中氮、磷的吸收及若干影响因素. 生态学报, 1994, 14(2): 168-173.
[5] 陈洪达. 菹草的生活史生物量和断枝的无性繁殖. 水生生物学报, 1985, 9(1): 32-39.
[6] Rogers K H, Breen C M. Growth and reproduction ofPotamogetoncrispusL. in a South Africa lake. Journal of Ecology, 1980, 68(2): 561-571.
[7] 金送笛, 李永函, 王永利. 几种生态因子对菹草光合作用的影响. 水生生物学报, 1991, 15(4): 295-302.
[8] 任久长, 乔建荣, 董巍, 戴长亮. 菹草(Potamogetoncrispus)的生态习性和在京密引水渠的发生规律研究. 北京大学学报: 自然科学版, 1997, 33(6): 749-754.
[9] 苏胜齐, 沈盎绿, 唐洪玉, 姚维志. 温度光照和pH对菹草光合作用的影响. 西南农业大学学报, 2001, 23(6): 532-534.
[10] 谢永宏, 于丹, 耿显华. CO2浓度升高对沉水植物菹草叶表型及生理生化特征的影响. 植物生态学报, 2003, 27(2): 218-222.
[11] 王天阳. 菹草生长与环境因子的相互影响及模拟 [D]. 南京: 南京师范大学, 2009.
[12] Ryan K G. UV radiation and photosynthetic production in Antarctic sea ice microalgae. Photochemistry and Photobiology, 1992, 13(3/4): 235-240.
[13] Smith R C, Prezelin B B, Baker K S, Bidiqare R R, Boucher N P, Coley T, Karentz D, Maclntyre S, Matick H A, Menzies D. Ozone depletion: ultraviolet radiation and phytoplankton biology in Antarctic water. Science, 1992, 255(5047): 952-959.
[14] 张运林, 秦伯强, 马荣华, 朱广伟, 陈伟民. 太湖典型草、藻型湖区紫外辐射的衰减及影响因素分析. 生态学报, 2005, 25(9): 2354-2361.
[15] 张运林, 秦伯强, 陈伟民. 增强UV-B对湖泊生态系统的影响研究. 地球科学进展, 2005, 20(1): 106-112.
[16] Ruben S. The role of solar UV radiation in the ecology of alpine lakes. Journal of Photochemistry and Photobiology B: Biology, 2001, 62(1/2): 35-42.
[17] Davidson A M, Jennions M, Nicotra A B. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis. Ecology Letters, 2011, 14(4): 419-431.
[18] Bellavance M E, Brisson J. Spatial dynamics and morphological plasticity of common reed (Phragmitesaustralis) and cattails (Typhasp.) in freshwater marshes and roadside ditches. Aquatic Botany, 2010, 93(2): 129-134.
[19] 肖克炎, 于丹. 克隆种群的有关概念在水生植物中应用和研究进展. 水生生物学报, 2008, 32(6): 920-925.
[20] Kaplan Z. Phenotypic plasticity inPotamogeton(Potamogetonaceae). Folia Geobotanica, 2002, 37(2): 141-170.
[21] 陈正勇, 王国祥, 吴晓东, 王立志, 徐伟伟, 俞振飞. 不同水深条件下菹草(Potamogetoncrispus)的适应对策. 湖泊科学, 2011, 23(6): 942-948.
[22] 陈小峰, 王庆亚, 陈开宁. 不同光照条件对菹草外部形态与内部结构的影响. 武汉植物学研究, 2008, 26(2): 163-169.
[23] Liu Q, Yao X Q, Zhao C Z, Cheng X Y. Effects of enhanced UV-B radiation on growth and photosynthetic responses of four species of seedlings in subalpine forests of the eastern Tibet plateau. Environmental and Experimental Botany, 2011, 74: 151-156.
[24] Hopkins L, Bond M A, Tobin A K. Ultraviolet-B radiation reduces the rates of cell division and elongation in the primary leaf of wheat (TriticumaestivumL.cvMarisHuntsman). Plant, Cell and Environment, 2002, 25(5): 617-624.
[25] 曾宪峰, 邱贺媛, 刘稳昌. 菹草石芽的初步研究. 生态学杂志, 1996, (1): 28-28.
[26] 李永函, 金送笛, 史进禄, 秦懿. 几种生态因子对菹草鳞枝形成和萌发的影响. 大连水产学院学报, 1989, 4(3): 1-9.
[27] 苏胜齐. 环境对菹草生长和繁殖的影响及菹草对富营养化水净化能力的研究 [D]. 重庆: 西南农业大学, 2001.
[28] 毛宇清, 姜爱军, 沈澄, 颜庭柏. 紫外线强度等级确定因子的季节性选择. 气象科学, 2010, 30(4): 516-621.
[29] 沈佳, 许文, 石福臣. 菹草石芽大小和贮藏温度对萌发及幼苗生长的影响. 植物研究, 2008, 28(4): 477-481.
Effect of ultraviolet radiation on phenotypic plasticity and turion ofPotamogetoncrispus
WANG Jinqi1,2,*, LIU Yan3, XUE Yan3,ZHENG Youfei4,WU Fangfang1
1SchoolofAppliedMeteorology,NanjingUniversityofInformationScience&Technology,Nanjing210044,China2JiangsuKeyLaboratoryofEnvironmentalChange&EcologicalConstruction,Nanjing210023,China3SchoolofEnvironmentalScienceandEngineering,NanjingUniversityofInformationScience&Technology,Nanjing210044,China4SchoolofAtmosphericPhysics,NanjingUniversityofInformationScience&Technology,Nanjing210044,China
Potamogetoncrispusis important in purifying water and maintaining a healthy aquatic ecosystems such as shallow lakes. However, mass mortality occurs inP.crispuspopulations in the late spring and early summer, which possibly results in secondary pollution. Therefore, the causes ofP.crispusmass mortality have been a very important research topic in the field of water ecological restoration. The UV-B band in the strong light is generally recognized to damage plants and animals and even to penetrate into the water column and harm aquatic organisms. Some researchers have reported that intense light is the key factor inP.crispusdecline. We carried out a series of experiments to find the effect of UV-B radiation in the strong light onP.crispusdecline. In this study, adult plants ofP.crispusare exposed to UV-B radiation in different doses (50 μW/cm2, 100 μW/cm2, 150 μW/cm2, and 200 μW/cm2) for 6 hours (9:00—15:00) every day, and the control group was exposed only to UV-A radiation and photosynthetically active radiation (PAR). Plant growth, morphological changes (plant height, internodal length, leaf area and fresh weight), turion formation (number, weight, and morphology of turion) and the germination indexes of turion were monitored. The results show that UV-B radiation can accelerate plant decline. When the exposure dose is in excess of 150 μW/cm2, the plants decline and fall within 31 days, while a few plants in the other treatment groups still grow. The tops of the plants are damaged more when they receive higher doses of UV-B radiation, so that plant height declines persistently with UV-B radiation, the internodal length is shortened by UV-B radiation, the leaf area shrinks, and the average fresh weight per plant decreases; whereas the plant height and internodal length of the control group increase till the 24thday, the leaf area also increases till the 16thday, and the average fresh weight per plant decreases gradually with increasing radiation doses. UV-B radiation had no effect on turion quantity in both the treatment and control groups, but the metamorphosis ratio of turion increases with the increasing radiation dose. When the exposure dose of UV-B radiation increases, the turion length increases, whereas the turion width and weight are reduced, the germination rate from the next growing season is reduced. The ratio of two seedlings that germinated from these turions decreases and the seedling growth indexes (germination rate, plant height, leaf number, leaf length, leaf width, leaf area, and so on) decrease and are significantly reduced especially when the exposure dose is in excess of 150 μW/cm2. The results indicate that UV-B radiation may be an important factor leading to mass mortality ofP.crispusin late spring and early summer. Accordingly, we deduce that the sharply enhanced ultraviolet radiation on the land surface in the late spring and early summer leads to mass mortality of the naturalP.crispuspopulation. However, further research is necessary to study whether UV-B radiation acts synergistically with other environmental factors on the decline ofP.crispus.
UV-B radiation; phenotypic plasticity; plant height; leaf area; turion
国家自然科学基金(41105113, 51109109); 江苏省环境演变与生态建设重点实验室开放基金资助项目; 南京信息工程大学本科生优秀毕业论文(设计)支持计划项目
2014-01-16;
日期:2014-11-19
10.5846/stxb201401160120
*通讯作者Corresponding author.E-mail: w_j_q@sina.com
王锦旗, 刘燕, 薛艳, 郑有飞, 吴芳芳.紫外辐射对菹草成株表型可塑性及石芽的影响.生态学报,2015,35(18):5984-5991.
Wang J Q, Liu Y, Xue Y,Zheng Y F,Wu F F.Effect of ultraviolet radiation on phenotypic plasticity and turion ofPotamogetoncrispus.Acta Ecologica Sinica,2015,35(18):5984-5991.

