施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响
苏 丹, 张 凯, 陈法霖, 李睿达, 郑 华
中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085
施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响
苏 丹, 张 凯, 陈法霖, 李睿达, 郑 华*
中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085
土壤微生物群落碳代谢功能既受土壤氮素水平的影响,也与土壤有机碳水平密切相关,但二者如何共同影响土壤微生物群落碳代谢功能的研究尚不多见。以我国南方广泛种植的桉树林为对象,采用野外控制实验比较研究了4种施氮处理(对照:0 kg/hm2,低氮:84.2 kg/hm2,中氮:166.8 kg/hm2,高氮: 333.7 kg/hm2)对有机碳水平差异显著的两桉树林样地土壤微生物群落碳代谢功能的影响,结果表明:(1)两种有机碳水平桉树林土壤微生物群落碳代谢强度和代谢碳源丰富度显著不同,高有机碳水平桉树林土壤微生物群落碳代谢强度和代谢碳源丰富度显著高于低有机碳水平桉树林(P<0.01);(2)施氮显著改变了桉树林土壤微生物群落的碳代谢强度和代谢碳源丰富度(P<0.05),随着施氮水平的升高,土壤微生物群落碳代谢强度和代谢碳源丰富度均呈现先增加后降低的变化规律,但是高、低有机碳水平桉树林土壤微生物群落碳代谢强度和代谢碳源丰富度对施氮梯度的响应各不相同,高、低有机碳水平桉树林的土壤微生物群落碳代谢指标分别在中氮、低氮处理中达到最高值;(3)施氮影响土壤微生物群落代谢的碳源类型主要是碳水化合物类、氨基酸类和羧酸类,土壤微生物生物量是影响土壤微生物碳代谢强度和代谢碳源丰富度的重要因素。由此可知,施氮对土壤微生物碳代谢功能影响,也与土壤本底中有机碳水平的调节有关,所以在研究土壤微生物群落对施氮等条件的响应时,不能忽略土壤中有机碳水平。
施氮; 有机碳; 微生物代谢; BIOLOG
氮素作为土壤微生物基本营养元素,影响土壤微生物的生长[1]。土壤中有效氮量的变化影响土壤微生物对氮的利用,外源氮素的添加可以通过影响土壤中有效氮含量进而影响微生物代谢。已有研究认为:施氮改善土壤中氮的缺乏,短期能促进土壤微生物活性[2-3]。另有研究却发现,施氮或者氮沉降抑制了土壤微生物活性[4],进而降低部分有机物的分解,促进碳等元素的储存[5]。同时,土壤有机碳作为土壤肥力的基本指标,也直接影响土壤微生物生长,土壤中活性碳为微生物提供能量[6-7],碳的缺乏同样会成为微生物活性限制性因素[8]而作用于土壤中养分循环。可见,碳氮对土壤微生物群落结构及功能具有重要影响,但已有研究关注施氮或氮沉降、土壤有机碳水平单方面影响较多[9-14],很少同时关注施氮水平和土壤有机碳水平对土壤微生物群落的综合影响。
桉树人工林是我国南方广泛种植的经济速生林,由于桉树生长快,对养分需求多,而导致桉树林土壤养分缺乏[15-16]。施加氮肥是维持桉树林土壤养分平衡的主要措施之一,施氮也会直接影响土壤微生物群落。与此同时,桉树林中土壤有机碳水平也会对土壤微生物群落产生影响。本研究以我国南方广泛种植的按树林为研究对象,采用野外试验的方法,探究不同土壤有机碳水平下施氮水平对桉树林土壤微生物群落碳代谢功能的影响,其目标是:揭示施氮水平对桉树林土壤微生物群落碳代谢功能的影响;明确不同有机碳水平桉树林土壤微生物群落碳代谢功能对施氮水平的响应是否一致。
1 材料及方法
1.1 研究区域
本研究野外控制实验样地设置在我国大面积(约20667 hm2)桉树人工林种植区的广西国营东门林场(107°15′ — 108°00′E, 22°17′ — 22°30′ N),该区域属于典型的亚热带季风气候,年均温22 ℃左右,年降雨量为1100—1300 mm,主要集中于6—8月。土壤为典型红壤,pH 值4.0—6.0。
1.2 实验设计
为了研究不同有机碳水平桉树林土壤微生物群落碳代谢功能对施氮的响应特征,本研究从预实验的20个样地中,选取土壤有机碳含量差异显著(P<0.01)的两个二代桉树林样地(表1),高有机碳样地(HC):有机碳含量14.80 g/kg;低土壤有机碳样地(LC):有机碳含量12.89 g/kg),开展野外实验。然后,依据当地常规施氮水平,在每个样地中进行4个施氮(脲甲醛)处理:对照(CK)0 kg /hm2,低氮(LN)84.2 kg /hm2,中氮(MN)166.8 kg /hm2(当地常规施氮水平)和高氮(HN)333.7 kg / hm2,每个处理有3个重复,每个样地12个10 m× 10 m的样方,每个样方之间间隔5 m。依照当地施肥方式实施穴施。施氮时间为2013年5月20日,取样时间为2013年8月26日。采集0—20 cm处土壤,储存在4 ℃冰箱中。并在一周之内进行指标测定。

表1 土壤基本性质
1.3 土壤理化性质测定
土壤理化性质测定参考土壤农化分析[17]。土壤总碳,总氮使用元素分析仪测定(Vario EL III,Elementar, Germany),有机碳含量用重铬酸钾滴定法(LYT 1237—1999),土壤pH值采用土水比为1∶2.5的方法测定。
1.4 土壤微生物生物量碳测定
土壤微生物量碳采用氯仿熏蒸法-K2SO4法进行测定[18-19]。提取的有机碳用Liqui TOC II分析仪(Elementar,Germany)测定。
1.5 土壤微生物群落碳代谢功能测定
土壤微生物群落碳代谢功能采用BIOLOG微平板培养法测定:称取相当于10 g干重的鲜土加90 mL无菌的0.85%NaCl溶液,振荡30 min后,将土壤样品稀释至10-3,再用移液器取150 μL悬浊液接种到BIOLOG-ECO板上。并置于25 ℃恒温箱中培养10 d,每12 h在BIOLOG 微生物自动分析系统测定590 nm波长处的光密度值。
孔平均颜色变化率(AWCD)计算方法[20]
(1)
式中,C为反应孔的光密度值,R为对照孔的光密度值。n为ECO板31种碳源。
采用曲线拟合的方法估算碳源代谢强度:
(2)
式中,Vi为i时刻的AWCD值。
碳源利用丰富度指数为培养84 h后,C-R>0.25的孔的个数。
1.6 数据分析
数据采用SPSS16.0软件分析,使用一般线性模型(GLM),通过两因素方差分析说明不同处理间的土壤微生物代谢差异,主成分分析(PCA)方法分析土壤微生物群落碳源利用类型,并采用Excel作图。
2 结果
2.1 施氮及不同有机碳对土壤微生物群落碳代谢强度及代谢碳源丰富度的影响
施氮水平显著影响土壤微生物群落碳代谢强度(P<0.01)和代谢碳源丰富度(P<0.05)(图1,图2),随着施氮水平的提高,土壤微生物群落碳代谢强度、代谢碳源丰富度均表现出先增加后降低的趋势。
土壤有机碳水平也显著影响土壤微生物群落碳代谢强度(P<0.01)和代谢碳源丰富度(P<0.01)(图1,图2),高有机碳水平样地的土壤微生物群落碳代谢强度、代谢碳源丰富度均显著高于低有机碳水平样地(P<0.01)。

图1 土壤微生物群落代谢碳源丰富度 Fig.1 Carbon metabolic richness of the soil microbial communities * 表示在P<0.05水平上差异显著,**表示在P<0.01.水平上差异显著;不同字母代表各指标之间差异显著; 图例N代表施氮处理,C为不同有机碳水平, N× C 代表碳氮之间的交互作用,用以表示处理的显著与否;CK: 对照0 kg/hm2,LN: 低氮84.2 kg/hm2,MN: 中氮166.8 kg/hm2,HN:高氮 333.7 kg/hm2
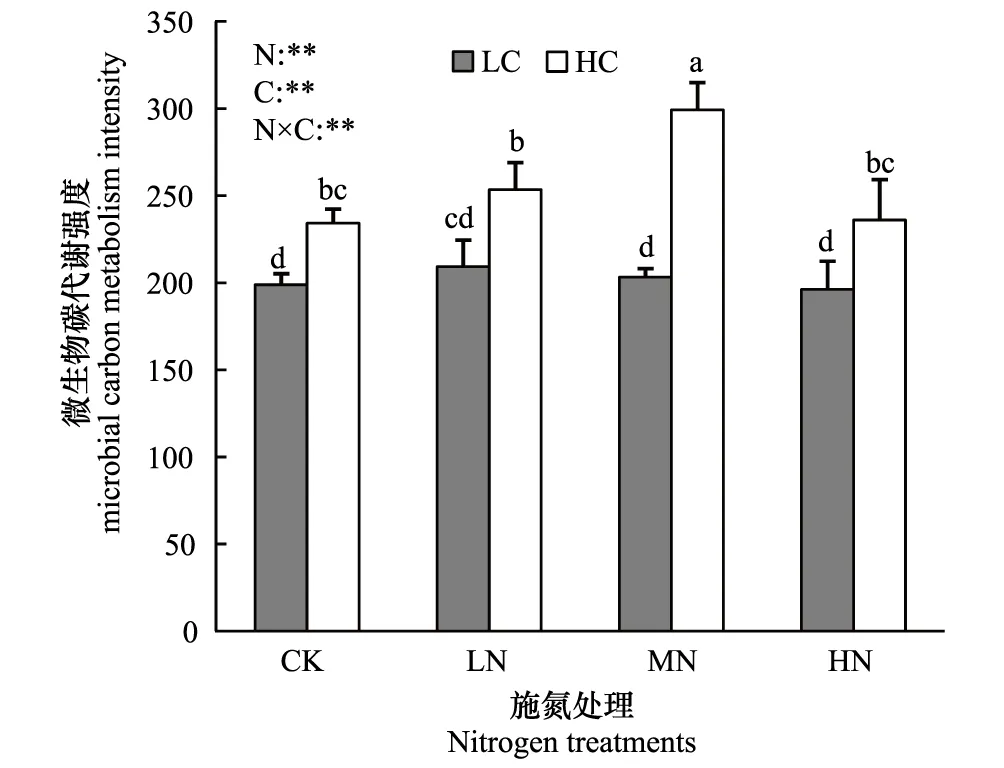
图2 土壤微生物群落碳源代谢强度 Fig.2 Carbon metabolic intensity of the soil microbial communities
施氮水平与土壤有机碳水平对土壤微生物群落碳代谢强度和代谢碳源丰富度的影响存在显著的交互作用(P<0.01)(图1,图2),在高有机碳水平样地中,中氮水平处理的土壤微生物群落碳代谢强度和代谢碳源丰富度显著高于其它氮素水平处理(P<0.05);而在低有机碳水平样地中,低氮水平处理的土壤微生物群落碳代谢强度和代谢碳源丰富度高于其它氮素水平处理,但差异不显著(图1,图2)。
2.2 处理条件下土壤微生物群落代谢碳源特征
不同施氮水平和不同土壤有机碳水平下土壤微生物群落碳源利用特征显著不同,主成分1(PC1)可以解释碳源利用50%的变异(图3)。不同施氮水平处理、不同有机碳水平处理在PC1上的得分分别在P<0.05、P<0.01水平上差异显著,且中施氮水平、高有机碳水平的处理组合在PC1上的得分显著高于其他处理组合(P<0.05)。

图3 土壤微生物碳源利用类型主成分分析Fig.3 Principal component analysis of carbon utilization profiles by soil microbial○ LC低有机碳水平样地,● HC高有机碳水平样地
相关分析进一步表明:21种碳源的吸光值与PC1得分值相关显著(P<0.05),对PC1起到分异作用的碳源类型主要是碳水化合物类、氨基酸类和羧酸类碳源(表2)。
2.3 土壤微生物代谢影响因素
土壤微生物生物量碳分别与土壤微生物群落碳代谢强度、代谢碳源丰富度均呈显著正相关关系,相关系数分别为0.845(P<0.01)和0.792(P<0.05)(图4)。可见土壤微生物生物量是影响土壤微生物群落代谢强度和代谢碳源丰富度的重要因素之一。
3 讨论
外源氮素可以影响土壤有机物的组成[21],改变有机物在土壤微生物食物链中的流通,进而影响土壤微生物的代谢活性[22-24]。本研究也发现施氮水平对土壤微生物群落代谢强度和代谢碳源丰富度有显著影响,随着施氮水平的增加,土壤微生物群落代谢强度和代谢碳源丰富度呈现先增加后降低的变化趋势(图1,图2),产生这种变化规律的原因可能是:(1)在氮含量较低的土壤中,产生氮限制,施氮改善有效氮含量,缓解了氮的限制,而促进土壤微生物碳代谢功能。Craine等实验发现施氮条件下,在低有效氮含量时,微生物的分解作用增加[25],而促进参与代谢分解的酶的活性增加[26],本实验中较低氮的施加处理中表现的结果可能因为上述原因。(2)当施氮含量较高,土壤中有效氮含量较高,反而抑制土壤中微生物活性。Campbell等实验发现氮的添加改变了土壤中细菌群落结构[27],土壤酸碱度[28]进而造成部分微生物代谢活性降低[29-31]。 而Mo 等对中国广东常绿林研究发现与本实验相似的结果,施氮量达到饱和并没有显著影响土壤中微生物对凋落物等的代谢[32]。

表2 与主成分1得分值显著相关的碳源

图4 土壤微生物生物量碳与代谢强度及代谢碳源丰富度相关分析Fig.4 Relationship of microbial biomass carbon and microbial carbon metabolic ability
不同有机碳水平桉树林土壤微生物群落碳代谢强度及代谢碳源丰富度差异显著(P<0.01),高有机碳水平桉树林土壤微生物群落代谢高于低有机碳水平桉树林,这可能与高有机碳水平桉树林具有显著高的土壤微生物生物量密切相关,本研究表明土壤微生物群落碳代谢强度及代谢碳源丰富度均与土壤微生物生物量碳呈显著正相关关系(图4)。可能是因为本实验测定方法测定的活性微生物生物量碳[18,33],从而与土壤微生物代谢活性表现较为一致;而另一方面微生物量碳是土壤肥力指标之一,可以指示土壤活性,即反映了土壤中可利用有机碳的变化,而土壤中可利用的有机碳影响土壤微生物活性[6,34],从而土壤中微生物代谢活性与土壤微生物量变化呈正相关关系,这一研究结果与郑华等的研究结果相似[35]。
本实验发现:施氮水平和土壤有机碳水平对微生物群落碳代谢功能有显著的交互作用(P<0.01)(图1,图2):在高有机碳水平、中氮处理上,微生物群落碳代谢强度及代谢碳源丰富度显著高于其它处理;而在低有机碳水平土壤中,低氮处理上土壤微生物群落碳代谢强度及代谢碳源丰富度最高,尽管差异不显著。可见,土壤微生物群落对施氮的响应,受到土壤中有机碳水平的影响,土壤有机碳含量能调节施氮条件下有效氮含量,进而促进土壤微生物的对氮利用效率[36]。其原因可能是:外源氮素虽然缓解了氮的限制,但是由于低有机碳水平土壤中有效碳缺乏,微生物生长代谢仍受到碳的限制[7]。而有机碳高的土壤中,微生物生长对氮的需求也高[37],因而在本实验中表现出低、高有机碳水平土壤中,微生物群落碳代谢在分别在低氮,中氮处理上有高峰值。
此外土壤碳氮比是调节土壤微生物活性的关键因子之一,一方面土壤中碳氮比变化影响土壤中微生物量碳氮比,从而影响土壤微生物主导群落变化,而影响土壤微生物代谢能力的变化;另一方面土壤碳氮比变化,影响土壤中有机物的质量——有机物碳氮比,从而影响土壤微生物对底物的分解效率,而影响土壤微生物的代谢功能[38-40]。但是施氮影响土壤中氮素含量进而影响土壤中碳氮比,从而影响土壤微生物代谢功能。土壤中当土壤中碳氮比较高时,土壤中氮可能成为土壤微生物生长的制约因素,而氮素添加后,土壤碳氮比增加,可能从一定程度上缓解了氮对土壤微生物的限制[8],从而影响土壤中微生物活性。表现出碳氮之间相互作用对土壤代谢能力的显著影响。
本研究表明,施氮水平和土壤有机碳水平均对土壤微生物群落碳代谢功能产生显著影响,因此在研究施氮水平对土壤微生物群落代谢功能影响的同时,不能忽略土壤有机碳水平对微生物群落代谢功能的影响,只有综合考虑两方面的影响,才能充分了解土壤微生物群落在土壤养分周转的作用。本研究借助BIOLOG培养方法研究了施氮水平和土壤有机碳水平对土壤碳代谢功能的影响,BIOLOG微平板培养方法虽然能快速培养微生物,但是并不能代表生态系统全部的底物[41-42],所以具体的影响机理尚需结合微生物呼吸及土壤中胞外酶活性等因素的变化阐释。
[1] Xue J H, Mo J M, Li J, Li D J. The short-term response of soil microorganism number to simulated nitrogen deposition. Guihaia, 2007, 27(2): 174-179.
[2] Micks P, Aber J D, Boone R D, Davidson E A. Short-term soil respiration and nitrogen immobilization response to nitrogen applications in control and nitrogen-enriched temperate forests. Forest Ecology and Management, 2004, 196(1): 57-70.
[3] Lovell R, Jarvis S, Bardgett R. Soil microbial biomass and activity in long-term grassland: effects of management changes. Soil Biology and Biochemistry, 1995, 27(7): 969-975.
[4] Lee K H, Jose S. Soil respiration, fine root production, and microbial biomass in cottonwood and loblolly pine plantations along a nitrogen fertilization gradient. Forest Ecology and Management, 2003, 185(3): 263-273.
[5] Freeman C, Ostle N, Kang H. An enzymic ‘latch’on a global carbon store. Nature, 2001, 409(6817): 149-149.
[6] Fontaine S, Bardoux G, Abbadie L, Mariotti A. Carbon input to soil may decrease soil carbon content. Ecology Letters, 2004, 7(4): 314-320.
[7] Fontaine S, Bardoux G, Benest D, Verdier B, Mariotti A, Abbadie L. Mechanisms of the priming effect in a savannah soil amended with cellulose. Soil Science Society of America Journal, 2004, 68(1): 125-131.
[8] Aber J D, Nadelhoffer K J, Steudler P, Melillo J M. Nitrogen saturation in northern forest ecosystems. BioScience, 1989, 39(6): 378-386.
[9] 邓小文, 韩士杰. 氮沉降对森林生态系统土壤碳库的影响. 生态学杂志, 2007, 26(10): 1622-1627.
[10] 方华, 莫江明. 氮沉降对森林凋落物分解的影响. 生态学报, 2006, 26(9): 3127-3136.
[11] 刘恩科, 赵秉强, 李秀英, 姜瑞波, 李燕婷, So H B. 长期施肥对土壤微生物量及土壤酶活性的影响. 植物生态学报, 2008, 32(1): 176-182.
[12] Bragazza L, Freeman C, Jones T, Rydin H, Limpens J, Fenner N, Ellis T, Gerdol R, Hájek M, Hájek T, Lacumin P, Kutnar L, Tahvanainen T, Toberman H. Atmospheric nitrogen deposition promotes carbon loss from peat bogs. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(51): 19386-19389.
[13] Keeler B L, Hobbie S E, Kellogg L E. Effects of long-term nitrogen addition on microbial enzyme activity in eight forested and grassland sites: implications for litter and soil organic matter decomposition. Ecosystems, 2009, 12(1): 1-15.
[14] 薛立, 邝立刚, 陈红跃, 谭绍满. 不同林分土壤养分、微生物与酶活性的研究. 土壤学报, 2003, 40(2): 280-285.
[15] 陈少雄. 桉树人工林土壤养分现状与施肥研究. 桉树科技, 2009, 26(1): 52-63.
[16] 廖观荣, 李淑仪, 蓝佩玲, 廖新荣, 王尚明, 杨国清, 简明, 李宏. 桉树人工林生态系统养分循环与平衡研究 Ⅰ. 桉树人工林生态系统的养分贮存. 生态环境, 2003, 12(2): 150-154.
[17] 鲍士旦. 土壤农化分析 (第三版). 北京: 中国农业出版社: 2005.
[18] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703-707.
[19] 陈法霖, 郑华, 阳柏苏, 欧阳志云, 张凯, 屠乃美. 外来种湿地松凋落物对土壤微生物群落结构和功能的影响. 生态学报, 2011, 31(12): 3543-3550.
[20] 陈法霖, 郑华, 阳柏苏, 欧阳志云, 张凯, 肖燚, 屠乃美. 中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响. 生态学报, 2011, 31(11): 3027-3035.
[21] Thomas D C, Zak D R, Filley T R. Chronic N deposition does not apparently alter the biochemical composition of forest floor and soil organic matter. Soil Biology and Biochemistry, 2012, 54: 7-13.
[22] Janssens I A, Dieleman W, Luyssaert S, Subke J A, Reichstein M, Ceulemans R, Ciais P, Dolman A J, Grace J, Matteucci G, Papale D, Piao S L, Schulze E D, Tang J, Law B E. Reduction of forest soil respiration in response to nitrogen deposition. Nature Geoscience, 2010, 3(5): 315-322.
[23] DeForest J L, Zak D R, Pregitzer K S, Burton A J. Atmospheric nitrate deposition and the microbial degradation of cellobiose and vanillin in a northern hardwood forest. Soil Biology and Biochemistry, 2004, 36(6): 965-971.
[24] Hobbie S E, Eddy W C, Buyarski C R, Adair E C, Ogdahl M L, Weisenhorn P. Response of decomposing litter and its microbial community to multiple forms of nitrogen enrichment. Ecological Monographs, 2012, 82(3): 389-405.
[25] Craine J M, Morrow C, Fierer N. Microbial nitrogen limitation increases decomposition. Ecology, 2007, 88(8): 2105-2113.
[26] Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315.
[27] Campbell B J, Polson S W, Hanson T E, Mack M C, Schuur E A G. The effect of nutrient deposition on bacterial communities in Arctic tundra soil. Environmental Microbiology, 2010, 12(7): 1842-1854.
[28] Biederbeck V O, Curtin D, Bouman O T, Campbell C A, Ukrainetz H. Soil microbial and biochemical properties after ten years of fertilization with urea and anhydrous ammonia. Canadian Journal of Soil Science, 1996, 76(1): 7-14.
[29] Waldrop M P, Balser T C, Firestone M K. Linking microbial community composition to function in a tropical soil. Soil Biology and Biochemistry, 2000, 32(13): 1837-1846.
[30] Waldrop M P, Zak D R, Sinsabaugh R L. Microbial community response to nitrogen deposition in northern forest ecosystems. Soil Biology and Biochemistry, 2004, 36(9): 1443-1451.
[31] Griepentrog M, Bodé S, Boeckx P, Hagedorn F, Heim A, Schmidt M W I. Nitrogen deposition promotes the production of new fungal residues but retards the decomposition of old residues in forest soil fractions. Global Change Biology, 2014, 20(1): 327-340.
[32] Mo J M, Brown S, Xue J H, Fang Y T, Li Z A. Response of litter decomposition to simulated N deposition in disturbed, rehabilitated and mature forests in subtropical China. Plant and Soil, 2006, 282(1/2): 135-151.
[33] 林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进. 生态学杂志, 1999, 18(2): 63-66.
[34] 薛菁芳, 高艳梅, 汪景宽, 付时丰, 祝凤春. 土壤微生物量碳氮作为土壤肥力指标的探讨. 土壤通报, 2007, 38(2): 247-250.
[35] 郑华, 欧阳志云, 王效科, 方治国, 赵同谦, 苗鸿. 不同森林恢复类型对土壤微生物群落的影响. 应用生态学报, 2004, 15(11): 2019-2024.
[36] Rowe E C, Emmett B A, Frogbrook Z L, Robinson D A, Hughes S. Nitrogen deposition and climate effects on soil nitrogen availability: influences of habitat type and soil characteristics. Science of the Total Environment, 2012, 434: 62-70.
[37] Burger M, Jackson L E. Microbial immobilization of ammonium and nitrate in relation to ammonification and nitrification rates in organic and conventional cropping systems. Soil Biology and Biochemistry, 2003, 35(1): 29-36.
[38] Garcia-Pausas J, Paterson E. Microbial community abundance and structure are determinants of soil organic matter mineralisation in the presence of labile carbon.Soil Biology and Biochemistry, 2011, 43(8): 1705-1713.
[39] Frey S D, Knorr M, Parrent J L, Simpson R T. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests. Forest Ecology and Management, 2004, 196(1): 159-171.
[40] Compton J E, Watrud L S, Porteous L A, DeGrood S. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest. Forest Ecology and Management, 2004, 196(1): 143-158.
[41] 胡婵娟, 刘国华, 吴雅琼. 土壤微生物生物量及多样性测定方法评述. 生态环境学报, 2011, 20(6/7): 1161-1167.
[42] Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods, 1999, 36(3): 203-213.
Effects of nitrogen application on carbon metabolism of soil microbial communities in eucalyptus plantations with different levels of soil organic carbon
SU Dan, ZHANG Kai, CHEN Falin, LI Ruida, ZHENG Hua*
StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China
Soil microorganisms are involved in the turnover of soil nitrogen and other soil nutrients.. Nitrogen and carbon, two basic elements utilized by soil microbial communities, directly influence the structure and function of these communities. However, few studies have focused on the combined effects of nitrogen application and soil organic carbon level on soil microbial communities. In this study, we conducted field experiments with four different nitrogen applications (control, CK): 0 kg/hm2; low application nitrogen level, LN:84.2 kg/hm2; middle application nitrogen level, MN: 166.8 kg/hm2; high application nitrogen level, HN: 333.7 kg/hm2) in two Eucalyptus plantation sites with significantly different soil organic carbon levels (low organic carbon site, LC and high organic carbon site, HC) in Guangxi, southern China. We identified the compound effects of nitrogen application level and soil organic carbon level on soil microbial function by using the BIOLOG method. The results showed that (1) carbon metabolism of soil microbial communities responds positively to soil organic carbon levels. Carbon metabolism intensity and richness of soil microbial communities in HC sites were significantly higher than those in LC sites (P< 0.01). (2) Carbon metabolism of soil microbial communities was significantly influenced by the nitrogen application level (P< 0.05). With the increase in nitrogen level, carbon metabolism intensity and richness of soil microbial communities increased gradually and then decreased gradually. However, carbon metabolism intensity and richness of soil microbial communities in Eucalyptus plantations with different soil organic carbon levels had significantly different responses to nitrogen application. The maximum carbon metabolism intensity and richness of soil microbial communities were observed in the HC site with MN application; this was also observed in the LC site with the LN level. The interactive effects of nitrogen application level and soil organic carbon level on soil carbon metabolism is significant (P<0.01). (3) The main metabolized carbon sources of soil microbial communities, which differentiated the responses of soil microbial carbon function according to nitrogen application level, were carbohydrates, amino acids, and carboxylic acids. Carbon in the soil microbial biomass was positively correlated with carbon metabolism intensity and richness index of soil microbial communities. Our results suggest that not only nitrogen levels but also soil organic carbon levels influence soil microorganism carbon source utilization, and soil organic carbon level cannot be neglected in analyzing the effects of nitrogen application level on soil microorganism community metabolism.
nitrogen application level; soil organic carbon level; soil microbial carbon metabolism; BIOLOG
国家自然科学基金(31170425); 中国科学院知识创新工程重要方向项目(KZCX2-EW-QN406)
2014-01-12;
日期:2014-11-19
10.5846/stxb201401120084
*通讯作者Corresponding author.E-mail: zhenghua@rcees.ac.cn
苏丹, 张凯, 陈法霖, 李睿达, 郑华.施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响.生态学报,2015,35(18):5940-5947.
Su D, Zhang K, Chen F L, Li R D, Zheng H.Effects of nitrogen application on carbon metabolism of soil microbial communities in eucalyptus plantations with different levels of soil organic carbon .Acta Ecologica Sinica,2015,35(18):5940-5947.

