中国制药企业欧盟GMP 认证现状分析
郝晓芳,李鹏飞
(华北制药河北华民药业有限责任公司,河北 石家庄 052165)
2011 年3 月1 日,我国《药品生产质量管理规范(2010 年修订)》正式实施[1],执行标准基本等同于欧盟药品生产质量管理规范(GMP)。2012 年2 月,国务院发布的《国家药品安全“十二五”规划》[2],明确提出对已经达到国际水平的制药企业,在药品定价、招标采购、医保报销等方面给予支持。从近两年各省、市的药品招标采购情况来看,该项政策已得到不同程度的落实。因此,从理论上分析,由于国内政策及法规变化的驱动,国内药品生产企业进行国外高端GMP 认证的能力及动力均应有所提升。笔者通过分析中国制药企业通过欧盟GMP 认证的实际数据,分析行业当前在国际高端GMP 认证方面的有关情况,为行业发展提供参考。
1 欧盟GMP 简介
欧盟作为欧洲国家的政治经济联合体,在医药产品方面也采取了相应的统一管理措施。Eudralex 是欧盟发布的一系列关于药物管理的规则和规章,共10 册,其中第4 册是关于GMP 的有关要求。第1 版欧盟GMP 发布于1989 年,现已经过1992 年、2004 年、2005 年及2010 年4 次修订。
欧盟GMP 依据2003 /94/EC 号指令(关于人用药)及91/412 /EEC 号指令(关于兽用药)制订,共分3 个部分:第1 部分为药品生产的基本要求,介绍了药品生产中采用GMP 管理的基本原则;第2 部分为原料药生产的基本要求,基于原料药生产与制剂生产的差异,对原料药生产过程相关的GMP 管理提出更加明确的要求;第3 部分为GMP 相关的指南文件,表明了药政当局对于企业实施GMP 的预期。
欧盟共有28 个成员国,为了在欧洲范围内共享药品注册批准、GMP 认证、不良反应等信息,由欧洲药品管理局(EMA)负责,所有欧盟国家药品监管当局共同参与建立和完善了欧盟远程信息管理系统。该远程信息管理系统由临床研究信息(Eudra CT)、欧洲内药品的研发、批准及生产情况(Eudra Data Warehouse)及药品生产发运管理(Eudra GMDP)等11 个信息版块组成,通过其中的Eudra GMDP 网站便可查询到所有欧盟GMP 及药品发运质量管理规范(GDP)认证情况。
2 数据查询情况概述
2014 年8 月21 日,通过Eudra GMDP 网站GMP 证书数据库查询[3],共获得261 条关于中国企业欧盟GMP 认证的情况记录,其中10 条是系统内的重复性录入,5 条是中国澳门企业记录,2条是中国香港企业记录,19 条中的企业名称和所链接证书中企业名称不匹配,剩余225 条是中国大陆制药企业欧盟GMP 认证情况的有效信息,其中包含17 条不符合性记录。考虑到本次研究的重点是企业通过认证的情况,因此只对208 条符合性认证结果进行分析。
3 中国药企通过欧盟GMP 认证情况分析
认证情况见图1 至图4。由于每条查询结果均对应GMP 证书,因此208 条欧盟GMP 符合性结果对应有208 份欧盟GMP 证书,其中单个企业证书数量达到7 个的只有1 家,另有2 家拥有4 个证书,12 家拥有3 个证书,29 家拥有2 个证书,剩余99 家拥有1 个证书。
4 讨论
4.1 中欧药品生产交流合作持续增长
目前,中国制药企业进行欧盟GMP 认证的情况主要分为2种,1 种是原料药的GMP 认证,另1 种是作为国外制剂产品的生产场地进行认证。根据欧盟的相关法律法规,无论哪种情况,认证的发起方均为欧洲当地的制剂上市许可持有人或生产商。因此,2010 年后中国制药企业获得欧盟GMP 证书的数量持续增加,充分说明欧洲市场对中国生产原料药及制剂的需求在不断增加,中国制药企业迎来“走出去”发展的良好机遇期。从另一方面看,中国制药企业经过过去十几年出口原料药的经验积累,对国外的药品生产质量管理体系有了比较深入的认识,加之中国新版GMP的实施,国内制药企业GMP 管理体系的完善程度和实施水平明显改善,通过国际高端GMP 认证的能力显著提高。
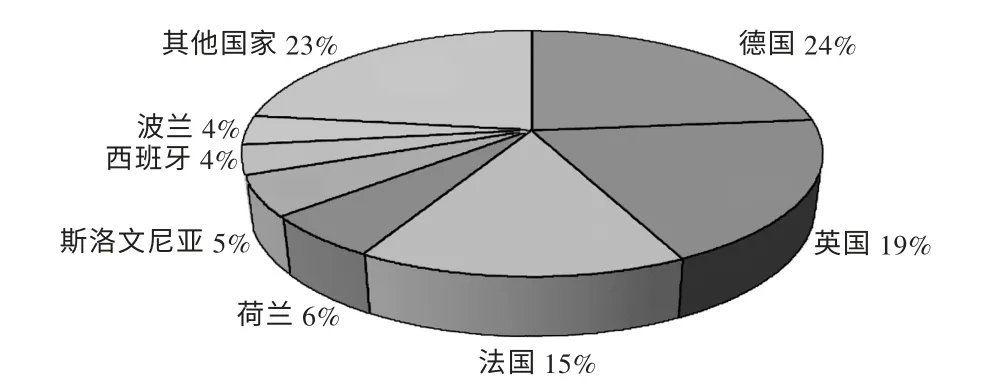
图1 中国制药企业欧盟认证国家分布

图2 中国制药企业欧盟GMP 认证年份分布

图3 通过欧盟GMP 的中国制药企业地区分布

图4 通过欧盟GMP 的剂型分布
4.2 中国制药企业产品结构调整的效果逐步显现
在通过欧盟GMP 认证的产品剂型分布方面,非无菌原料药占绝对优势,说明我国的药品出口仍以普通原料药为主;制剂直接供给患者使用,出现质量投诉的风险大,质量管理体系要求更加严格,因此较原料药的出口发展缓慢。但从进一步数据分析仍可以看到,从2012 年开始,中国通过欧盟GMP 认证的制剂生产企业数量明显增多,2007 年仅有2 家,2012 年10 家,2013 年23 家,2014 年8 月达到19 家。这一方面说明企业进行产品结构调整的效果正在逐步显现,部分企业已经开始由生产附加值低的原料药转向附加值较高的制剂产品;另一方面说明中国制药企业的GMP 实施水平确实在提高,敢于向管理要求更高的制剂生产发起挑战。
4.3 中国制药企业的出口认证存在明显的地区差异
由于中国地域辽阔,东西部经济发展不平衡,制药行业在国内各省份的发展也不平衡。浙江、江苏等地由于地处东部沿海地区,信息、技术、人才资源相对丰富,加之企业领导在发展战略及规划方面有所建树,两省制药行业的发展在国内遥遥领先,拥有江苏恒瑞、浙江海正、浙江华海等一批外向型发展业绩突出的企业。而华北地区的河北和山东,由于有华北制药、石药集团、齐鲁制药等传统大型制药企业,获得欧盟GMP 证书的情况明显好于除江浙及广东以外的省份,尤其是齐鲁制药,通过认证的品种范围不仅包括多种原料药,还包括无菌制剂。以上现象说明,国内制药企业的出口发展仍在延续传统的地区强弱格局,但在当前信息技术、物流运输极大发展的形势下,地域差异已不再是阻碍企业发展的关键因素。相反,内地企业有人力成本和资源方面的优势,在同等质量管理水平下,或许能实现更好的成本控制优势。中国虽有较大的内需市场,但面对监管持续变严、价格政策不断紧缩的局面,国内药品行业竞争同样惨烈。因此,如何规划企业发展,抓住机遇参与制药产业链的全球分工,更是目前发展相对落后的地区及企业应该关注的问题。
4.4 中国制药企业真正的国际化发展任重道远
纵观全球的制药巨头,无论是美国的辉瑞,还是欧洲的葛兰素史克、诺华等,都在全球范围内拥有庞大的制剂产品生产网络和销售网络;即使是后起之秀印度,国际化发展比较成功的Dr.Reddy's 及Ranbaxy 等公司[4],也在仿制药的全球注册和销售方面取得了明显成功。而中国制药企业目前仍以原料药出口为主,处于药品生产供应链的最末端,附加值低,且生产过程需要消耗大量的资源,污染严重。可喜的是,江苏恒瑞、浙江海正等企业的制剂产品国际化战略已经起步,江苏恒瑞侧重创新,一类新药国内外同步注册;海正则依托传统的特色原料药出口优势稳扎稳打,推进相关品种的仿制药国际注册和场地GMP 工作,着力建设产业链供应式的产品出口结构。中国制药企业虽然迎来产业链全球调整的良好机遇,但由于国际药品市场竞争同样激烈,且欧美等发达国家的海外审计及监管日益趋严,中国制药企业实现真正的国际化发展依然任重道远。
[1] 国家食品药品监督管理总局. 关于实施《药品生产质量管理规范(2010 年修订)》有关事宜的公告(2011 年第19 号)[EB/OL].[2014-08-21].http:/ /www.sda.gov.cn/WS01/CL0087/59027.html.
[2] 国家食品药品监督管理总局,国务院关于印发国家药品安全“十二五”规划的通知(国发[2012] 5 号)[EB/OL] . [2014 -08 -21] .http:/ /www.sda.gov.cn/WS01 /CL0100 /69672.html.
[3] European Commission.EU Guidelines to Good Manufacturing Practice to Medicinal Products for Human and Veterinary Use-Introduction[EB/OL] . [2014 -08 -21] . http:/ /ec.europa. eu/health/documents/eudralex/vol-4 /index_en. htm.

