杜仲叶提取物滴丸质量控制及稳定性考察*
王柏强,刘 福,江承平,何效平,曾芝兰
(1. 川北医学院附属医院药剂科,四川 南充 637000; 2. 川北医学院药学院,四川 南充 637000)
杜仲叶提取物滴丸是将杜仲叶经提取、纯化后再利用固体分散技术制备的滴丸制剂[1],是《卫生部药品标准·中药成方制剂(第11 册)》收载的杜仲平压片[2]的改剂型品种,具有服用剂量小、速效、携带方便等优点,能降血压、强筋健骨,主要用于高血压、头晕目眩、腰膝酸痛、筋骨痿软等证[3]。为了有效地控制该制剂质量,保证临床疗效,本试验中采用薄层色谱(TLC)法对制剂中的绿原酸进行了定性鉴别,同时采用高效液相色谱(HPLC)法对制剂中绿原酸进行了含量测定,并对其在室温和加速条件下的稳定性进行了考察[4]。现报道如下。
1 仪器与试药
SPD-10A 型高效液相色谱仪(日本岛津公司);SPD-10A 型紫外检测器(日本岛津);溶剂过滤器(大连依利特科学仪器有限公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市英峪予华仪器厂);TP-114 型电子分析天平(德国赛多利斯股份有限公司);760CRT 型双光束可见分光光度计(北京普析通用仪器有限公司)。绿原酸对照品(中国药品生物制品检定所,批号为0753 -200111);杜仲叶提取物滴丸(自制,批号分别为050926,050927,050928);乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 薄层色谱鉴别
取杜仲叶对照药材1 g,加50%甲醇25 mL,于50 ℃超声提取1 h,放冷,滤过,滤液作为对照药材溶液。称取绿原酸对照品适量,加50%甲醇制成每1 mL 含1 mg 的溶液,作为对照品溶液。取20 粒杜仲叶提取物滴丸研细,称取约0.2 g,加50%甲醇5 mL 溶解,作为供试品溶液。照2010 年版《中国药典(一部)》附录ⅥB 薄层色谱法试验,分别吸取供试品溶液及对照药材溶液各10 μL、对照品溶液5 μL,点于同一以羧甲基纤维素钠为黏合剂的硅胶G 薄层板上,以醋酸丁酯-甲酸-水(7 ∶2.5 ∶2.5)的上层溶液为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视[5]。供试品溶液色谱中,在与对照品及对照药材溶液色谱相应位置显相同颜色的荧光斑点(见图1)。
2.2 绿原酸含量测定
2.2.1 溶液制备
称取干燥至恒重的绿原酸对照品约25 mg,精密称定,置50 mL棕色容量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,精密量取溶液12.5 mL,置50 mL 棕色容量瓶中,加50%甲醇液稀释至刻度,摇匀,即得对照品溶液,避光低温保存。取20 粒滴丸,研细,称取约40 mg,精密称定,置25 mL 容量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,0.45 μm 微孔滤膜过滤,即得供试品溶液。取适量不含药的空白滴丸,加50%甲醇溶解并用0.45 μm 微孔滤膜过滤,即得阴性对照品溶液。
2.2.2 色谱条件与系统适用性试验
色谱柱:Hypersic C18柱(250 mm ×4.6 mm,5 μm);流动相:乙腈-0.4% 磷酸溶液(13 ∶87);流速:1.0 mL /min;检测波长:327 nm;柱温:室温;进样量:20 μL。在此色谱条件下的色谱图见图2。可见,阴性对照品溶液不干扰测定,供试品溶液色谱与对照品溶液色谱上保留时间一致的峰可确定为绿原酸峰,保留时间约9 min,理论板数按绿原酸峰计算应不低于2 000。
2.2.3 方法学考察
线性关系考察:精密量取对照品溶液0,1,3,5,8,10 mL,置10 mL 容量瓶中,加50%甲醇稀释至刻度,摇匀,0.45 μm 微孔滤膜过滤,各取续滤液20 μL 注入高效液相色谱仪,重复3 次,记录色谱图,计算平均峰面积。以平均峰面积值(A)对进样质量浓度(C)进行回归,得标准曲线方程A=31 860 C+27 633,r=0.999 9(n=6)。结果表明,绿原酸质量浓度在1.3 ~130 μg/mL 范围内与峰面积线性关系良好。
精密度试验:精密吸取同一对照品溶液20 μL,连续测定5次,记录峰面积值。结果的RSD 为0.94% ( n=5),表明仪器精密度良好。
稳定性试验:精密吸取同一供试品溶液20 μL,于0,2,4,6,8 h 时进样测定峰面积。结果的RSD 为1.33% ( n=5),表明供试品溶液在8 h 内稳定性良好。
重复性试验:取同一批样品5 份,依法制备供试品溶液,并按拟订方法测定。结果平均含量为每丸0.263 mg,RSD 为0.71%(n=5),表明方法的重复性良好。

图1 薄层色谱图
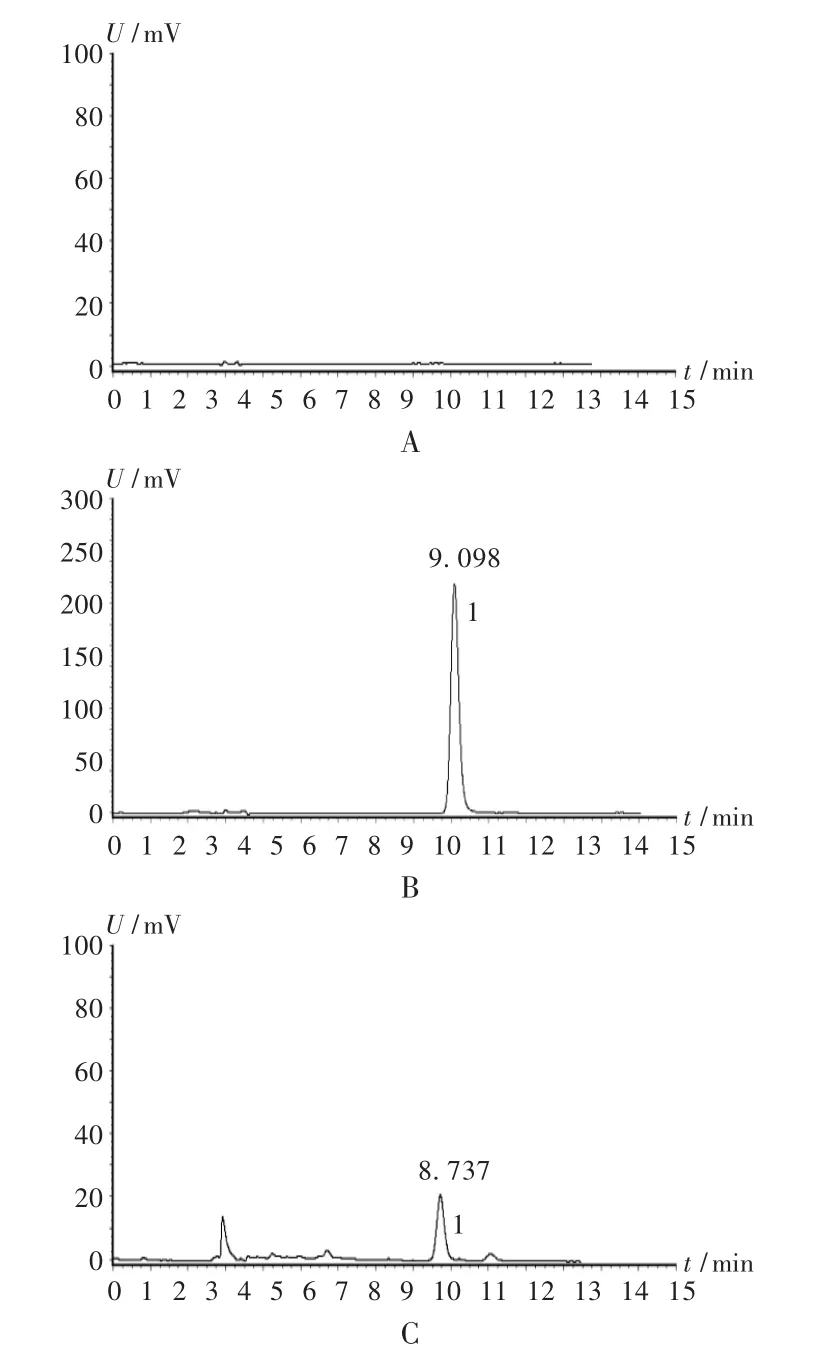
图2 高效液相色谱图
加样回收试验:取已知含量的绿原酸滴丸20 粒,研细,取细粉约40 mg,精密称定,置10 mL 容量瓶中,分别精密加入绿原酸对照品溶液6.0,3.2,1.0 mL,按供试品溶液制备方法操作,并量取续滤液20 μL,依法测定,计算回收率。结果见表1。
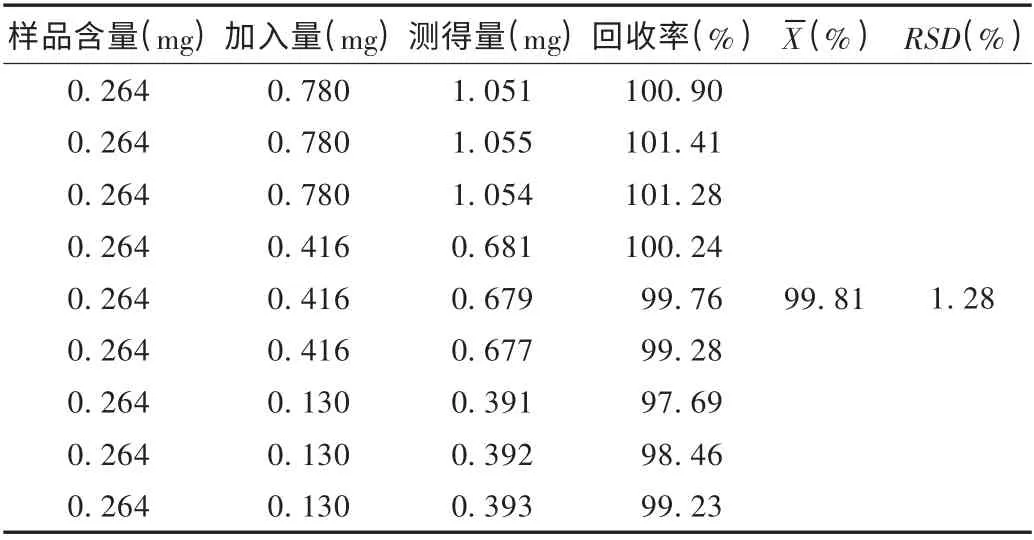
表1 绿原酸加样回收试验结果(n=9)
2.2.4 样品含量测定
取3 批杜仲叶提取物滴丸,制备供试液,按拟订方法测定,按外标法计算样品中绿原酸含量。结果3 批样品每丸含绿原酸量分别为0.256,0.260,0.263 mg。
2.3 稳定性考察[6 -7]
取模拟上市包装中试样品3 批进行加速试验和长期试验。加速试验条件为温度(40 ±2)℃、相对湿度(75 ±5)%(氯化钠饱和溶液),放置6 个月,分别于第0,1,2,3,6 个月取样。长期试验条件为温度(25 ±2)℃、相对湿度(60±10)%(亚硝酸钠饱和溶液),放置12 个月,分别于第0,3,6,9,12 个月取样。结果在加速试验及长期试验条件下,滴丸性状均为棕褐色圆球,无明显变化,溶散时限及含量见表2。可见,制剂中绿原酸含量虽有所下降,但均符合质量标准的要求。

表2 加速试验结果
3 讨论
采用薄层色谱法对杜仲叶提取物滴丸中杜仲叶进行定性鉴别,在薄层色谱中能检出绿原酸的特征斑点,斑点分离清晰,专属性强,重复性好,可作为杜仲叶提取物滴丸制剂的有效鉴别方法。
采用HPLC 法测定制剂中绿原酸时,比较了不同比例的甲醇-水、甲醇-0.4%磷酸溶液、乙腈-水、乙腈-0.4%磷酸溶液等流动相系统,结果以乙腈-0.4%磷酸溶液(13 ∶87)为流动相,不仅峰形良好,且保留时间适中,并具有良好的重复性。
在滴丸稳定性试验中,除对性状、溶散时限、含量测定进行了考察外,还分别进行了薄层鉴别、微生物限度等检查,结果均符合质量标准要求。
[1] 王柏强,刘 福,江承平,等. 正交试验优选杜仲叶滴丸成型工艺[J].中国药房,2012,23(7):616 -618.
[2] 马凤仙,赫锦锦,李 钦.RP-HPLC 测定杜仲平压片中京尼平苷酸、绿原酸、京尼平苷的含量[J]. 中成药,2008,30(1):86 -89.
[3] 周厚琼. 对杜仲叶深度开发的思考与建议[J]. 中国药房,1998,9(5):203 -204.
[4] 兰燕宇,郑 林,黄 勇,等. 甘菊滴丸的质量控制及稳定性考察[J].中国实验方剂学杂志,2013,19(1):99 -101.
[5] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2010:154.
[6] 张望刚,王 俏,陈国神,等. 盐酸丙卡特罗舌下滴丸的研制及其稳定性考察[J]. 中国现代应用药学,2011,28(6):542 -545.
[7] 国家药典委员会. 中华人民共和国药典(二部)[M]:北京:中国医药科技出版社,2010:附录199.

