早期食管癌及癌前病变的内镜特点及治疗前后病理诊断的对比分析
胡桂梅 叶国良 郑拓 金燕平
早期食管癌及癌前病变的内镜特点及治疗前后病理诊断的对比分析
胡桂梅 叶国良 郑拓 金燕平
目的评价早期食管癌及癌前病变的内镜特点,比较术前、术后病理诊断的符合率,为食管上皮内瘤变的内镜治疗提供依据。方法收集2010年1月至2015年1月所有因早期食管癌及癌前病变行内镜下治疗的患者共89例,92处病灶,分析内镜下特征及术前、术后病理诊断的一致率。结果术前、术后病理诊断完全一致率69.6%(64/92),其中术前低级别上皮内瘤变(3类)诊断一致率71.4%(35/49),高级别上皮内瘤变(4类)诊断一致率53.3%(16/30),浸润性癌(5类)诊断一致率100.0%(13/13)。术后4类及5类病灶与1、2、3类病灶平均最大直径和面积的比较差异均有统计学意义(P<0.05或0.01),4、5类间病灶大小、部位的比较差异均无统计学意义(均P>0.05),但两者在内镜形态上差异有统计学意义(P<0.05)。结论术前病理诊断不能完全代表食管黏膜病变的性质,对于食管低级别上皮内瘤变者,若病变直径>20mm或为Ⅱc病变者,应尽快选择内镜下治疗。
早期食管癌 癌前病变 病理 活检
食管癌是我国常见的恶性肿瘤,我国的患者占世界总数的50%以上[1]。早期食管癌病灶小、患者无明显临床症状,预后良好,而中晚期食管癌患者则病死率显著升高,因此食管癌早期诊断及治疗意义重大。随着内镜器械和诊疗技术迅速发展,内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)已经成为治疗早期消化道肿瘤的有效方法。笔者对本院近年来行内镜下治疗的早期食管癌及癌前病变患者作了内镜特征和术前、术后病理诊断符合率的对比分析,以评价术前活检在内镜治疗中的应用价值,现将结果报道如下。
1 资料和方法
1.1 一般资料 选取我院2010年1月至2015年1月所有因早期食管癌及癌前病变行ESD的患者共89例, 92处病灶,均在胃镜检查时发现,表现为浅表病变,伴有不同程度色泽改变,临床症状无特异性;其中男80例,女9例,年龄50~79(61.8±10.2)岁,≥70岁29例。病理分类标准:根据食管、胃肠上皮性肿瘤WHO专家组意见和Vienna分类[2-3],将早期食管、胃肠道肿瘤分为5类,1类:无瘤变或异型增生;2类:不能明确的瘤变或异型增生;3类:低级别上皮内瘤变(L),包括轻度和中度不典型增生,其结构和细胞异常仅限于上皮质的下1/2;4类:高级别上皮内瘤变,包括原位癌和重度不典型增生,其结构和细胞异常超过上皮质的1/2且异型性更明显,但无间质内浸润;5类:浸润性癌,包括黏膜内癌和黏膜下癌。其中1例男性患者有3处病灶,2处术前病理诊断为3类,1处为4类;另1例男性患者有2处病灶,术前病理诊断均为3类。术前活检病理属3类的有49处,属4类的有30处,属5类的有13处。
1.2 方法
1.2.1 内镜治疗标准 根据国内外ESD切除标准,近几年扩大切除指征和我院实际情况制定的ESD切除纳入标准:(1)术前活检病理提示高级别瘤变,超声内镜或增强CT未发现淋巴管侵犯;(2)术前活检提示为原位癌,超声内镜或增强CT检查未发现淋巴管侵犯,超声内镜提示黏膜下层完整;(3)术前活检提示为分化型癌,超声内镜或增强CT检查未见淋巴管侵犯,超声内镜提示可能有黏膜下层累及,年龄≥70岁,无法耐受手术者;(4)术前活检病理提示低级别瘤变,反复复查不能消失;(5)术前病理检查虽然未取到癌变黏膜,碘染色+窄带成像术(NBI)+放大内镜高度怀疑病变为高级别瘤变病变或癌变可能;(6)未分化肿瘤不行ESD治疗;(7)病变直径>1.5cm,采用ESD,若病变直径≤1.5cm,则选择内镜多环黏膜套扎切除术。
1.2.2 内镜治疗方法 食管ESD:包括标记、黏膜下注射抬举病灶、预切开及黏膜下剥离4个基本步骤。整块黏膜标本取出后铺平用大头针固定,浸泡于甲醛溶液送检。内镜多环黏膜套扎切除术:标记,在胃镜前端安装套扎器,在胃镜直视下靠近病灶,用吸引法将部分病变黏膜吸至胃镜前端,用释放装置将橡皮圈套于病变根部;然后用圈套器在橡皮圈根部下方收紧,将病灶切除。
1.2.3 内镜特征和ESD术后诊断 内镜特征:包括病变位置,分为上段(距门齿15~24cm)、中段(距门齿25~32cm)、下段(距门齿33~40cm);病灶大小以最大直径(病灶长轴)和面积(病灶长轴短轴)来衡量,分别统计>20mm或≤20mm;病灶周径≤1/3周、1/3~1/2周(包括1/ 2周)、>1/2周。按日本内镜学会对早期食管癌侵犯深度标准[4-5],内镜下形态分为Ⅱa(轻微隆起型)、Ⅱb(表面平坦型)、Ⅱc(浅表凹陷型);肿瘤位于上皮内层为m1,肿瘤浸润至黏膜固有层为m2,肿瘤浸润至黏膜肌层为m3,肿瘤浸润深度超过黏膜下层上1/3为sm1。病理检查结果均由2位中级职称以上病理医师同时观察后给予认定。肿瘤浸润深度超过sm1者给予进一步手术或放疗。
1.3 观察指标 比较患者术前活检、ESD术后病理诊断的符合率(指活检病理与ESD术后病理诊断完全相同的例数占总例数的百分比,包括瘤变和癌变的严重程度均完全相同);术后病理类型与病变内镜特点的关系。
1.4 统计学处理 采用SPSS 21.0统计软件,计量资料以表示,不同病变类型间的比较采用t检验,计数资料比较采用χ2检验。
2 结果
2.1 食管病灶基本情况 92处病灶位于食管上段10处(10.9%),中段52处(56.5%),下段30处(32.6%);大部分病灶在食管中段。病灶大小(长径)20mm 45处(48.9%),>20mm 47处(51.1%);病灶周径≤1/3的42处(45.7%),1/3~1/2的35处(38.0%),>1/2的15处(16.3%),病变范围绝大多数<1/2周径。内镜形态Ⅱa 17处(18.5%),Ⅱb 59处(64.1%),Ⅱc 16处(17.4%),主要为Ⅱb型。
2.2 术前、术后病理诊断对比 92处食管上皮内瘤变术前、术后病理诊断符合率69.6%(64/92),术后病理类型级别加重23.9%(22/92),减轻6.5%(6/92),详见表1。其中术前诊断的49处低级别上皮内瘤变ESD术后病理诊断3类35处,符合率71.4%(35/49);术前诊断的30处高级别上皮内瘤变ESD术后病理诊断4类只有16处,符合率53.3%;另14处为5类(浸润性癌),其中4处侵及黏膜固有层m2(均为中高分化鳞癌),4处侵及黏膜肌层m3(3处为中分化鳞癌,1处为高中分化鳞癌),6处侵及黏膜下层sm1(3处为中低分化鳞癌,2处为中高分化鳞癌,1处为高分化鳞癌);术前诊断的13处5类病灶与术后病理诊断均一致,符合率达100.0%。92处病变中均未见腺癌。
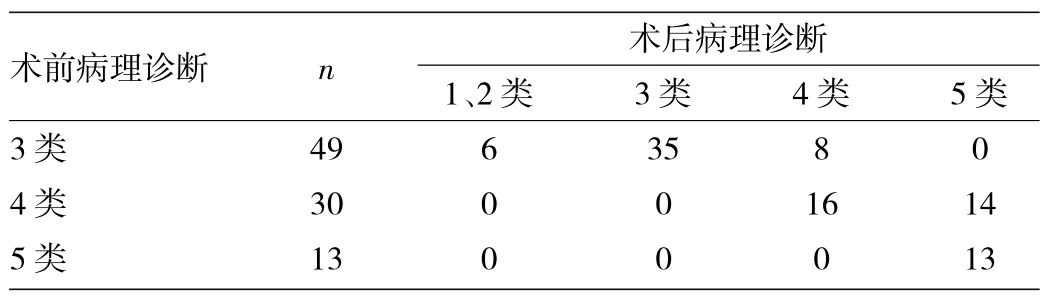
表1 92处病灶胃镜活检病理诊断与ESD术后病理诊断的比较(处)
2.3 ESD术后不同病理类型病灶直径、面积的比较 见表2。
由表2可见,1、2类和3类病灶平均直径<20mm,平均面积<250mm2;而4、5类病灶平均直径>20mm,平均面积>250 mm2,4、5类病灶与1、2类及3类病灶比较,差异均有统计学意义(P<0.05或0.01);而4类与5类病灶之间差异均无统计学意义(均P>0.05)。

表2 ESD术后不同病理类型病灶直径、面积的比较
2.4 ESD术后4类与5类病灶内镜形态、病变部位的比较 见表3。
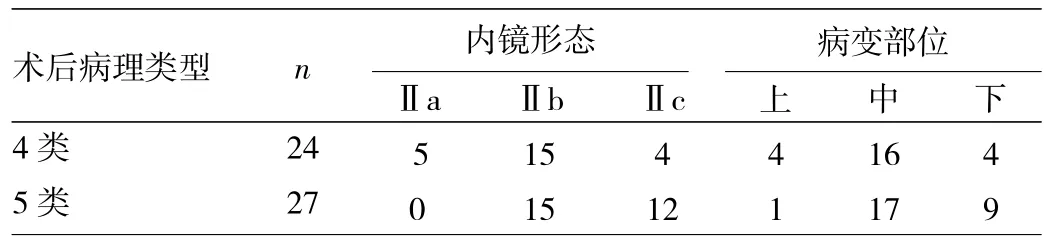
表3 ESD术后4类与5类病灶内镜形态、病变部位的比较(处)
由表3可见,4类病灶中内镜形态以Ⅱb型为主,Ⅱc型比例较低(16.7%);5类病灶中Ⅱc型比例明显增加(44.4%),无Ⅱa型病变。两者在内镜形态上的比较差异有统计学意义(χ2=8.854,P<0.05)。4、5类病灶均大部分在食管中段,两者的病变部位比较差异无统计学意义(χ2=3.589,P>0.05)。
3 讨论
本研究发现食管癌多发生于中段,以中老年患者为主,且男性明显多于女性,与我国食管癌发病特点基本一致[6],内镜表现主要以Ⅱb型为主。一般来讲,病理诊断是确定病变性质的金标准,通过术前活检病理诊断可以明确患者的治疗方向,但术前活检和术后大块病理诊断间存在不一致性,术前活检病理诊断可能低估或高估病灶实际情况,因此其不能代表病变实际情况。最近Wani等[7]多中心回顾性研究发现138处Barrett食管上皮内瘤变者行内镜切除治疗后证实术前活检和术后病理完全一致率只有68.9%,术后病理程度加重占21%,术后病理程度减轻占10.1%。在我们的研究中发现术前活检与术后病理诊断一致率达69.6%,术后病理加重23.1%(22/92),术后病理减轻6.5%(6/92),与国外报道的数据基本一致。其中低级别上皮内瘤变活检和术后病理诊断的一致率在71.4%;而高级别上皮内瘤变术前活检和术后病理诊断的一致率只有53.3%,且术前活检明显低估了病灶实际情况。造成这种治疗前后病理诊断不一致的原因有以下几点:(1)病变认识不足:由于各种原因,胃镜检查中未能行碘染色或NBI,导致医师对病变判断出现偏差,活检位置不准确,取材量少,没做到多点多部位活检;(2)活检位置不准确:由于内镜检查时,食管与内镜呈平行状态,导致部分内镜医师不能很好操控内镜达到准确活检病变组织;(3)活检深度不够:一般活检的深度只有黏膜上皮和黏膜固有层,但内镜治疗后标本可有完整黏膜层(黏膜上皮、固有层及黏膜肌层)和部分黏膜下层,病理医师仅根据术前活检不一定能看到浸润,因此可解释在我们的研究中高级别上皮内瘤变组病理完全一致率明显低于低级别上皮内瘤变组;(4)各地病理医师对食管上皮内瘤变病理诊断存在一定偏差,尤其对中度与重度异型增生、浸润性与非浸润性癌的认识上存在一定偏差。
由于术前内镜活检与术后病理诊断存在一定差异,那内镜下病变特点是否有助于病变的判断呢?有学者对胃上皮内瘤变术后病理与内镜特点的对比研究发现,不同级别的病理类别与内镜形态和部位无关,与病变大小有关[8]。本文也对食管上皮内瘤变的内镜特点与不同病理类别的差异性进行观察,术后证实1、2和3、4与5类病理类别的病灶在病变大小上均无明显差异,术后证实4、5类病理的病变在病灶直径和面积均大于其他三类,存在明显差异。4、5类病理类别在内镜形态上存在差异,在5类病理类别中Ⅱc型病变比例明显上升,提示若在内镜形态上出现Ⅱc病灶,即使术前病理提示高级别或低级别上皮内瘤变均应警惕浸润性癌可能。因此,内镜下病变大小、范围及内镜形态均可帮助内镜医师评估病变受侵情况。
食管癌的发生是个连续过程,一般认为从单纯鳞状上皮增生,低级别上皮内瘤变,高级别上皮内瘤变最终演变为食管癌。由于食管癌在欧美等国家发病率低,国外相关的研究少之又少。对食管高级别上皮内瘤变的认识较为一致,王国清等[9]报道在一组878处内镜检查加黏膜活检后经13.5年随访,病理组织学为轻度、中度和重度异型增生者,食管鳞癌的发生率分别为5.3%、26.7%和65.2%,重度异型增生癌变率高,需积极处理。现研究一致认为m1、m2期病变一般无淋巴结转移,m3病变淋巴结转移率可在0~18%;黏膜下浸润时,淋巴转移率明显增加,可高达50%[10]。本研究的30处术前为高级别上皮内瘤变者中,术后发现有8处为黏膜内癌,6处黏膜下层癌(sm1)。因此对于高级别上皮内瘤变主张积极行外科干预,如病变表浅,可通过行超声内镜、CT检查判断病变浸润情况并排除肿大淋巴结后考虑行ESD,若有超声内镜提示病灶侵及黏膜下层或有淋巴结转移者,需外科手术治疗。对食管低级别上皮内瘤变的处理存在争论,陈正言等[11]对40处食管轻中度不典型增生患者随访8年,发生重度不典型增生8处,食管鳞癌9处。陈思杰等[12]对42处食管鳞状上皮低级别内瘤变患者随访8年,22处保持低级别上皮内瘤变,但有12处转变成高级别上皮内瘤变或原位癌。因此,对此类病变不适合外科手术的情况下,是否需行内镜干预有待进一步研究。本研究的49处食管低级别上皮内瘤变者中,发现8处术后证实为高级别上皮内瘤变,6处术后证实为鳞状上皮炎症或增生。在术后证实1、2、3类病理中病变平均直径<20mm,4、5类病理中病变平均直径>20mm;5类病理中内镜下Ⅱc病变比例明显增加。因此,对于低级别上皮内瘤变者,不能单纯依据术前病理诊断来决定随访或内镜干预,对病变直径>20mm或Ⅱc者应尽早内镜干预。
总之,术前病理诊断还不能完全代表食管黏膜病变性质,对食管高级别上内瘤变者,应尽早行内镜下干预或外科手术治疗;对食管低级别上皮内瘤变者,若病变直径>20mm或Ⅱc病变者,应尽快选择内镜下治疗。
[1] Parking D M,Whehan S L,Ferlay J.Estimating the world cancer burden:Globocan 2000[J].International Journal of Cancer,2001, 94(2):153-156.
[2] 张新华,周晓军.食管肿瘤WHO新分类解读[J].中华消化内镜杂志, 2003,20(5):359-360.
[3] Schlemper R J,Riddell R H,Kato Y,et al.The Vienna classification of gastrointestinal epithelial neoplasia[J].Gut,2000,47(2):251-255.
[4] Arantes V,Forero Pineros E A,Yoshimura K,et al.Advances in the management of early esophageal carcinoma[J].Rev Col Bras Cir,2012,39(6):534-543.
[5] Shimizu M,Zaninotto G,Nagata K,et al.Esophageal squamous cell carcinoma with special reference to its early stage[J].Best Pract Res Clin Gastroenterol,2013,27(2):171-186.
[6] 乌日图牧仁,曾波,熊刚,等.726处食管癌患者分布特征分析[J].中华疾病控制杂志,2011,15(2):95-97.
[7] Wani S,Abrams J,Edmundowicz S A,et al.Endoscopic mucosal resection results in change of histologic diagnosis in Barrett's esophagus patients with visible and flat neoplasia:a multicenter cohort study[J].Dig Dis Sci,2013,58(6):1703-1709.
[8] Lee S B,Kang H Y,Kim K I,et al.The diagnostic accuracy of endoscopic biopsy for gastric dysplasia[J].J Gastric Cancer,2010, 10(4):175-181.
[9] Wang G Q,Abnet C C,Shen Q,et al.Histological precursors of oesophageal squamous cell carcinoma:results from a 13 year prospective follow up study in a high risk population[J].Gut,2005, 54(2):187-192.
[10] Cho J W,Choi S C,Jang J Y,et al.Lymph Node Metastases in Esophageal Carcinoma:An Endoscopist's View[J].Clin Endosc, 2014,47(6):523-529.
[11] 陈正言,张蓓,沈小建,等.食管黏膜良性增生和轻中度不典型增生的随访研究[J].中华消化杂志,2006,26(3):202-203.
[12] 陈思杰,邹清云,黄中华,等.食管鳞状上皮低级别上皮内瘤变的随访研究[J].中国全科医学,2010,13(2B):531-532.
Accuracy of preoperative endoscopic diagnosis of early esophageal cancer and precancerous lesions
Objective To evaluate the preoperative endoscopic diagnosis of early esophageal cancer and precancerous lesions.MethodsEighty nine patients with early esophageal cancer or precancerous lesions(92 lesions)were treated with endoscopic surgery in the Affiliated Hospital of Ningbo University Medical College between January 2010 and January 2015.The concordance of preoperative and postoperative pathological diagnosis was analyzed.ResultsThe overall consistency rate of preoperative and postoperative pathological diagnosis was 69.6%.For low-grade intraepithelial neoplasia (category 3), high-grade intraepithelial neoplasia(category 4)and invasive neoplasia(category 5),the diagnostic consistency were71.4%, 53.3%and 100.0%,respectively.There were significant differences in maximum diameter and area between categories 4,5 and categories 1,2,3(P<0.05);while no difference between category 4 and 5,but there were significant differences in endoscopic characteristics between two categories.ConclusionPreoperative biopsy is insufficient for accurate diagnosis of esophageal mucosal lesions.For esophageal low-grade intraepithelial neoplasia,if the lesions is belong to Ⅱ c or diameter over 20mm,endoscopic resection should be first considered.
Early esophageal cancer Precancerous lesions Pathology Biopsy
2014-10-13)
(本文编辑:沈叔洪)
消化系统恶性肿瘤诊治新技术创新团队(2011B82014)、宁波市医学科技计划项目(2013A18)
315020 宁波大学医学院附属医院消化内科
叶国良,E-mail:ndfyygl@163.com

