亚热带不同演替树种米槠和马尾松细根性状对比研究
王韦韦, 熊德成, 黄锦学, 黄超超, 杨智杰, 胡双成, 林成芳,*,陈光水
1 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007 2 福建师范大学地理研究所, 福州 350007
亚热带不同演替树种米槠和马尾松细根性状对比研究
王韦韦1,2, 熊德成1,2, 黄锦学1,2, 黄超超1,2, 杨智杰1,2, 胡双成1,2, 林成芳1,2,*,陈光水1,2
1 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007 2 福建师范大学地理研究所, 福州 350007
选择福建省三明市中亚热带演替前期树种马尾松和演替后期树种米槠两种人工林为研究对象,采用土芯法研究两个树种细根(直径<2 mm)的生物量及其垂直分布、形态以及分支结构等细根性状特征。结果表明:(1) 0—80 cm 土层米槠的细根生物量密度(0.21±0.06) kg/m3、根表面积密度(3.15±1.25) m2/m3和根长密度(2202.84±517.03) m/m3分别为马尾松的1.6、1.2倍和2.2倍,并且3个指标均随土层深度增加而降低,但演替前期树种马尾松细根在土层间分布更均匀,而演替后期树种米槠细根更富集于表层。(2)马尾松细根的直径(0.86±0.04) mm、比表面积(191±32) cm2/g分别是米槠的1.4倍和1.3倍;米槠细根的比根长(10.73±0.46) m/g、组织密度(0.49±0.06) g/cm3分别是马尾松的1.4倍和2.0倍,马尾松细根的较大直径和低组织密度的形态结构能够迅速生长占领土壤空间和适应干旱环境,而米槠细根的较小直径、高比根长和较高的组织密度使其具有较强养分竞争能力和应对取食压力;(3) 米槠的比根尖密度(4288±63) 个/g、比分叉密度(1164±155) 个/g均为马尾松的2.2倍,米槠细根的高分支系统能够迅速利用富养斑块。结论表明处于不同演替阶段的树种细根性状具有明显差异,可能反映了不同的资源获取策略。
森林演替; 细根性状; 形态特征; 分支结构
正如地上部分对光的竞争一样,森林群落地下根系的养分竞争,也深刻地影响林木的生长、物种共存和森林群落动态[1]。在森林群落中不同树种根系有不同的资源获取策略,表现在不同的方面,如扩展细根进入和填充土壤空间以获取土壤养分和水分资源[2],体现在细根生物量的垂直和水平分布上[3];调整细根的分支系统来提高利用效率,体现在细根形态和分支特征上,包括细根的比根面积、比根长和分支模式[4]。植物细根的性状特征是对其生境长期适应的结果[5],承载着一定的环境变化信息[6]。森林土壤的养分空间分布有着高度的异质性[7],植物根系在长期进化过程中为最大限度获取土壤资源,形成形态可塑性、生理可塑性、菌根可塑性等觅食机制,不同植物种细根性状可塑性的差异较大。其中形态可塑性的反应特征包括根系广布性与觅食精确性[8],如Campbell 等[9]对8种草本植物的根系形态反应的研究表明,植物根系广布性与觅食精确性间有负相关关系,并提出植物根系觅食广布-精细(foraging scale-precision)假说,即物种对资源觅食的空间范围和对资源热点觅食的精细程度之间有一个权衡。对该假说的研究主要集中于温带地区草本植物群落[9- 10],并有类似的研究结果[10],在森林群落中的研究则很少。
自然条件下森林的演替总是遵循着客观规律:耐贫瘠的先锋植物最先侵入、定居裸地,逐渐改变环境条件,导致后继植物入侵、定居,形成新的群落,最终经过不同植物群落的更替、发展,形成复杂而稳定的中生性顶极森林群落。处于不同演替阶段的树种面临不同的生境条件,可能进化出一系列不同的生态适应机制,从而具有不同的细根性状特征。目前有关不同演替树种生态适应机制的研究主要集中于地上生态过程(如光合作用、幼苗更新等)[11- 13],而对于地下生态特征特别是细根性状的研究十分缺乏。探明不同演替树种的细根性状特征,可以了解生境因子对细根性状的影响和细根对生境因子的可塑性响应,并可反映地下资源利用策略的种间差异。
在排除人为干扰的情况下,亚热带区域森林的演替过程一般为:针叶林(或其它先锋性群落)-针阔混交林-常绿阔叶林,最终趋向演替顶级。马尾松(Pinusmassoniana)是我国南方重要的速生用材树种,为亚热带演替早期优势树种[14];米槠(Castanopsiscarlesii)是我国中亚热带地区最典型的地带性植被类型,为演替后期顶级种,米槠群落也是我国亚热带地区特有的相对稳定的顶级群落[15]。本研究选取了在相似立地条件上营造的两个不同演替阶段树种的人工林作为研究对象,对两个树种的细根生物量指标和形态特征进行研究,初步了解处于不同演替阶段树种的细根性状特征(包括细根形态特征、分支结构和垂直分布等),从而深入理解不同演替阶段树种对地下资源的利用策略差异,为亚热带森林经营管理等提供理论依据。
1 研究地概况
研究区位于福建省三明市,属中亚热带季风气候,年均气温19.1 ℃,年均降水量1749 mm,年均蒸发量1585 mm,相对湿度81%。区域内土壤以花岗岩发育的红壤和黄壤为主,还分布有红黄壤、黄棕壤等,多呈酸性,土壤厚度超过1 m。马尾松人工林位于三明市金丝湾森林公园陈大林业采育场(26°19′ N, 117°36′ E)内,林下植被覆盖度约为90%,灌木较少,主要以芒萁(Dicranopterisdichotoma)、芒(Miscanthussinensis)和蕨(Pteridiumaquilinum)等草本为主。米槠人工林样地位于三明格氏栲(Castanopsiskawakamii)自然保护区(26°19′ N,117°28′ E)内,林下植被主要以毛冬青(Ilexpubescens)、乌饭树(Vacciniumbracteatum)、薄叶山矾(Symplocosanomala)、桂北木姜子(Litseasubcoriace)、山姜(Alpiniajaponica)等为主,草本以芒萁为主。马尾松和米槠人工林的直线距离不超过30 km,两者立地条件(如母岩、土壤类型、小地形和小气候条件等)相同,前身均为米槠次生林,经过皆伐、火烧、挖穴造林和幼林抚育形成。马尾松林和米槠林群落特征及土壤(0—20 cm)理化性质见表1[16]。
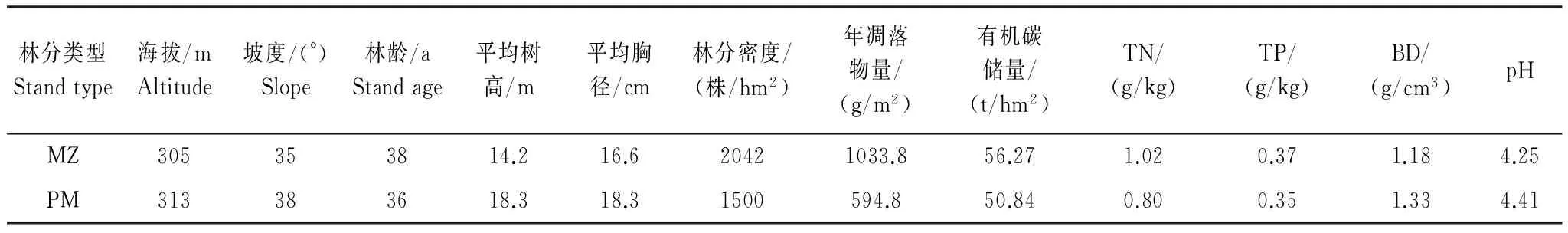
表1 2种林分的基本特征及土壤表层(0—20 cm)理化性质
2 研究方法
2.1 细根采集与处理
中亚热带细根生物量一般在春季(3—5月)达到一个峰值[17],故选择在2011年4月进行细根取样。在两个林分中各设置3块20 m×20 m样地,用内径4.05 cm的土钻按S形随机钻取土芯,深度为80 cm。3个样地分别钻取7、7和6个土芯,每种林分均为20个土芯。按0—10 cm、10—20 cm、20—40 cm、40—60 cm和60—80 cm土层分割土芯,把每个土层样品分别装入标记好的塑料袋中,带回实验室,于4 ℃冰箱内冷藏。
将样品从塑料袋中取出,在盆中用自来水浸泡、漂洗、过0.5 mm筛,拣出根系,用镊子、剪刀、游标卡尺等工具捡出直径<2 mm的细根,并根据根系颜色、外形、弹性、根皮与中柱分离的难易程度分出各目标树种的活细根。马尾松细根表皮多呈黄棕色,侧根较少;米槠细根表皮多呈红褐色,多细小分支。本研究中仅包括目的树种细根。
2.2 细根指标测定
将处理好的细根样品放置在盛有水的透明扫描仪托盘中,使根系完全舒展,采用数字化扫描仪Espon scanner 对根系样品进行扫描。使用Win-RHIZO(Pro 2005b)根系扫描分析系统对细根图像进行扫描,得到细根的数量、直径、长度、表面积、根尖数、分叉数等数据。再将根样品放置于65 ℃烘箱中烘干48 h至恒重后称干重。
计算细根生物量密度、根表面积密度、根长密度、比根长、比表面积、比根尖数、比分叉数等数据。计算公式如下:
生物量密度(kg/m3)=细根干重/取样体积
根表面积密度(m2/m3)=细根表面积/取样体积
根长密度(m/m3)=细根长/取样体积
组织密度(g/cm3)=细根干重/细根体积
比根长(m/g)=细根长/细根质量
比表面积(cm2/g)=细根表面积/细根质量
比根尖数(g-1)=细根根尖数/细根质量
比分叉数(g-1)=细根分叉数/细根质量
为描述根系分布,Gale 和Grigal提出基于渐近方程式的根系垂直分布模型:
Y=1-βd
式中,Y为从地表到深度d的根系生物量累计分数(分数值在0—1之间);d为土层深度(cm);β为根系生物量消弱系数。β值高说明根系生物量在深层土壤中分布的比例越大;β值低说明根系生物量集中分布于接近地表的土层中[18]。
2.3 数据分析
利用SPSS 17. 0软件对数据进行统计分析。采用双因素方差分析方法检验树种和土层对细根生物量、细根形态和细根分支结构指标的影响,采用单因素方差分析检验不同树种的β值以及细根生物量、形态和分支结构各指标的差异,采用单因素方差分析和最小显著差数法(LSD)检验同一树种不同土层间或同一土层不同树种的差异。显著性水平设定为α=0.05。利用Excel 2003软件作图。
3 结果与分析
3.1 细根生物量及垂直分布
由图1和表2可知,0—80 cm土层内,马尾松林和米槠林的总细根生物量密度分别为0.13 kg/m3和0.21 kg/m3,总根表面积密度分别为2.54 m2/m3和3.15 m2/m3,总根长密度分别为1020.98 m/m3和2202.84 m/m3。总细根生物量密度和总根表面积密度在两个林分间的差异不显著,但总根长密度差异显著。两种林分的细根生物量密度、根表面积密度和根长密度均随土层的增加而降低。
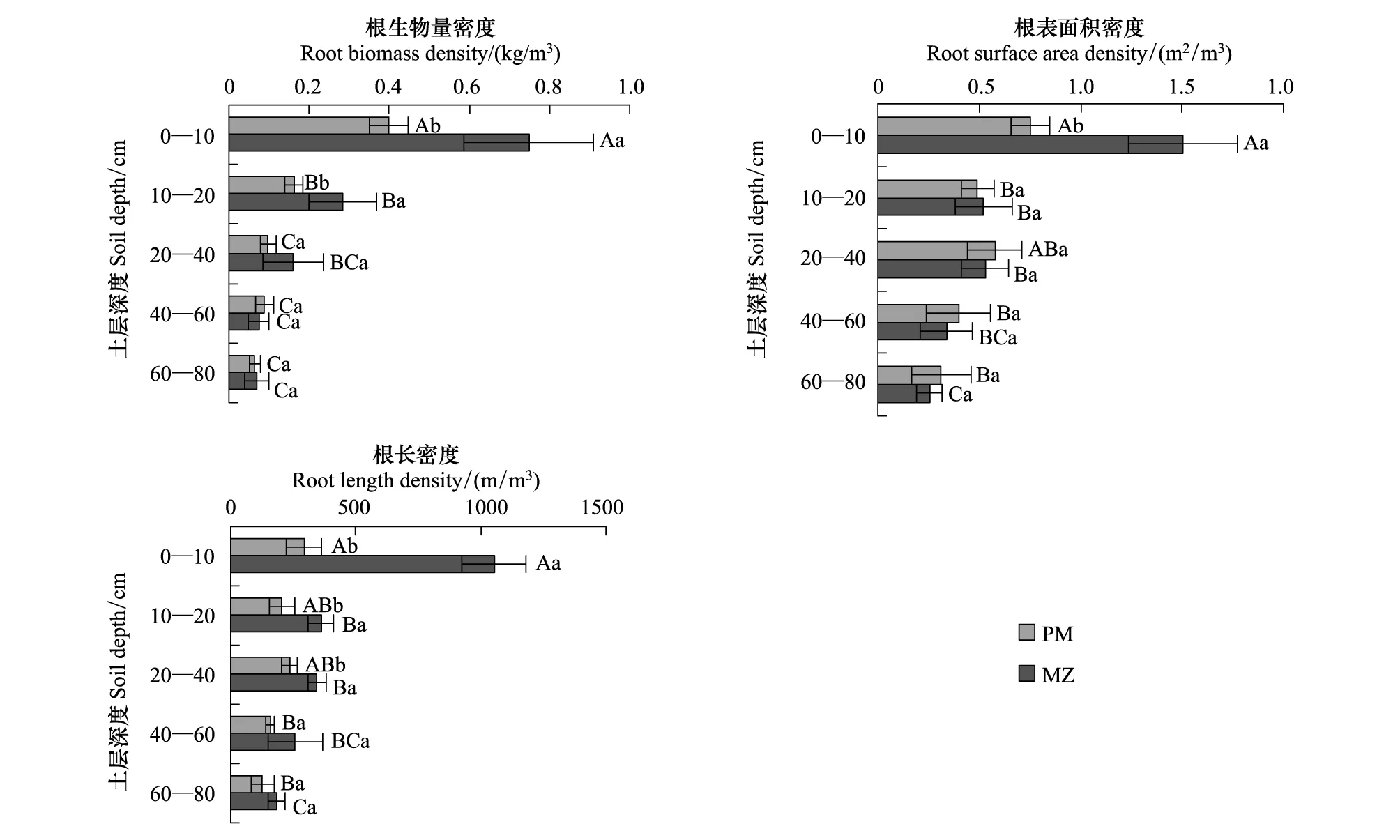
图1 马尾松(PM)和米槠人工林(MZ)细根生物量密度、根表面积密度和根长密度随土层变化Fig.1 Vertical changes in fine root biomass density, surface area density and length density in the Pinus massoniana (PM) and Castanopsis carlesii (MZ) plantations相同字母表示每种林分类型各土层间(大写字母)或不同森林同一土层间(小写字母)细根指标无显著差异(P﹥0.05)
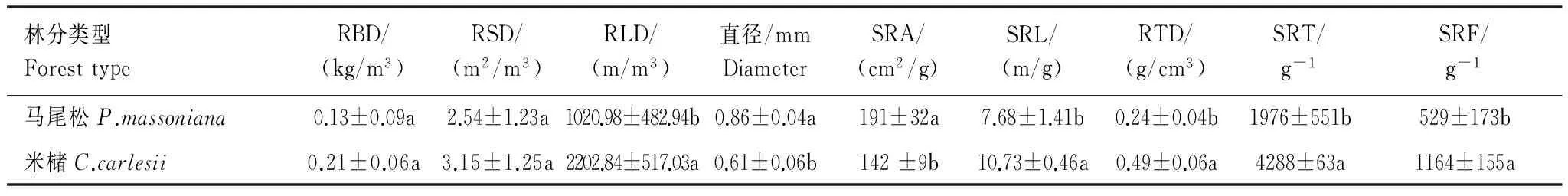
表2 马尾松和米槠人工林0—80 cm土层细根生物量、形态和分支结构特征
土层对米槠和马尾松细根生物量密度、根表面积密度和根长密度均有显著影响(图1)。2种树种间的生物量密度在0—10 cm、10—20 cm土层差异显著,其他土层差异不显著;根表面积密度在0—10 cm土层差异显著,其他土层差异不显著;根长密度在0—10 cm、10—20 cm和20—40 cm土层差异显著,其他土层差异不显著(图1)。
米槠的细根生物量、根表面积和根长的消弱系数均显著低于马尾松(表3)。根据β值的理论意义,米槠细根分布更集中于土壤表层,马尾松细根在各土层分布较均匀,在深层土壤中分布的比例较大。

表3 马尾松和米槠人工林细根生物量、表面积和根长垂直分布的消弱系数
3.2 细根的形态特征
由表2可知,0—80 cm土层内,细根的平均直径和总比表面积均为马尾松显著大于米槠,马尾松和米槠细根的平均直径分别为0.86 mm和0.61 mm,总比表面积分别为191 cm2/g和142 cm2/g。细根总比根长和总根组织密度均为米槠显著大于马尾松,米槠和马尾松的总比根长分别为10.73 m/g和7.68 m/g,总组织密度分别为0.49 g/cm3和0.24 g/cm3。
土层对米槠根直径和根组织密度有显著影响,但对马尾松根直径和根组织密度没有显著影响;两树种的根直径和根组织密度在不同土层均有显著差异(图2)。土层对米槠的根比表面积有显著影响,但对比根长没有显著影响;而土层对马尾松的比表面积和比根长均没有显著影响(图2)。除0—10 cm土层的比表面积在两个树种间差异显著外,两个树种间的比表面积和比根长在各土层均差异不显著(图2)。
3.3 细根的分支结构
由表2可知,细根总比根尖数和比分叉数均为米槠显著大于马尾松,米槠和马尾松的总比根尖密度为: 4288 g-1和1976 g-1,总比分叉密度为1164 g-1和529 g-1。
土层对米槠细根的比根尖数有显著影响,但对米槠的比分叉数及马尾松的比根尖数和比分叉数没有显著影响;两树种间的细根比根尖数在10—20 cm、40—60 cm和60—80 cm土层差异显著,在其他土层差异不显著;细根比分叉数在40—60 cm土层差异显著,其他土层均差异不显著(图3)。
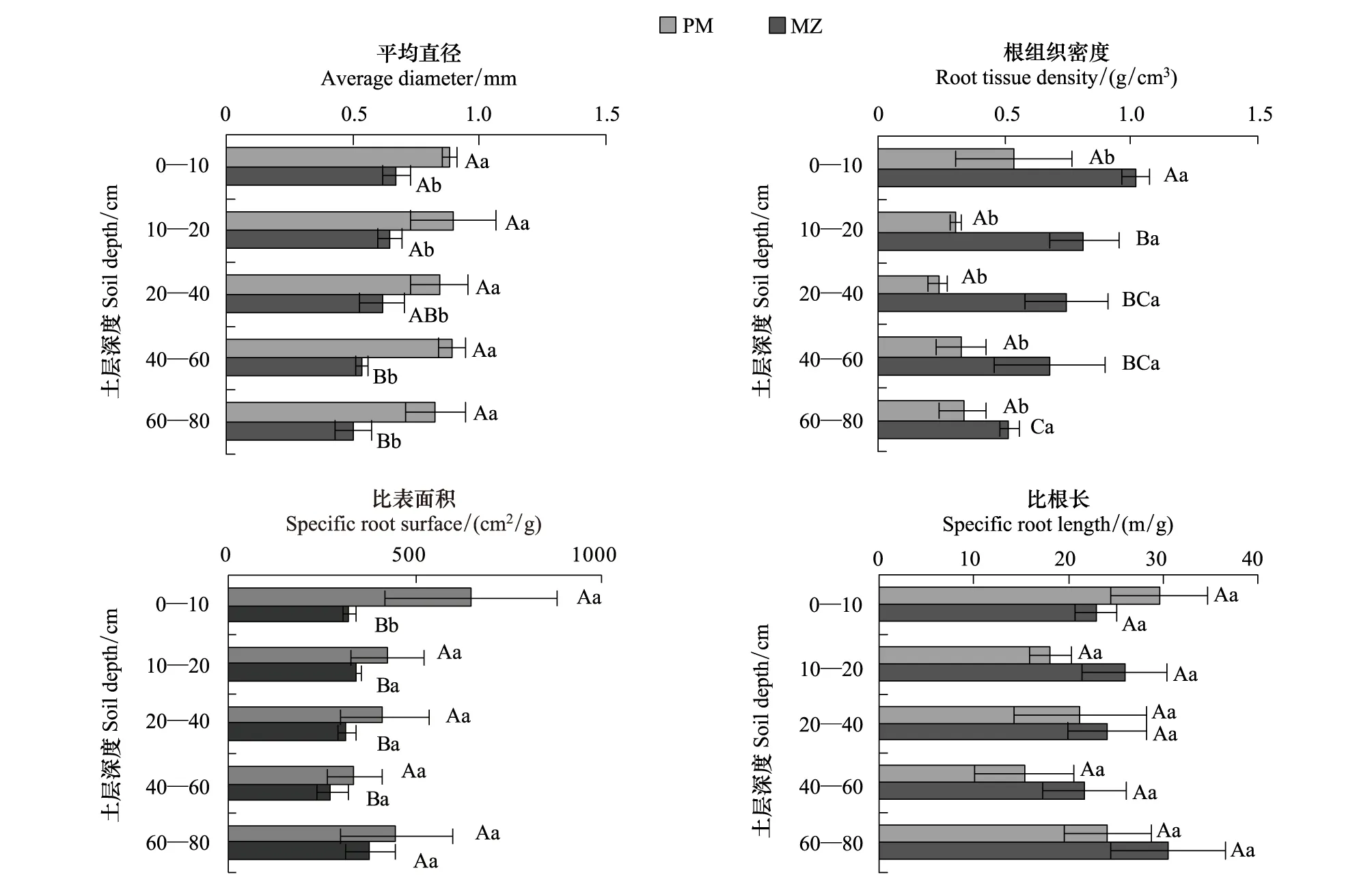
图2 马尾松和米槠人工林细根的形态特征Fig.2 Fine root morphologies in the Pinus massoniana (PM) and Castanopsis carlesii (MZ) plantations
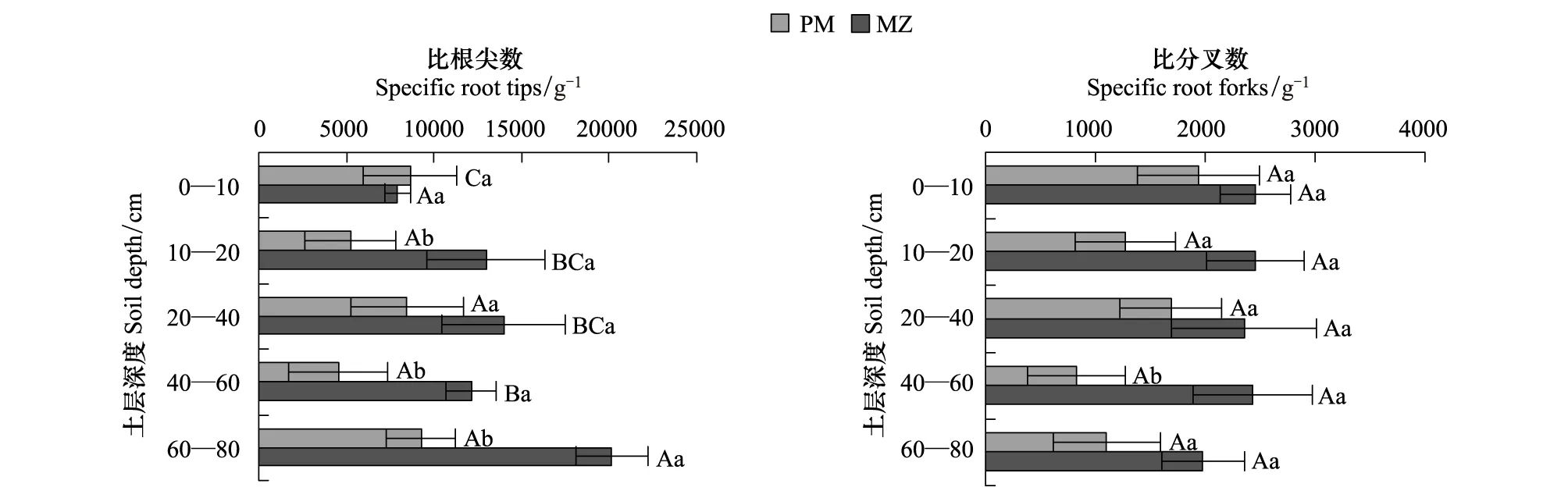
图3 马尾松和米槠人工林细根的分支结构Fig.3 Fine root branching intensity in the Pinus massoniana (PM) and Castanopsis carlesii (MZ) plantations
4 讨论
4.1 细根生物量密度及垂直分布
细根生物量密度是细根生物量与取样体积的比值,其值越大,代表单位土壤体积中投入的细根越多,其竞争能力越强。根表面积密度和根长密度是总量指标,主要受细根生物量密度的影响。三个指标均为演替后期的米槠林高于演替早期的马尾松林(图1)。两个林分前身均为米槠次生林,林龄相近,立地条件(如母岩、土壤类型、小地形和小气候条件等)相同,因此在细根特性方面的差异可能主要来自于树种特性差异。米槠林细根生物量密度高于马尾松,这与一般阔叶林细根生物量高于针叶林的报道一致[19]。演替早期和后期树种对土壤空间的利用差异亦体现在细根的垂直分布上,米槠细根集中分布于土壤表层,马尾松细根在土层中分布较均匀。在演替后期的森林群落中,物种间土壤资源竞争激烈,为了提高竞争力,米槠细根会迅速识别富养斑块并大量增生[20],并增加单位土壤体积的细根生物量投入,养分利用更加精细,利用效率更高。而演替早期树种马尾松则通过迅速和广泛的占据土壤空间获取资源[21],单位土壤体积的细根投入则相对较低,因而对养分斑块的利用不够精细,养分的利用效率较低。根系趋向养分丰富的土壤表层代表了觅食精确性[9],是根系竞争力的重要体现[22],因此米槠根系土壤中富养斑块的利用更加精细,具有觅食精确性。相反的,作为演替早期的速生树种,马尾松为了获取快速生长所需养分,以迅速占据、扩大土壤空间为主,细根在垂直分布上较均匀,因此马尾松根系对富养斑块的利用不够精细,但根系水平和垂直范围较大,具有觅食广布性。在其他研究中有相似的研究结果,如郝艳茹等[22]研究表明,马尾松根系分布具有均匀性,长白山森林生态系统中演替后期树种岳桦林根系分布表层化。Cté等[23]和Grier 等[24]对北美森林的研究表明,演替后期的细根分布逐渐表层化。
4.2 细根的形态特征
本研究中,演替后期树种的米槠具有更高的比根长,而演替早期树种的马尾松具有更大的细根直径,从而使得两种林分的总根表面积密度无显著差异(表2)。通过比较细根直径和细根组织密度发现,两个树种具有明显不同的细根形态适应策略。
与马尾松相比,米槠细根有较高的组织密度和较小直径(图2)。从树种适应角度看,米槠是亚热带演替后期的优势种,竞争压力大,同时细根被土壤小动物等的取食压力也较大,因此为了提高细根的竞争和防御能力,只能通过减小细根直径,并增加组织密度(增加细根中的木质素、单宁、木栓等次生代谢物种含量)。然而,减小细根直径可能导致细根木质部导管孔径变小,使细根的水分疏导能力降低。但由于米槠群落是亚热带顶级群落,群落环境较稳定,水分条件相对较好,因而不会产生水分输导障碍而影响对土壤水分的获取。
演替早期先锋树种的马尾松,在腐殖层薄、土壤贫瘠以及较干旱生境中,为了获取快速生长所需的养分和水分,需要快速的细根生长能力和较强的细根水分输导能力,因此马尾松细根在形态上表现为组织密度较低但细根直径较大。已有的研究表明,松柏类树种平均细根直径通常大于落叶树[25- 28]。有研究认为,直径较大的细根(白色、未栓化),单位根长的根表面积较大,从而会促进单位根长水分、养分吸收及运输能力的提高[29]。同时,马尾松根的低组织密度,使其能够迅速生长,占领广泛的土壤空间获取养分。Xiang等[4]对亚热带树种的研究中亦发现了部分与本研究相似的结论,即与演替早期的拟赤杨和枫树相比较,演替晚期的青冈栎的细根直径更小和比根长更高。
4.3 细根的分支结构
植物根系统形态结构对养分斑块的响应包括根分支模式和根增生的变化[30]。在肥沃土壤中,植物根会生长大量侧分支和增生[31],并且树木的生根策略具有种特异性和广泛的基因遗传性[25]。本研究中,米槠细根的总比根尖数和总比分叉数分别是马尾松的2.17和2.20倍(图3,表2)。演替后期米槠林生境条件较好,种间竞争压力大,米槠细根能够迅速识别富养斑块并大量增生和高度分支,觅食精度高,从而形成极细细根和密集分支,以充分吸收土壤养分,是具有地下高竞争力的演替后期树种的代表[8]。Majdi等[26]认为,细根分支的增加和形成根尖两个过程是相互依赖的,只有增加细根分支,才能增加细根尖数;同时细根分支的增加,伴随着平均根直径的减少和细根比表面积的增加。演替早期树种马尾松细根是通过占据大范围土壤空间获取资源,因而具有较粗的细根系统和较少的细根分支,并且对富养斑块响应不够迅速,是保守策略树种的代表,包括很多松柏科树种,如欧洲赤松和香脂冷杉[27- 28]。与此类似,Bauhus 等[28]对加拿大北方森林的研究也认为在较贫瘠的土壤环境中,树种细根较少且根系统的根尖、分支等级少。
本文发现亚热带演替早期树种马尾松和后期树种米槠有不同的细根性状特征,反映了不同的地下资源利用策略,这是不同树种细根对自身生境环境的长期适应、进化形成的,并对森林生态系统的功能过程和格局产生影响。本研究有助于理解亚热带森林生态系统演替的过程、机制,并为亚热带森林经营等提供科学依据。
[1] de Kroon H. Ecology. How do roots interact? Science, 2007, 318(5856): 1562- 1563.
[2] Brassard B W, Chen H Y H, Bergeron Y, Pare D. Differences in fine root productivity between mixed-and single-species stands. Functional Ecology, 2011, 25(1): 238- 246.
[3] Li L, Sun J, Zhang F, Guo T, Bao X, Smith F A, Smith S E. Root distribution and interactions between intercropped species. Oecologia, 2006, 147(2): 280- 290.
[4] Xiang W H, Wu W, Tong J, Deng X W, Tian D L, Zhang L, Liu C, Peng C H. Differences in fine root traits between early and late-successional tree species in a Chinese subtropical forest. Forestry, 2013, 86(3): 343- 351.
[5] Tjoelker M G, Craine J M, Wedin D, Reich P B, Tilman D. Linking leaf and root trait syndromes among 39 grassland and savannah species. New Phytologist, 2005, 167(2): 493- 508.
[6] Farrish K W. Spatial and temporal fine-root distribution in three Louisiana forest soils. Soil Science Society of America Journal, 1991, 55(6): 1752- 1757.
[7] 马雪红, 周志春, 张一, 金国庆. 杉木不同家系对异质养分环境的适应性反应差异. 植物生态学报, 2008, 32(1): 189- 196.
[8] 王庆成, 程云环. 土壤养分空间异质性与植物根系的觅食反应. 应用生态学报, 2004, 15(6): 1063- 1068.
[9] Campbell B D, Grime J P, Mackey J M L. A trade-off between scale and precision in resource foraging. Oecologia, 1991, 87(4): 532- 538.
[10] Wijesinghe D K, John E A, Beurskens S, Hutchings M J. Root system size and precision in nutrient foraging: responses to spatial pattern of nutrient supply in six herbaceous species. Journal of Ecology, 2001, 89(6): 972- 983.
[11] De Steven D. Experiments on mechanisms of tree establishment in old-field succession: seedling survival and growth. Ecology, 1991, 72(3): 1076- 1088.
[12] Marteinsdóttir B, Thórhallsdóttir T E, Svavarsdóttir K. An experimental test of the relationship between small scale topography and seedling establishment in primary succession. Plant Ecology, 2013, 214(8): 1007- 1015.
[13] Ellsworth D S, Reich P B. Photosynthesis and leaf nitrogen in five Amazonian tree species during early secondary succession. Ecology, 1996, 77(2): 581- 594.
[14] 王伯荪, 彭少麟. 鼎湖山森林群落分析 Ⅴ.群落演替的线性系统与预测. 中山大学学报: 自然科学版, 1985, (4): 75- 80.
[15] 刘浩凤. 亚热带米槠群落生态恢复中种间竞争研究 [D]. 福建: 福建农林大学, 2006.
[16] 王超. 常绿阔叶林不同更新方式下土壤呼吸的动态及机制 [D]. 福建: 福建师范大学, 2012.
[17] Yang Y S, Chen G S, Lin P, Huang R Z, Chen Y X, He Z M. Fine root distribution, seasonal pattern and production in a native forest and monoculture plantations in subtropical China. Acta Ecologica Sinica, 2003, 23(9): 1719- 1730.
[18] Gale M R, Grigal D F. Vertical root distributions of northern tree species in relation to successional status. Canadian Journal of Forest Research, 1987, 17(8): 829- 834.
[19] Steele S J, Gower S T, Vogel J G, Norman J M. Root mass, net primary production and turnover inaspen,jackpineandblackspruceforests in Saskatchewan and Manitoba, Canada. Tree Physiology, 1997, 17(8- 9): 577- 587.
[20] Brassard B W, Chen H Y H, Bergeron Y. Influence of environmental variability on root dynamics in northern forests. Critical Reviews in Plant Sciences, 2009, 28(3): 179- 197.
[21] Schmid I, Kazda M. Root distribution ofNorwaysprucein monospecific and mixed stands on different soils. Forest Ecology and Management, 2002, 159(1/2): 37- 47.
[22] 郝艳茹, 彭少麟. 根系及其主要影响因子在森林演替过程中的变化. 生态环境, 2005, 14(5): 762- 767.
[24] Grier C C, Vogt K A, Keyes M R, Edmonds R L. Biomass distribution and above-and below-ground production in young and matureAbiesamabiliszone ecosystems of the Washington Cascades. Canadian Journal of Forest Research, 1981, 11(1): 155- 167.
[25] Curt T, Prévosto B. Rooting strategy of naturally regenerated beech inSilverbirchandScotspinewoodlands.// Roots: The Dynamic Interface between Plants and the Earth. Netherlands: Springer, 2003: 265- 279.
[26] Majdi H, Damm E, Nylund J E. Longevity of mycorrhizal roots depends on branching order and nutrient availability. New Phytologist, 2001, 150(1): 195- 202.
[27] Bolte A, Villanueva I. Interspecific competition impacts on the morphology and distribution of fine roots in European beech (FagussylvaticaL.) and Norway spruce (Piceaabies(L.)Karst.). European Journal of Forest Research, 2006, 125(1): 15- 26.
[28] Bauhus J, Messier C. Soil exploitation strategies of fine roots in different tree species of the southern boreal forest of eastern Canada. Canadian Journal of Forest Research, 1999, 29(2): 260- 273.
[29] Barber S A. Soil Nutrient Bioavailability. New York: Wiley and Sons, 1984.
[30] Farley R A, Fitter A H. The responses of seven co-occurring woodland herbaceous perennials to localized nutrient-rich patches. The Journal of Ecology, 1999, 87(5): 849- 859.
[31] Drew M C, Saker L R. Nutrient supply and the growth of the seminal root system in Barley II. Localized, compensatory increases in lateral root growth and rates op nitrate uptake when nitrate supply is restricted to only part of the root system. Journal of Experimental Botany, 1975, 26(1): 79- 90.
Comparison of fine-root traits between two subtropical tree speciesPinusmassonianaandCastanopsiscarlesiidiffering in succession stages
WANG Weiwei1,2, XIONG Decheng1,2, HUANG Jinxue1,2, HUANG Chaochao1,2, YANG Zhijie1,2, HU Shuangcheng1,2, LIN Chengfang1,2,*, CHEN Guangshui1,2
1CultivationBaseofStateKeyLaboratoryofHumidSubtropicalMountainEcology,Fuzhou350007,China2InstituteofGeographicalSciences,FujianNormalUniversity,Fuzhou350007,China
The tree fine root (<2 mm in diameter) system is a functionally highly important compartment of forest ecosystems. Fine root traits are a result of long-term adaptation of trees to local habitat, and they strongly reflect the information of environmental changes. The objective of this study was to investigate differences in fine-root traits between two subtropical tree species, i.e., the early-succession species,Pinusmassoniana(PM), and the late-succession species,Castanopsiscarlesii(MZ) in their respective monoculture plantations in Sanming City, Fujian Province. Three 20m×20m plots were established in each forest type. Fine roots were extracted using soil core method and measured for their biomass, vertical distribution, and morphological and branching structure. The extinction coefficient (β) from the model of vertical root distribution:Y= 1 -βdwas used to represent root distribution. The results showed that root biomass density (RBD), root surface area density (RSD), and root length density (RLD) decreased with the increasing soil depth. Their levels in the 0—80 cm soil layer of the MZ stand were (0.21±0.06) kg/m3(RBD), (3.15±1.25) m2/m3(RSD), and (2202.84 ±517.03) m/m3(RLD), which were 1.6, 1.2, and 2.2 times higher than those in the PM stand, respectively. Soil depth had a significant effect on RBD, RSD, and RLD in both stands. Root extinction coefficients (β) for root biomass, root surface area, and root length were each higher in the PM stand than in the MZ stand, indicating that fine roots in the PM stand were distributed more evenly along the soil profile, while those in the MZ stand were concentrated primarily in the surface layer. The average root diameter (RD) and specific root surface area (SRA) in the PM stand were (0.86±0.04) mm and (191±32) cm2/g, respectively, which were 1.4 and 1.3 times larger than those in the MZ stand, respectively. Specific root length (SRL) and root tissue density (RTD) in the MZ stand were (10.73±0.46) m/g and (0.49±0.06) g/cm3, respectively, which were 1.4 and 2.0 times higher than in the PM stand. Soil depth had significant effects on RD, RTD and SRA and little effect on SRL in the MZ stand, whereas none of these variables were significantly affected by soil depth in the PM stand. RD and RTD differed significantly between these two stands in all soil depths. Except for the 0-10 cm soil layer, there was no significant difference between two stands at all depths in terms of SRA and SRL. Fine roots with coarser diameter and lower tissue density in the PM stand can grow rapidly to fill the soil space, adapting to the arid soil, whereas those with thinner diameter as well as higher SRL and RTD in the MZ stand enable them to strongly compete for nutrients while avoiding herbivory. Specific root tip density (SRT) and specific root forks density (SRF) of fine roots in the MZ stand were (4288.44±63.35) ind./g and (1164.35±155.38) ind./g, respectively, which were both 2.2 times those in the PM stand. Soil depth exerted significant effect only on SRT in the MZ stand. Roots with higher branching intensity in the MZ stand can rapidly exploit nutrient-rich soil patches. We conclude that there are contrasting fine-root traits in tree species at different succession stages, probably reflecting the differences in soil foraging strategy.
forest succession; fine root traits; root morphology; root architecture
国家自然科学基金重点项目(31130013); 福建省高校杰出青年科研人才培育计划项目(JA10057)
2013- 10- 31;
日期:2014- 11- 03
10.5846/stxb201310312641
*通讯作者Corresponding author.E-mail: Tonylcf99@yahoo.com.cn
王韦韦, 熊德成, 黄锦学, 黄超超, 杨智杰, 胡双成, 林成芳,陈光水.亚热带不同演替树种米槠和马尾松细根性状对比研究.生态学报,2015,35(17):5813- 5821.
Wang W W, Xiong D C, Huang J X, Huang C C, Yang Z J, Hu S C, Lin C F, Chen G S.Comparison of fine-root traits between two subtropical tree speciesPinusmassonianaandCastanopsiscarlesiidiffering in succession stages.Acta Ecologica Sinica,2015,35(17):5813- 5821.

