大兴安岭5种典型林型森林生物碳储量
胡海清, 罗碧珍 , 魏书精,2,3, 魏书威, 文正敏, 孙 龙 , 罗斯生 ,王立明, 马洪斌,*
1 东北林业大学, 林学院, 哈尔滨 150040 2 桂林理工大学, 土木与建筑工程学院, 桂林 541004 3 广西建筑新能源与节能重点实验室, 桂林 541004 4 兰州理工大学, 设计艺术学院, 兰州 730050
大兴安岭5种典型林型森林生物碳储量
胡海清1, 罗碧珍1, 魏书精1,2,3, 魏书威4, 文正敏2,3, 孙 龙1, 罗斯生1,王立明1, 马洪斌1,*
1 东北林业大学, 林学院, 哈尔滨 150040 2 桂林理工大学, 土木与建筑工程学院, 桂林 541004 3 广西建筑新能源与节能重点实验室, 桂林 541004 4 兰州理工大学, 设计艺术学院, 兰州 730050
森林生态系统是陆地生态系统的重要碳库,森林生态系统的生物碳储量作为森林生态系统碳库的重要组成部分,对全球碳循环与碳平衡产生重要作用。以大兴安岭5种典型林型为研究对象,结合森林资源清查资料,采用地理信息技术(GIS),将5种林型分龄组分别对乔木层、林下的灌木层、草本层和凋落物层各组分的单位面积生物量、含碳率和生物碳储量进行测定和计量估算,并从林分水平上,采用分龄组的方法,计量估算了生物碳储量。结果表明:大兴安岭5种典型林型不同龄组的生物碳储量分别为:兴安落叶松幼龄林、中龄林、近熟林和成熟林的生物碳储量分别为15.20、50.96、95.80t/hm2和109.33t/hm2;白桦幼龄林、中龄林、近熟林和成熟林的生物碳储量分别为15.36、30.67、41.62t/hm2和64.35t/hm2;樟子松幼龄林、中龄林、近熟林和成熟林的生物碳储量分别为29.89、59.92、90.01t/hm2和117.08t/hm2;蒙古栎幼龄林、中龄林、近熟林和成熟林的生物碳储量分别为11.17、11.90、34.94t/hm2和59.49t/hm2;山杨幼龄林、中龄林、近熟林和成熟林的生物碳储量分别为21.81、28.58、42.84t/hm2和64.39t/hm2。研究发现:5种典型林型不同龄组的森林生物碳储量均随着林龄(幼龄林、中龄林、近熟林和成熟林)的增长而增加,但不同林型的碳汇功能存在差异,同一种林型在不同林龄的生物碳储量增幅差异亦较大。尤其是大兴安岭目前林分质量比较差,幼龄林和中龄林所占的比重较大,若能对现有林分加以更好地抚育和管理,该区森林植被仍具有较大的碳汇潜力,碳汇功能将进一步增强,大兴安岭在国家的生态功能区建设中将发挥更重要的碳汇功能,对此提出了森林生态系统碳增汇管理策略与管理路径。研究结果为正确认识森林生物碳储量对区域碳平衡及生态环境的影响具有重要意义,以及在未来营林、造林活动中充分发挥人工林碳汇效应提供参考依据。
森林生物量; 碳储量; 典型林型; 大兴安岭; 森林生态系统管理; 碳汇管理措施
全球变化问题是人类社会共同面临的一个复杂系统的科学问题。随着全球气候变化的日益显著,气候变暖及其影响越来越引起科学界的关注[1- 2]。大气中CO2浓度从工业革命前的280μmol/L升至2011年的390μmol/L[3]。森林生态系统作为陆地生态系统的重要碳库和碳吸收汇,其在植被中储存的碳素在全球的碳循环中发挥重要碳汇功能,是全球碳循环与碳平衡研究的基础,并对全球的碳平衡产生重要影响,在调节气候变化、降低大气中温室气体浓度、减缓温室效应方面均有不可替代的作用[4- 14]。虽然全球森林面积仅占陆地面积的27%,但其生物量却占陆地生物量的85%,而其储存的碳量分别占全球植被碳储量的80%以上和全球土壤碳储量的40%以上[9,14- 16],其中森林生态系统生物碳储量达282.7GtC,约占全球植被碳储量的77%[8]。森林生物碳储量作为森林生态系统碳库的重要组成部分,在森林生态系统中发挥重要作用。由于森林生态系统是巨大的碳库,即使该碳库发生较小的变化就足以对全球的气候系统产生巨大影响[17]。森林生物量是森林生态系统的物质来源,是森林生态系统碳循环和碳动态分析的基础[18],同时森林生物量是森林生态系统固碳能力的重要标志,发挥重要的碳汇作用[19- 21]。目前,森林生物量与森林生态系统碳汇功能的研究越来越受到重视,从而使森林生物碳储量的研究成为研究热点[22- 25]。大兴安岭是我国唯一的寒温带针叶林区,同时作为国家重要的生态功能区与生态敏感区,对我国东北平原乃至华北平原起着重要的生态屏障作用,加强碳源碳汇的研究,对进一步定量评价其碳汇功能具有重要意义。据此,本文以黑龙江省大兴安岭5种典型林型为研究对象,系统研究各林型不同龄组和组分两种因子对生物量的影响,并对由此引起的森林生物碳储量及固碳能力的变化进行系统研究,旨在进一步定量计算森林生态系统的生物碳储量,并试图探讨影响森林生态系统碳储量变化的原因与各种因子的关系,以期为准确计量森林生物碳储量提供科学计量方法,为森林生态系统生物碳储量的估算提供参考数据。同时,对提高森林生态系统碳吸收能力,促进碳增汇,减少碳排放,发挥森林生态系统的碳效应,加强森林生态系统的可持续经营与管理均有重要意义,并提出了森林生态系统碳增汇管理策略,亦为正确认识森林生物碳储量对区域碳平衡及生态环境的影响,以及有效实施森林生态系统管理提供参考依据。
1 材料与方法
1.1 研究区概况
黑龙江省大兴安岭地区地处我国东北部,是我国位置最北、纬度最高且面积又最大的林区(50°10′—53°33′N,121°12′—127°00′E)。西接内蒙古呼伦贝尔盟,南临松嫩平原,北部与俄罗斯隔江相望,东靠黑河市,边境线长786km,全区土地总面积8.35×106hm2,是我国唯一的寒温带针叶林区。该区有林地面积为678.4万hm2,森林覆盖率81.23%。大兴安岭植物区的地带性植被属于寒温带针叶林(北方森林),以兴安落叶松(Larixgmelinii)为主要优势建群种。其他乔木树种主要有针叶乔木樟子松(Pinussylvestrisvar.mongolica)、偃松(Pinuspumila)、云杉(Piceakoraiensis)等和阔叶乔木白桦(Betulaplatyphylla)、黑桦(Betuladahurica)、蒙古栎(Quercusmongolica)、山杨(Populusdavidiana)、紫椴(Tiliaamurensis)等[26]。该林区的森林具有下列结构特征:(1)植物种类较少,多样性较低,树种以兴安落叶松为主,并混生有白桦,同时灌草层的结构亦较为单一,次生林以杨桦林混生为主。(2)垂直层较少,属于明亮针叶林区。(3)生活型结构较为特殊,乔木以兴安落叶松和白桦这两种树种占主流分布。
1.2 森林生物量调查
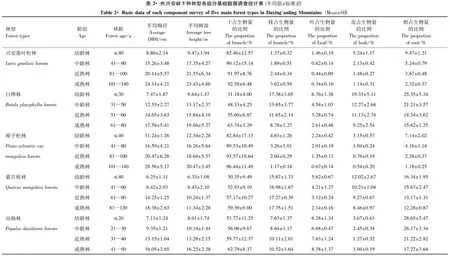
采用地理信息技术(GIS),结合森林资源调查资料、林分生长状况、林相图、植被分布图、土壤类型分布图和黑龙江省大兴安岭行政区划图,选择大兴安岭典型林分分布区,在大兴安岭北部的漠河林业局和塔河林业局,同时在大兴安岭南部的松岭林业局和新林林业局分别设置固定标准样地,并进行野外调查与样品的采集与采样。漠河林业局采样时间为2012年7月上旬,塔河林业局的采样时间为2012年7月中旬,松岭林业局的采样时间为2012年8月上旬,新林林业局的采样时间为2012年8月中旬。根据大兴安岭各林型林分分布的特点与采样时的实际情况,选择有代表性的5种林型(落叶松林、白桦林、樟子松林、蒙古栎林和山杨林),按照4种龄组(幼龄林、中龄林、近熟林和成熟林),由于过度开发,过熟林在大兴安岭地区较为少见,因此采样时没有对过熟林进行取样。大兴安岭5种主要林型树种龄级与龄组划分标准见表1,并按照此划分标准设置标准样地,进行调查与采样。把各林型的不同组分(乔木、林下的灌木、草本、凋落物等)作为研究对象,采用随机布点法,在每种林型各龄组分别设置20m×20m的3个重复样地作为固定标准样地。共设置固定标准样地240块(5种林型×3个重复×4龄组×4个林业局)。

表1 大兴安岭5种主要林型树种龄级与龄组划分表
1.2.1 乔木层生物量调查
根据乔木分布特点和生长状况,在设置好的标准样地内,以5cm为起测胸径(5cm以下胸径的小树当作灌木进行测定),调查因子包括胸径、树高(普鲁莱测高器测量树高)、树种、郁闭度、林龄、枝下高、冠幅和林分生长状况等,并分树种统计各径级的平均值,在每个固定标准样地内选取各径级的标准木3株。主要采集乔木的干、枝、叶、皮和根,其中干和皮分别从树干基部、胸径和梢头3个部位进行取样,枝带皮从粗枝到小枝按比例取样,叶亦分别从不同部位取样,根带皮从粗根到小根按比例分别取样。采集的样品野外称鲜重,并取样,标记好带回实验室进行实验测定及实验分析。
1.2.2 灌木层生物量调查
根据灌木分布的均匀程度沿标准样地的对角线设置小样方(每种林型每种龄组均有3个标准样地,每个标准样地亦有5个灌木样方,设置时沿标准样地的对角线设置5个小样方,当分布较为均匀时设置2m×2m重复样方5个,当分布不均匀时设置5m×5m重复样方5个)。调查灌木层的盖度、株数和平均高度,各树种数量、地径、高度等,然后按灌木种类收割样方内的所有灌木(包括灌木的根),称量并取样。
1.2.3 草本层生物量调查
在设置好的标准样地内沿另一对角线设置1m×1m的重复样方5个,调查草本层种类、盖度和平均高度,然后全部收割(包括草的根)、称量并取样。
1.2.4 凋落物层生物量调查
在标准样地内按对角线选取1m×1m的重复样方5个,分别收集小样方内的凋落物(枯枝和落叶、针叶和阔叶分开),记录其鲜质量并取样。
1.3 森林生物碳储量的计算方法
假设森林生物碳储量用Ct表示,森林生物量用M表示;森林生物量的含碳率用fc表示,森林生物碳储量的计算公式可以表示为:
Ct=M×fc
(1)
1.4 生物量测定方法
1.4.1 乔木层生物量的测定
乔木生物量的估测一般利用相对生长法。相对生长法主要是指Huxley[27]根据林木生长过程中各生长系之间有协调增长的规律,提出“异速生长”(Allometric)关系法则,亦称相对关系法则,其相对生长关系可用公式表示为[27- 35]:
Y=a(D2H)b
(2)
式中,Y表示生物量,D表示胸径,H表示树高,a、b为回归所得的常数。
异速生长法则的核心思想是建立生物量与主要测树因子,即胸径、树高的关系来计量乔木层生物量。根据实验测定结果重新拟合黑龙江省大兴安岭5种典型树种的生物量回归方程,然后利用采样分析结果得到系数a、b的值[28],再代入方程(2),根据D、H实测结果计算各树种各部位的生物量,根据各树种林龄等因子估算单位面积乔木生物量,并依据调查样地的单位面积生物量外推到林分水平[29- 31],林分水平的生物量计算公式如下:
Yf=Yt+YS+Yh+Yl
(3)
式中,Yf表示林分总生物量,Yt乔木层生物量,YS灌木层生物量,Yh草本层生物量,Yl凋落物层生物量。
1.4.2 灌木层生物量的测定
灌木层生物量的测定方法,主要通过计算含水率的方法推算单位面积内的生物量。把通过收割法采集得到的灌木样品带回到实验室后,把样品经85℃恒温烘干至恒重(间隔6h两次称量所得的含水率差小于0.1%即被视为达到恒重),用精度0.01g的电子天平称干重量,用公式(4)计算出样品不同器官的含水率(P),并通过含水率的方法换算出不同器官的生物量,不同器官的生物量相加便可计算出单位面积的生物量[29- 31]。灌木层生物量含水率的计算公式可表示为:
(4)
1.4.3 草本层生物量的测定
草本层生物量的测定方法与1.4.2节中灌木层生物量的测定方法相同。
1.4.4 凋落物层生物量的测定
凋落物层生物量的测定方法与1.4.2节中灌木层生物量的测定方法相同。
1.4.5 森林生物量含碳率的测定
对于森林生物碳储量的计量,一般用直接或间接测定植被生物量的现存量乘以生物量中含碳率进行推算[32- 35],本文通过直接测定生物量中含碳率的方法来计算森林生物碳储量[36]。通过对以上各生物量的实验样品进行3次粉碎法制样,样品含碳率的测定采用干烧法。用MultiN/C3000分析仪(Multi N/C3000, Analytik Jena AG, Jena, Germany)测定含碳率,每次测3个平行样,对测定结果取平均值作为一个样本数,测量精度为0.01%,误差为±0.2%。用公式(样品含碳率=样品碳含量/样品干重×100%)计算样品的含碳率。
2 结果与分析
2.1 各组分单位面积生物量
单位面积森林生物量主要包括乔木(干、枝、叶、皮和根)、灌木(包括根)、草本(包括根)和凋落物,通过1.2节森林生物量的调查所得到各龄组不同组分的样本数,乔木合计720个样本(标准木),灌木、草本和凋落物的样本数分别为1200个。对测定结果进行统计分析,不同林型各组分生物量的测定结果在以下各部分分别进行阐述。
2.1.1 乔木层单位面积生物量
根据乔木每木检尺调查,大兴安岭5种林型各组分每木调查的基础数据见表2。从表2中可看出,在大兴安岭5种林型的不同龄组中,平均胸径从大到小的基本排列顺序为:樟子松林>兴安落叶松林>白桦林>蒙古栎林>山杨林,其中在幼龄林和中龄林时蒙古栎林的平均胸径小于山杨林,在成熟林时白桦林的平均胸径小于蒙古栎林,针叶树种的平均胸径>阔叶树种的平均胸径;其平均树高从大到小的依次排列顺序为:兴安落叶松林>樟子松林>白桦林>山杨林>蒙古栎林,其中在幼龄林时,樟子松林>白桦林>兴安落叶松林,针叶树种的平均树高>阔叶树种的平均树高。兴安落叶松林干和枝所占的比例均随着林龄的增长而增加,相反叶、皮和根所占的比例则随着林龄的增长反而减少。樟子松林干所占的比例亦随着林龄的增长而增加,但其增加的速度快于兴安落叶松林,然而其枝所占的比例却随着林龄的增加而下降,同时其叶、皮和根所占的比例亦随着林龄的增长而减少,由于樟子松林自然整枝能力较强,因而其枝条一般少于兴安落叶松林,导致随着林龄的增长其枝所占的比例反而下降。白桦林的干所占的比例总体上随着林龄的增加而增多,但其增加的速度慢于兴安落叶松林,然而其枝、叶、皮和根所占的比例均随着林龄的增长而减少。蒙古栎林干和枝所占的比例总体上亦随着林龄的增加而增多,但干和枝增长的速度均表现为较为缓慢的增长趋势,其叶、皮和根所占的比例亦随着林龄的增长而表现为缓慢下降。山杨林的干、枝和叶所占的比例均随着林龄的增长而变多,但其增长的速度均较为缓慢,其皮和根所占的比例也随着林龄的增长而缓慢下降。综上所述,大兴安岭5种林型均随着林龄的增长,生物量有向地上部分生物量增加的趋势。
将标准样地内每株树的胸径和树高数据代入式(2)计算其生物量,然后再加起来得到整个样地的生物量,生物量的计量结果见表3。从表3可知各林型单位面积乔木层生物量总体上由大到小的排列顺序为:樟子松林>兴安落叶松林>山杨林>白桦林>蒙古栎林。从总体上看,大兴安岭5种林型乔木层生物量均随着林龄的增长而增加。从林型上看,其中兴安落叶松林和樟子松林两种针叶林的增长速度较快,兴安落叶松林的乔木生物量从幼龄林的18.27t/hm2,增加到成熟林的193.53t/hm2,樟子松林的乔木生物量从幼龄林的43.47t/hm2,增加到成熟林的212.22t/hm2,樟子松林乔木生物量的增长速度慢于兴安落叶松林,但樟子松林成熟林乔木生物量高于兴安落叶松林。而白桦林、山杨林和蒙古栎林等3种阔叶林的增长速度较慢,白桦林的乔木生物量从幼龄林的16.04t/hm2,增加到成熟林的120.49t/hm2,山杨林的乔木生物量从幼龄林的25.02t/hm2,增加到成熟林的121.45t/hm2,蒙古栎林的乔木生物量从幼龄林的9.15t/hm2,增加到成熟林的123.44t/hm2。从林型的各龄组进行分析发现,蒙古栎林的乔木层生物量在幼龄林9.15t/hm2、中龄林21.10t/hm2和近熟林69.02t/hm2时均表现为最低,樟子松林的乔木层生物量在幼龄林43.47t/hm2和中龄林103.81t/hm2时均表现为最高,而近熟林时生物量最高的是兴安落叶松林达到174.19t/hm2,成熟林时白桦林的生物量最低120.49t/hm2,樟子松林在成熟林时生物量亦高达212.22t/hm2。
从不同龄组看,幼龄林单位面积乔木层生物量中樟子松林的生物量最大达到43.47t/hm2,生物量最小的是蒙古栎林仅为9.15t/hm2;中龄林单位面积乔木层生物量中樟子松林的生物量最大达到103.81t/hm2,生物量最小的是蒙古栎林仅为21.10t/hm2;近熟林单位面积乔木层生物量中兴安落叶松林的生物量最大达到174.19t/hm2,生物量最小的是蒙古栎林仅为69.02t/hm2;成熟林单位面积乔木层生物量中樟子松林的生物量最大达到212.22t/hm2,生物量最小的是山杨林仅为121.45t/hm2。森林乔木层生物量随着林龄的增长,各林型乔木层生物量的增长速度并不相同,出现消长的情况,但总体上是随着林龄的增长其乔木层生物量不断增加。因此在估测森林生物量时一定要充分考虑林龄因子对生物量的重要影响。
2.1.2 灌木层单位面积生物量
通过1.2节森林生物量调查所得到的各林型灌木层的样本数为1200个,对测定结果进行统计分析,单位面积灌木层生物量见表4,从表4可看出,各林型单位面积灌木层生物量总体上由大到小的排列顺序为:白桦林>山杨林>兴安落叶松林>樟子松林>蒙古栎林。单位面积灌木层生物量排列顺序与乔木层生物量的排列顺序并不相同,兴安落叶松林和樟子松林的乔木层生物量相对较大,但其灌木层生物量却小于白桦林和山杨林,而蒙古栎林不论乔木层还是灌木层的生物量均低于其他4种林型。这主要是因为单位面积灌木层生物量同样由于气候类型、立地类型、树种构成以及人为干扰等因子的影响,导致产生较大的异质性,因而造成单位面积灌木层生物量相差较大。
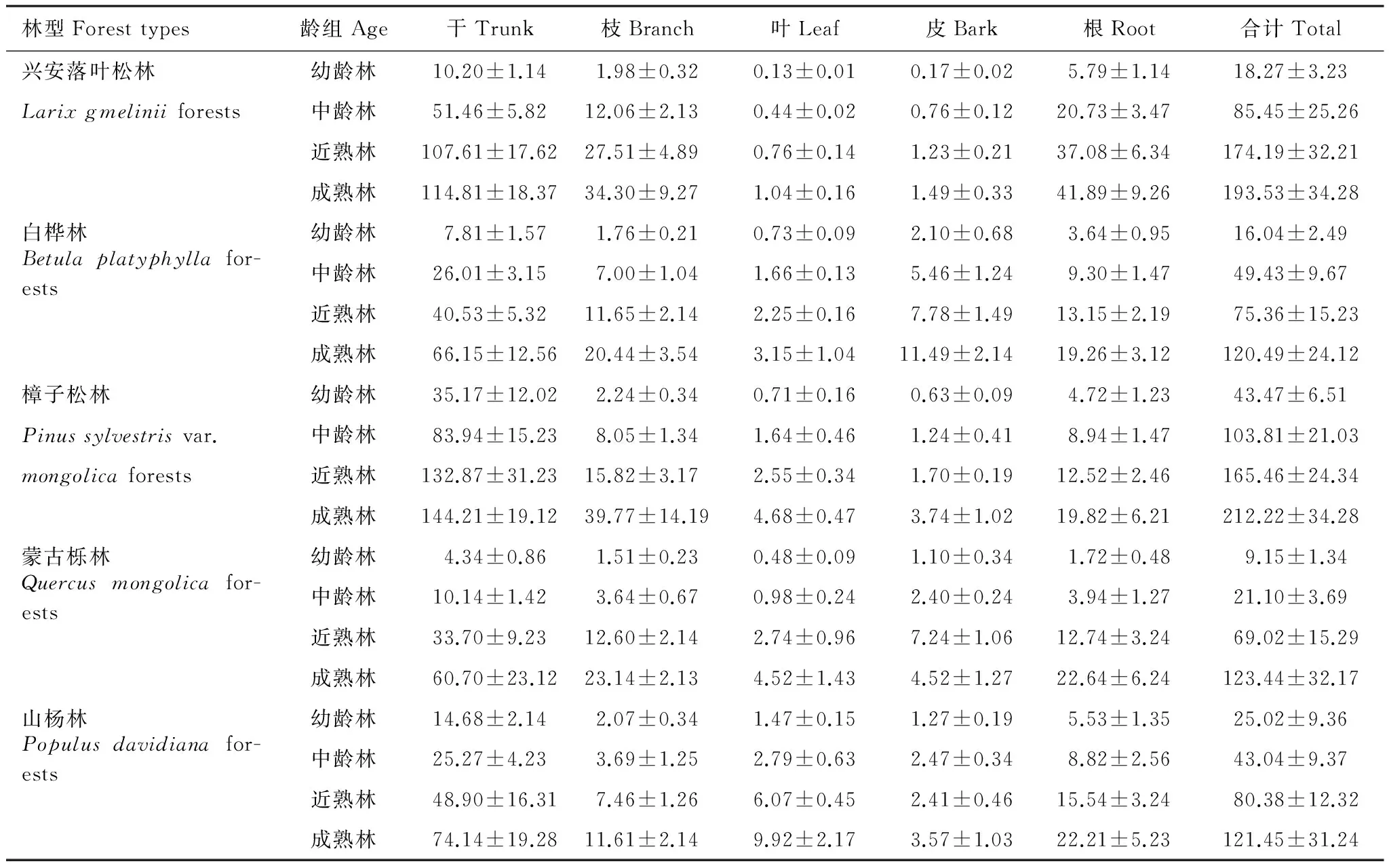
表3 大兴安岭5种林型乔木层各组分生物量(平均值±标准差,t/hm2)
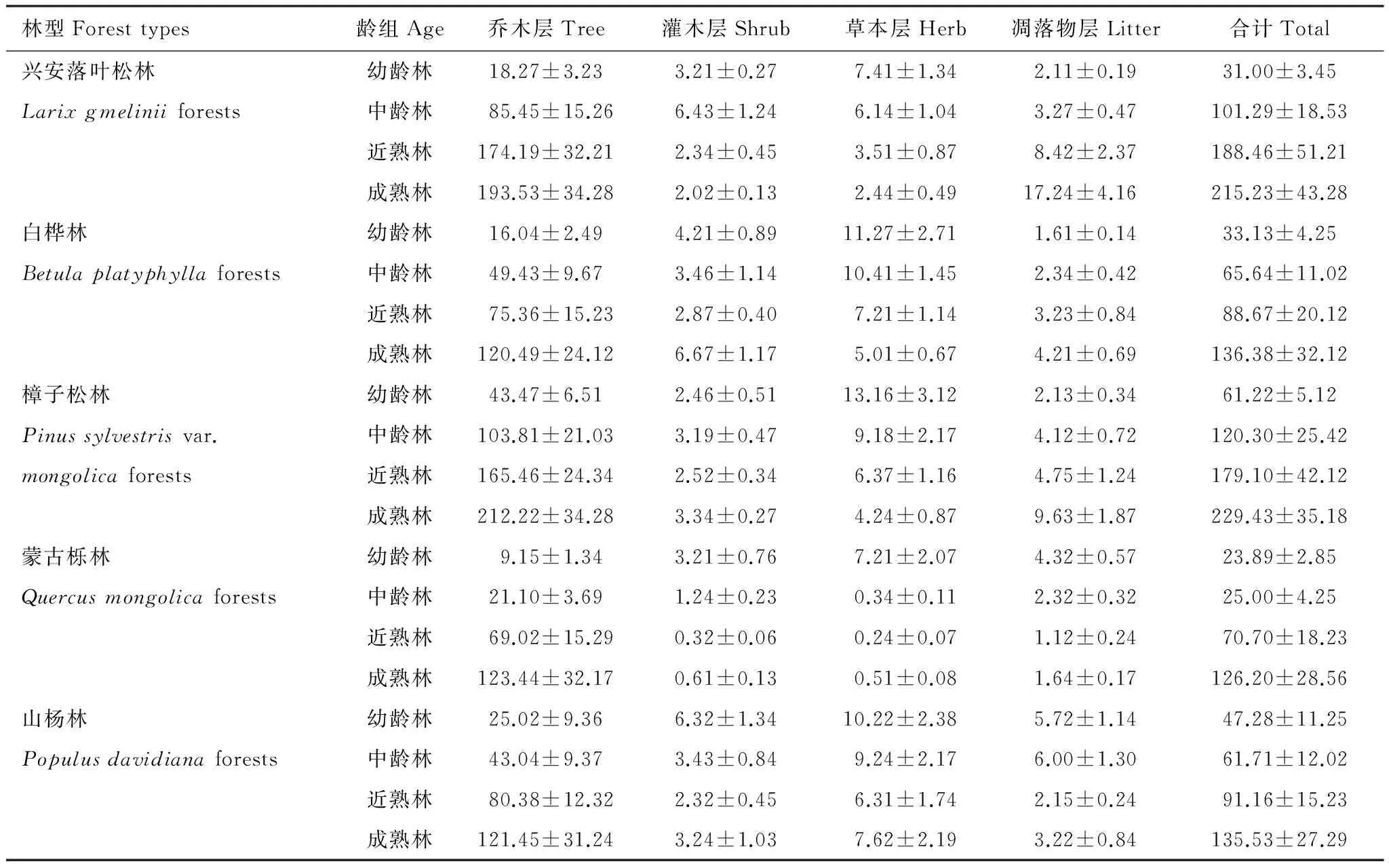
表4 大兴安岭5种林型各组分单位面积生物量(平均值±标准差, t/hm2)
从不同龄组看,幼龄林单位面积灌木层生物量中山杨林的生物量最大达到6.32t/hm2,生物量最小的是樟子松林仅为2.46t/hm2;中龄林单位面积灌木层生物量中兴安落叶松林的生物量最大达到6.43t/hm2,生物量最小的是蒙古栎林仅为1.24t/hm2;近熟林单位面积灌木层生物量中白桦林的生物量最大达到2.87t/hm2,生物量最小的是蒙古栎林仅为0.32t/hm2;成熟林单位面积灌木层生物量中白桦林的生物量最大达到6.67t/hm2,生物量最小的是山杨林仅为0.61t/hm2。各林型灌木层生物量随着林龄的增长,不同林型灌木层生物量出现较大的变化,与各林型乔木层生物量的变化规律不同,灌木层生物量的变化规律并不随着林龄的增长而不断增加。蒙古栎林的灌木层生物量从幼龄林的3.21t/hm2下降到成熟林的0.61t/hm2。蒙古栎林的灌木层生物量从幼龄林的3.21t/hm2下降到成熟林的0.61 t/hm2。兴安落叶松林和山杨林的灌木层生物量均呈下降的趋势,但中间有波动,其中兴安落叶松林在中龄林时,其灌木层单位面积生物量反而上升到6.43t/hm2,而山杨林在近熟林时,其灌木层生物量下降到2.32t/hm2。白桦林在中龄林和近熟林时单位面积灌木层生物量均较低,在成熟林时增加到6.67t/hm2。樟子松林的单位面积灌木层生物量在幼林龄和近熟林时均表现为较低,成熟林时其生物量达到3.34t/hm2。因此,在估测森林灌木层生物量时一定不要忽略林龄因子对森林灌木层生物量的影响。
2.1.3 草本层单位面积生物量
通过1.2节森林生物量调查所得到的各林型草本层的样本数1200个,对测定结果进行统计分析,单位面积草本层生物量见表4,从表4可看出,各林型单位面积草本层生物量总体上由大到小的排列顺序为:白桦林>山杨林>樟子松林>兴安落叶松林>蒙古栎林。单位面积草本层生物量排列顺序与乔木层生物量的排列顺并不相同,兴安落叶松林和樟子松林的乔木层生物量相对较大,但其草本层生物量却小于白桦林和山杨林,而蒙古栎林不论乔木层还是草本层的生物量均低于其他4种林型。这主要是因为单位面积草本层生物量同样由于气候类型、立地类型、树种构成以及人为干扰等因子的影响,导致产生较大的异质性,因而造成单位面积草本层生物量相差较大。
从不同龄组看,幼龄林单位面积草本层生物量中樟子松林的生物量最大达到13.16t/hm2,生物量最小的是蒙古栎林仅为7.21t/hm2;中龄林单位面积草本层生物量中白桦林的生物量最大达到10.41t/hm2,生物量最小的是蒙古栎林仅为0.34t/hm2;近熟林单位面积草本层生物量中白桦林的生物量最大达到7.21t/hm2,生物量最小的是蒙古栎林仅为0.24t/hm2;成熟林单位面积草本层生物量中山杨林的生物量最大达到7.62t/hm2,生物量最小的是山杨林仅为0.51t/hm2。各林型草本层生物量随着林龄的增长,不同林型草本层生物量变化与各林型乔木层生物量的变化规律相反,单位面积草本层生物量总体上呈不断下降的规律,但蒙古栎林和山杨林在成熟林时,其草本层生物量大于近熟林,研究发现草本层生物量的消长与林型的郁闭度密切相关,在幼龄林时,乔木层的郁闭度较低,随着林龄的增长,郁闭度提高,而蒙古栎林和山杨林在成熟林时其郁闭度下降,从而影响单位面积草本层生物量。蒙古栎林的草本层生物量从幼龄林的7.21t/hm2下降到成熟林的0.51 t/hm2,下降幅度最快。山杨林的草本层生物量从幼龄林的10.22 t/hm2下降到成熟林的7.62 t/hm2,下降幅度较慢。兴安落叶松林、白桦林和樟子松林草本层生物量均呈逐步下降的趋势。
2.1.4 凋落物层单位面积生物量
通过1.2节森林生物量的调查所得到的各林型凋落物层的样本数1200个,对测定结果进行统计分析,单位面积凋落物生物量见表4,从表4可看出,各林型单位面积凋落物层生物量总体上由大到小的排列顺序为:兴安落叶松林>樟子松林>山杨林>白桦林>蒙古栎林。单位面积凋落物层生物量排列顺序与乔木层生物量的排列顺序并不相同,兴安落叶松林和樟子松林的乔木层和凋落物层的生物量均相对较大,但其凋落物层生物量亦相对较大,而蒙古栎林不论乔木层还是凋落物层的生物量均低于其他4种林型。这主要是因为单位面积凋落物层生物量同样由于气候类型、立地类型、树种构成以及人为干扰等因子的影响,导致产生较大的异质性,因而造成单位面积凋落物层生物量相差较大。
从不同龄组看,兴安落叶松林、白桦林和樟子松林的单位面积凋落物层生物量随着林龄的增长而增加,而山杨林和蒙古栎林的单位面积凋落物层生物量则随着林龄的增长而减少。由于大兴安岭地处北方寒温带针叶林区,气候寒冷干燥,凋落物较难分解腐殖化,因而单位面积凋落物层生物量积累较多,尤其是针叶林(兴安落叶松林和樟子松林)在气候寒冷干燥的条件下更难分解,从而导致随着林龄的增长其凋落物生物量增长较快。兴安落叶松林单位面积凋落物层生物量从幼龄林的2.11t/hm2增加到成熟林的17.24t/hm2,增加到原来的8.17倍。樟子松林单位面积凋落物层生物量从幼龄林的2.13t/hm2增加到成熟林的9.63t/hm2,增加到原来的4.52倍。而白桦林作为阔叶林其单位面积凋落物层生物量从幼龄林的1.61t/hm2增加到成熟林的4.21t/hm2,增幅较为平缓。然而山杨林和蒙古栎林作为阔叶林,其单位面积凋落物层生物量从幼龄林到成熟林不但未增加,反而下降,蒙古栎林的单位面积凋落物层生物量从幼龄林的4.32t/hm2到成熟林1.64t/hm2,而蒙古栎林的单位面积凋落物层生物量虽然总体上呈现减少趋势,但中龄林高于幼龄林,成熟林高于近熟林。
2.2 各林型单位面积生物量
各林型单位面积生物量包括乔木层生物量、灌木层生物量、草本层生物量和凋落物层生物量,结合表3和表4可得出各林型不同龄组单位面积生物量。总体上看各林型不同龄组单位面积生物量由大到小的排列顺序为:樟子松林>兴安落叶松林>山杨林>白桦林>蒙古栎林。兴安落叶松林不同龄组中幼龄林、中龄林、近熟林和成熟林的单位面积生物量分别为31.00、101.29、188.46t/hm2和215.23t/hm2;白桦林不同龄组幼龄林、中龄林、近熟林和成熟林的单位面积生物量分别为33.13、65.64、88.67t/hm2和136.38t/hm2;樟子松林不同龄组中幼龄林、中龄林、近熟林和成熟林的单位面积生物量分别为61.22、120.30、179.10t/hm2和229.43t/hm2;蒙古栎林不同龄组中幼龄林、中龄林、近熟林和成熟林的单位面积生物量分别为23.89、25.00、70.70t/hm2和126.20t/hm2;山杨林不同龄组中幼龄林、中龄林、近熟林和成熟林的单位面积生物量分别为47.28、61.71、91.16t/hm2和135.53t/hm2。
从不同林型的龄组上进行分析,在幼龄林中单位面积生物量由大到小的排列顺序为:樟子松林>山杨林>白桦林>兴安落叶松林>蒙古栎林;在中龄林中单位面积生物量由大到小的排列顺序为:兴安落叶松林>樟子松林>白桦林>山杨林>蒙古栎林;在近熟林中单位面积生物量由大到小的排列顺序为:兴安落叶松林>樟子松林>山杨林>白桦林>蒙古栎林;在成熟林中单位面积生物量由大到小的排列顺序为:樟子松林>兴安落叶松林>白桦林>山杨林>蒙古栎林。从总体上看,单位面积生物量随着林龄的增长而增加,但各林型的增长速度不同。其中兴安落叶松林的增长速度最快,从幼龄林单位面积生物量的31.00t/hm2增加到成熟林的215.23t/hm2,增加到原来的6.94倍;其次蒙古栎林各龄组的单位面积生物量虽然相对较少,但增长速度较快,从幼龄林单位面积生物量的23.89t/hm2增加到成熟林的126.20t/hm2,增加到原来的5.28倍;白桦林从幼龄林单位面积生物量的33.13t/hm2增加到成熟林的136.38t/hm2,增加到原来的4.12倍;樟子松林虽然幼龄林单位面积生物量达到61.22t/hm2,但从幼龄林到成熟林生物量的229.43t/hm2,只增加到原来的3.75倍;山杨林从幼龄林单位面积生物量的47.28t/hm2增加到成熟林的135.53t/hm2,其幼龄林的单位面积生物量最多,但随着林龄的增长,其生物量增加速度反而最慢,仅增加到原来的2.87倍。
2.3 不同林型生物量含碳率
大兴安岭5种典型林型不同组分的森林生物量含碳率,根据MultiN/C3000进行测定的结果见表5。
表5中可看出,从林型各组分看,各组分生物量的含碳率从高到低的依次排列顺序为:乔木层>灌木层>草本层>凋落物层。从不同林型的乔木树种的形态来看,其含碳率的排序是:针叶林>阔叶林。从不同林型之间的乔木层含碳率来看,兴安落叶松林>樟子松林>蒙古栎林>白桦林>山杨林。从龄组上看,乔木层干的生物量含碳率一般随着林龄的增加而变大,其含碳率的增幅排序是:蒙古栎林>樟子松林>山杨林>兴安落叶松林>白桦林。
乔木层枝的含碳率的变化规律与干的变化规律相同,其含碳率亦随着林龄的增加而变大,但各乔木层枝的含碳率增幅均不大,兴安落叶松林、白桦林、樟子松林、蒙古栎林和山杨林各乔木层的枝部分含碳率从幼龄林到成熟林分别增加了0.42%、3.20%、4.36%、7.25%和2.58%,其中蒙古栎林的增幅最大,其次是樟子松林,增幅最小的是兴安落叶松林。樟子松林、蒙古栎林和山杨林乔木层叶的含碳率的变化规律与乔木干的变化趋势相同,但兴安落叶松林和白桦林含碳率的变化规律随着林龄增加有波动中上升的趋势。兴安落叶松林在成熟林时,其乔木层叶的含碳率反而小于近熟林,白桦林在中龄林和近熟林时,其乔木层叶的含碳率小于幼龄林。乔木层皮的含碳率随着林龄的增加其变化规律总体上呈现上升趋势,但兴安落叶松林的中龄林小于幼龄林。乔木根的含碳率随着林龄的增加其变化规律亦在总体上呈现增加趋势。
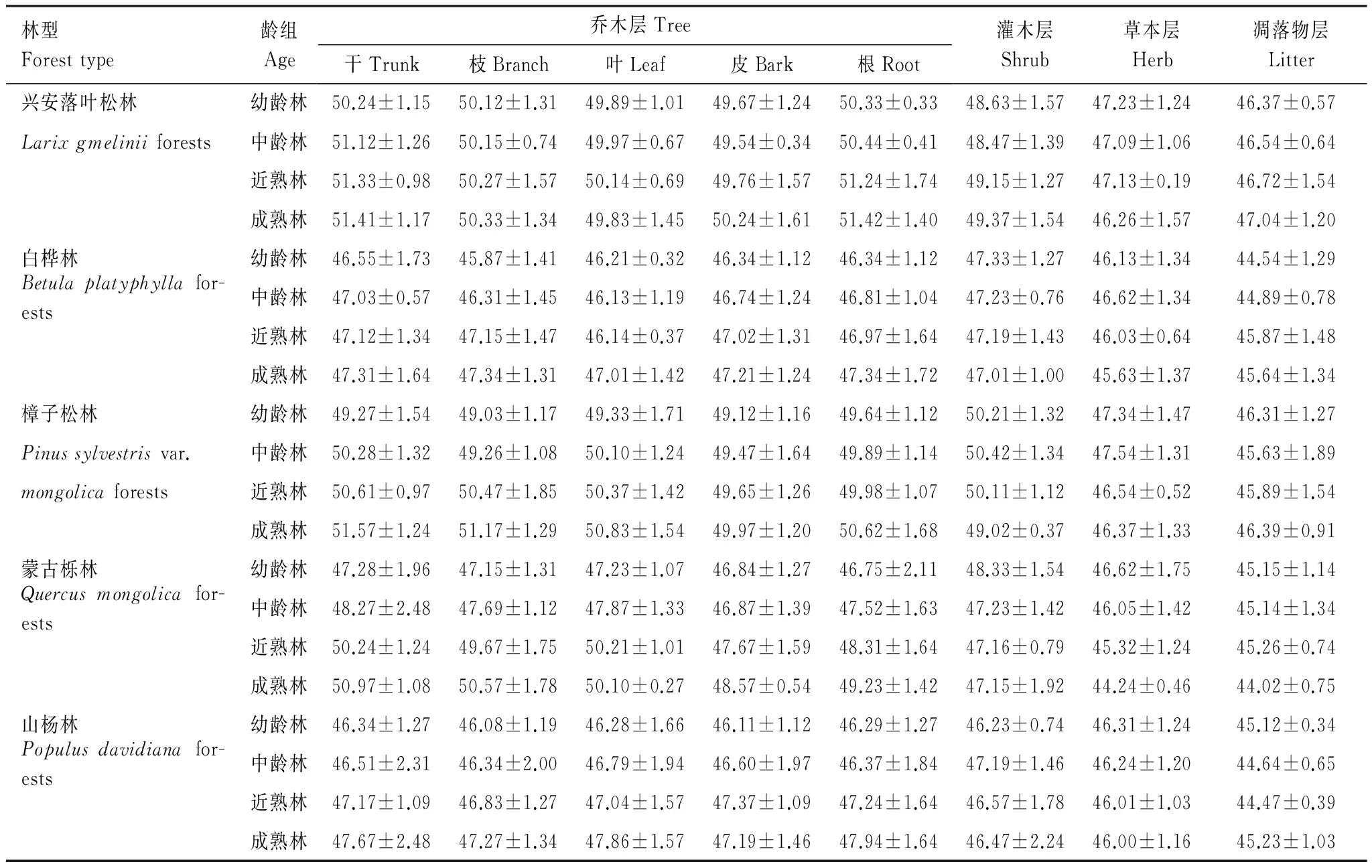
表5 大兴安岭5种林型不同组分的森林生物量含碳率(平均值±标准差,%)
国际上对各种树种常采用50%的含碳率来计量生物量的碳储量[37- 40],国内外研究者大多也采用50%作为所有树种的平均含碳率,而对非木质部分的凋落物、草本等通常采用45%的平均含碳率[41- 42]。从表5中可看出各林型中的木质部分(乔木、灌木)的含碳率比较接近50%,而非木质部分(草本、凋落物)的含碳率比较接近45%。在林分水平上,针叶林的含碳率高于阔叶林的含碳率,其中兴安落叶松林的含碳率最高,其次为樟子松林的含碳率,含碳率最低的是山杨林。
2.4 不同林型单位面积森林生物碳储量
森林生物碳储量是森林生物量与生物量含碳率的乘积[43]。大兴安岭5种不同林型单位面积森林生物碳储量见表6,从表6可知,乔木层的碳储量一般随着林龄的增加而增大,但各林型的增长幅度相差较大。兴安落叶松林、白桦林、樟子松林、蒙古栎林和山杨林各乔木层的碳储量从幼龄林到成熟林分别增加了10.82%、7.65%、5.09%、13.52%和5.00%。在不同林型下,灌木层的碳储量随林龄的变化差异较大。兴安落叶松林从幼龄林到中龄林灌木层的碳储量表现为增加、而从中龄林到成熟林又表现为减少的趋势。白桦林从幼龄林到成熟林灌木层的碳储量一直表现为增加趋势,且增幅较大。樟子松林灌木层的碳储量波动较大。蒙古栎林和山杨林灌木层碳储量从幼龄林到成熟林均表现为减少的规律,减少的百分比分别为5.35%和1.93%。
草本层的碳储量总体上随着林龄的增加而减少,但蒙古栎林和山杨林草本层的碳储量在成熟林时均高于近熟林。兴安落叶松林、白桦林和樟子松林各乔木层碳储量从幼龄林到成熟林分别发生变化的百分比为3.10%、2.27%和3.16%,其中蒙古栎林从幼龄林到近熟林减幅达到30.55%,而山杨林从幼龄林到近熟林减幅仅为1.63%。各林型凋落物层的碳储量随着林龄的变化相对较大。兴安落叶松林、白桦林和樟子松林均表现为随着林龄的增加而增长,各林型的增长百分比分别为8.28%、2.67%和4.52%。而蒙古栎林凋落物层的碳储量随着林龄的增加反而减少,减少幅度达到2.71%。山杨林的凋落物层的碳储量变化幅度较大,从幼龄林到中龄林开始表现为增加,而从中龄林到近熟林又表现为减少的趋势,然后从近熟林到成熟林表现为增加的规律。
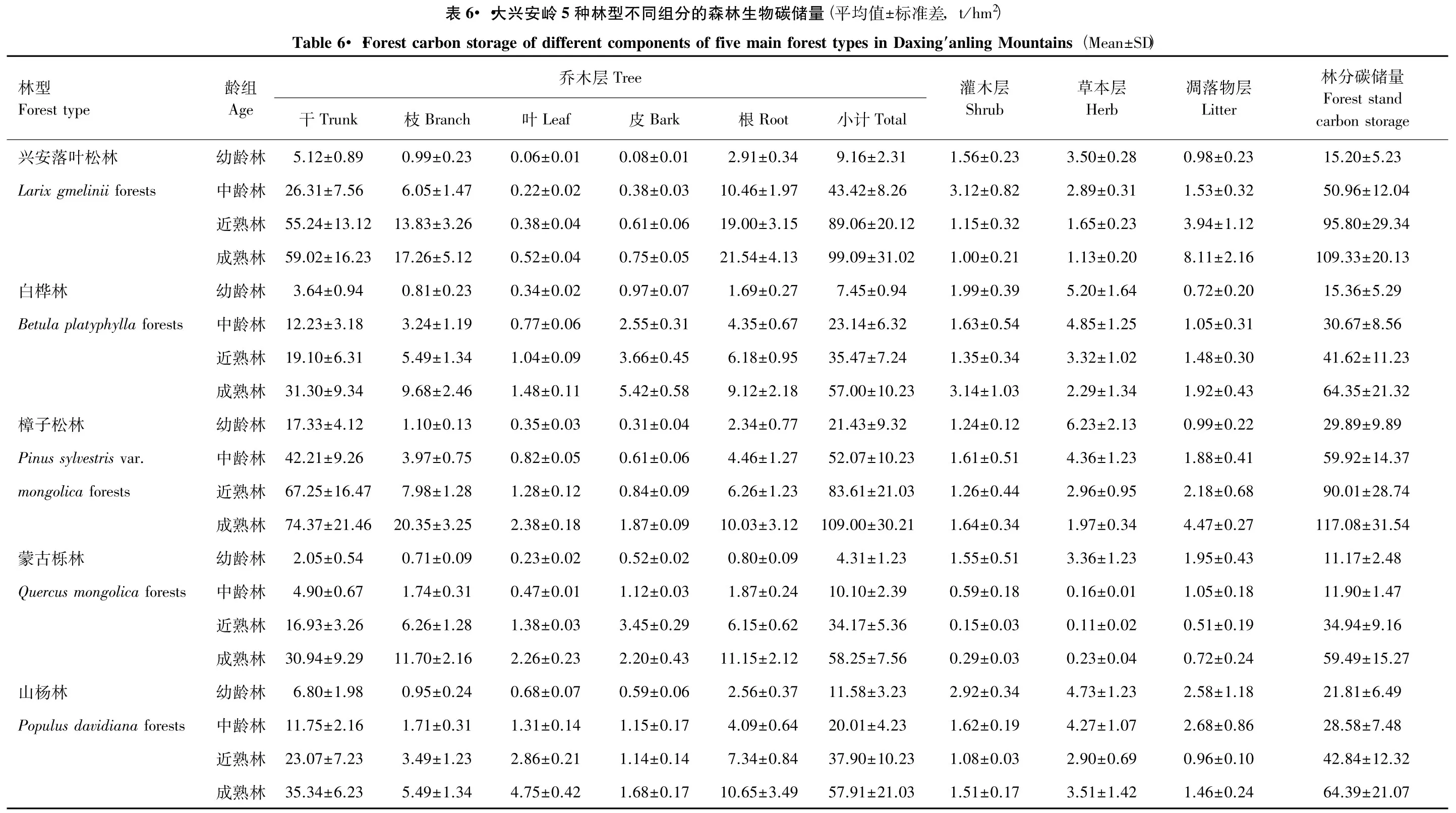
从表6中可看出大兴安岭5种典型林型不同龄组的森林生物碳储量。其中兴安落叶松林单位面积生物碳储量从幼龄林的15.20t/hm2增加到成熟林的109.33t/hm2,增加了7.19倍。白桦林单位面积生物碳储量从幼龄林的15.36t/hm2到成熟林的64.35t/hm2,增加了4.19倍。樟子松林单位面积生物碳储量从幼龄林的29.89t/hm2到成熟林的117.08t/hm2,增加了3.92倍。蒙古栎林单位面积生物碳储量从幼龄林的11.17t/hm2到成熟林的59.49t/hm2,增加了5.33倍。山杨林单位面积生物碳储量从幼龄林的21.81t/hm2到成熟林的64.39t/hm2,增加了2.95倍。从幼龄林到成熟林单位面积生物碳储量由大到小的增幅排列顺序为:兴安落叶松林>蒙古栎林>白桦林>樟子松林>山杨林。其中增加幅度最快的是兴安落叶松林,增加到原来的7.19倍;增加幅度最慢的是山杨林。
3 结论与讨论
黑龙江省大兴安岭是我国典型的明亮针叶林分布区,该区植被和土壤中储存的碳量,在区域碳循环与碳平衡中发挥重要作用。研究发现大兴安岭5种典型林型不同龄组的森林生物碳储量均随着林龄(幼龄林、中龄林、近熟林和成熟林)的增长而增加,但不同林型的碳汇功能存在差异,同一种林型在不同林龄的生物碳储量增幅差异也较大。5种林型的生物碳储量分别为:兴安落叶松幼龄林、中龄林、近熟林和成熟林分别为15.20、50.96、95.80t/hm2和109.33t/hm2;白桦幼龄林、中龄林、近熟林和成熟林分别为15.36、30.67、41.62t/hm2和64.35t/hm2;樟子松幼龄林、中龄林、近熟林和成熟林分别为29.89、59.92、90.01t/hm2和117.08t/hm2;蒙古栎幼龄林、中龄林、近熟林和成熟林分别为11.17、11.90、34.94t/hm2和59.49t/hm2;山杨幼龄林、中龄林、近熟林和成熟林分别为21.81、28.58、42.84t/hm2和64.39t/hm2。其中兴安落叶松林单位面积生物碳储量从幼龄林到成熟林增加了7.19倍,增幅较大,随着林龄的增长碳汇功能较强。白桦林单位面积生物碳储量从幼龄林到成熟林增加了4.19倍。樟子松林单位面积生物碳储量从幼龄林到成熟林增加了3.92倍。蒙古栎林单位面积生物碳储量从幼龄林到成熟林增加了5.33倍。山杨林单位面积生物碳储量从幼龄林到成熟林增加了2.95倍,增幅较小。
3.1 不同林龄碳汇功能的变化
林龄被认为森林结构与功能的主要驱动因子,许多学者的研究表明森林林龄是决定生态系统碳通量与碳储量的关键因子,是影响森林生态系统碳汇功能变化的主要因子。许多研究的结果表明森林生态系统碳汇随着林龄的增加而增长,尤其是周国逸等通过对广东省鼎湖山国家自然保护区内一片林龄400多年的成熟森林土壤25a的连续观测发现成熟森林土壤可持续积累有机碳,成熟森林仍然发挥着巨大的“碳汇”作用[44]。由于大兴安岭林区的开发始于20世纪60年代,尤其是改革开放初期对大兴安岭的大规模开发,而且由于对木材的过度依赖,导致森林资源破坏严重,林分结构发生较大变化,大兴安岭原始林不复存在,取而代之的是以次生林和人工林为主,近熟林和成熟林亦遭到破坏,目前留下的基本是幼龄林以及中龄林,所以许多对大兴安岭森林生物量及生物碳储量的研究主要集中于幼龄林以及中龄林[45]。本文通过选取大兴安岭5种代表性林型不同林龄的生物碳储量作为研究对象,研究结果表明相同林型各组分均随着林龄的增长,其生物碳储量均呈现为较明显的递增趋势,尤其是从幼龄林过度到近熟林阶段,单位面积生物碳储量增长较快。根据第八次森林资源调查资料可知,大兴安岭林区目前森林的林龄仍然处在幼龄林和中龄林较多,因此森林生态系统的碳储潜力较大,应采取科学有效的森林经营管理措施,不断增加森林碳汇量,充分发挥林区的碳汇功能。
3.2 不同林型碳汇功能的潜力差异
许多研究发现不同林型生物量碳汇及其积累速率随林龄的增加呈现较大差异,阔叶林各林龄组的生物碳储量均大于针叶林相应林龄组的水平,而且这种差距随着林龄的增长而增大。本文研究发现,大兴安岭5种不同林型的碳汇功能存在较大差异,幼龄林时不同林型生物碳储量取值范围为11.17—29.89t/hm2;中龄林时不同林型生物碳储量取值范围为11.90—59.92t/hm2;近熟林时不同林型生物碳储量取值范围为34.94—95.80t/hm2;成熟林时不同林型生物碳储量取值范围为59.49—117.08t/hm2;兴安落叶松林生物碳储量从幼龄林到成熟林增加了7.19倍,增幅呈直线上升。白桦林生物碳储量从幼龄林到成熟林增加了4.19倍,呈现出明显的随着林龄增长碳汇功能较强的趋势。樟子松林生物碳储量从幼龄林到成熟林增加了3.92倍。蒙古栎林生物碳储量从幼龄林到成熟林增加了5.33倍。山杨林生物碳储量从幼龄林到成熟林增加了2.95倍,从以上5种林型生物碳储量的变化趋势可知,各种林型均表现为持续增长的趋势,但增幅较小,尤其是整体上碳固定能力还不强,碳密度低于我国平均森林碳密度[8]。针叶林(除蒙古栎林)各林龄组的生物碳储量均大于阔叶林相应林龄组的水平,而且这种差距随着林龄的增长而增大。因此,通过科学经营管理森林生态系统,充分挖掘潜力,大兴安岭林区的森林生态系统在全球碳循环中将发挥更大的作用。
3.3 气候变化对生物碳储量的影响
全球变化问题是人类社会共同面临的一个复杂系统的科学问题,近年来,尤其是随着全球气候变化的日益显著,气候变暖及其影响越来越引起学者们的广泛关注[6]。森林生态系统是陆地生态系统的主体,储存着大量的碳汇、发挥着重要的碳汇效应,然而,随着气候变暖的日益加剧,森林生态系统在陆地生态系统碳平衡中是扮演碳源还是碳汇功能引起学者们的广泛关注,近年来,不少研究者对不同国家或区域的各林型生物碳储量开展了相应的大量研究,研究者们在研究中发现,在北半球的中高纬度地区的生态系统是重要碳库,是“迷失的碳汇”的重要固定场所[46]。而我国大兴安岭林区地处高纬度地区,属于寒温带针叶林区,亦是我国乃至世界气候变化的敏感地区,通过加强该区主要森林林型的生物碳储量及碳汇潜力研究,以利于了解森林生态系统的碳汇功能,从而有利于进一步量化对森林生态系统生物碳储量的科学计量,对解释“迷失的碳汇”问题,进一步了解气候变化背景下生态系统碳源碳汇的动态变化规律具有重要意义。森林生态系统对温室效应的影响研究是全球气候变化研究的主要内容,本文通过开展生物碳储量的研究,有利于进一步量化森林生态系统对大气CO2的碳汇功能。学者们研究发现我国森林生物碳储量水平地带分布上主要表现为东部区域生物碳储量随纬度升高而下降的趋势[47],然而大兴安岭林区虽然位于我国东北的寒温带针叶林区,处于我国的高纬度地区,本文研究结果表明,该林区的单位面积生物碳储量相对较高。黑龙江省大兴安岭寒温带针叶林地带性植被多为原生林,种群的密度较大,因而该林区植被固碳能力仍然较强。兴安落叶松林是大兴安岭林区地带性植被类型,蒋延玲等[48]利用CENTURY模型模拟该林型的碳循环并探讨全球变化对其碳循环的影响,研究发现,兴安落叶松林是一个重要的碳汇,年净吸收碳2.65t/hm2。多种气候模型模拟的结果表明气候变化将进一步加剧,为充分应对气候变化的挑战,应加强对大兴安岭林区的森林生态系统进行科学合理的管理,不断促进森林生态系统健康稳定的发展,优化大兴安岭林区的碳汇功能。
3.4 大兴安岭森林碳汇功能变化趋势
森林生态系统在全球生态系统碳平衡中扮演重要角色。森林在其生长发育过程中可从大气中吸收大量的碳,并固定在有机体中,是陆地生态系统最大的有机碳库,可高达约76%—98%,构成大气CO2的一个重要碳汇[20]。《京都议定书》已于2005年正式生效,现阶段我国虽无温室气体减排义务,但对森林碳汇大小的估算以及对区域森林碳吸存潜力的正确评价,寻求CO2减排与增汇的对策技术同样是关系到我国政治经济国际地位和发展趋势的重要举措。大兴安岭林区是北方森林的典型分布区,亦是我国唯一的北方针叶林区,是国家重要的主体生态功能区,是松嫩平原乃至整个东北平原的重要生态屏障,大兴安岭森林生态系统固碳能力的高低,对保障松嫩平原乃至东北地区的生态安全具有不可替代的作用。本文通过实际测量数据的研究结果表明,大兴安岭林区的主要林型大多处于幼龄林和中龄林,而许多学者的相关研究表明,生长旺盛期的幼龄林和中幼龄林的固碳能力最强,成熟林的固碳量达到最大值,且新增固碳能力几乎为零[8- 9,49- 53]。据统计,该区现有各种幼龄林和中龄林的林地面积、蓄积分别占用材林的83.17%和75.13%[54],由于该区大部分森林属于中幼龄林,而且正处于旺盛的生长期,森林固碳能力最强,森林固碳潜力很大,碳汇效应很强,因此,加强该区森林生态系统的抚育管理以及森林防火与森林病虫害的防治工作,对增强碳汇功能具有重要意义。森林生物量和碳储量研究是生态系统碳循环和碳平衡研究的基础,亦是揭示森林生态功能和评估森林环境效益的重要内容[55]。本文通过实测数据计量估算了大兴安岭林区生物碳储量,可为深入研究大兴安岭林区森林固碳能力及其碳汇功能研究提供参考依据。
[1] 胡海清, 魏书精, 孙龙, 王明玉. 气候变化、火干扰与生态系统碳循环. 干旱区地理, 2013, 36(1): 57- 75.
[2] Karl T R, Nicholls N, Gregory J. The coming climate. Scientific American, 1997, 276(5): 78- 83.
[3] World Meteorological Organization. WMO Greenhouse Gas Bulletin: The State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2011. Geneva: World Meteorological Organization, 2012: 1- 4.
[4] 周健, 肖荣波, 庄长伟, 邓一荣. 城市森林碳汇及其抵消能源碳排放效果——以广州为例. 生态学报, 2013, 33(18): 5865- 5873.
[5] 张明阳, 罗为检, 刘会玉, 章春华, 岳跃民, 王克林. 基于林业清查资料的桂西北植被碳空间分布及其变化特征. 生态学报, 2013, 33(16): 5067- 5077.
[6] IPCC. Land Use, Land Use Change and Forestry. Special Report, Inter-Governmental Panel on Climate Change. Cambridge: Cambridge University Press, 2000.
[7] 方精云, 刘国华, 徐嵩龄. 我国森林植被的生物量和净生产量. 生态学报, 1996, 16(5): 497- 508.
[8] 刘国华, 傅伯杰, 方精云. 中国森林碳动态及其对全球碳平衡的贡献. 生态学报, 2000, 20(5): 733- 740.
[9] Dixon R K, Solomon A M, Brown S, Houghton R A, Trexier M C, Wisniewski J. Carbon pools and flux of global forest ecosystems. Science, 1994, 263(5144): 185- 190.
[10] 罗云建, 张小全, 王效科, 朱建华, 侯振宏, 张治军. 森林生物量的估算方法及其研究进展. 林业科学, 2009, 45(8): 129- 134.
[11] 焦燕, 胡海清. 黑龙江省森林植被碳储量及其动态变化. 应用生态学报, 2005, 16(12): 2248- 2252.
[12] 赵敏, 周广胜. 基于森林资源清查资料的生物量估算模式及其发展趋势. 应用生态学报, 2004, 15(8): 1468- 1472.
[13] Woodwell G M, Whitaker R H, Reiners W A, Likens G E, Delwiche C C, Botkin D B. The biota and the world carbon budget. Science, 1978, 199(4325): 141- 146.
[14] 王邵军, 阮宏华. 全球变化背景下森林生态系统碳循环及其管理. 南京林业大学学报: 自然科学版, 2011, 35(2): 113- 116.
[15] 毛子军. 森林生态系统碳平衡估测方法及其研究进展. 植物生态学报, 2002, 26(6): 731- 738.
[16] Malhi Y, Baldocchi D D, Jarvis P G. The carbon balance of tropical, temperate and boreal forests. Plant, Cell & Environment, 1999, 22(6): 715- 740.
[17] Kramer P J. Carbon dioxide concentration, photosynthesis, and dry matter production. BioScience, 1981, 31(1): 29- 33.
[18] 巨文珍, 农胜奇. 森林生物量研究进展. 西南林业大学学报, 2011, 32(2): 78- 83.
[19] 胡海清, 孙龙. 1980—1999年大兴安岭灌木、草本和地被物林火碳释放估算. 应用生态学报, 2007, 18(12): 2647- 2653.
[20] 王效科, 冯宗炜, 欧阳志云. 中国森林生态系统的植物碳储量和碳密度研究. 应用生态学报, 2001, 12(1): 13- 16.
[21] 胡海清, 李敖彬. 小兴安岭主要乔、灌木燃烧过程的烟气释放特征. 应用生态学报, 2008, 19(7): 1431- 1436.
[22] 葛立雯, 潘刚, 任德智, 杜玉婕, 郑祥蕾. 西藏林芝地区森林碳储量、碳密度及其分布. 应用生态学报, 2013, 24(2): 319- 325.
[23] 吴仲民, 李意德, 曾庆波, 周光益, 陈步峰, 杜志鹄, 林明献. 尖峰岭热带山地雨林C素库及皆伐影响的初步研究. 应用生态学报, 1998, 9(4): 341- 344.
[24] 胡海清, 魏书精, 魏书威, 孙龙. 气候变暖背景下火干扰对森林生态系统碳循环的影响. 灾害学, 2012, 27(4): 37- 41.
[25] 魏书精, 孙龙, 魏书威, 胡海清. 气候变化对森林灾害的影响及防控策略. 灾害学, 2013, 28(1): 36- 40.
[26] 李景文. 黑龙江森林. 哈尔滨: 东北林业大学出版社, 1993.
[27] Huxley J S. Problems of Relative Growth. New York: Dial Press, 1932: 1- 9.
[28] 魏书精. 黑龙江省森林火灾碳排放定量评价方法研究[D]. 哈尔滨: 东北林业大学, 2013.
[29] 胡海清, 魏书精, 孙龙. 1965- 2010年大兴安岭森林火灾碳排放的估算研究. 植物生态学报, 2012, 36(7): 629- 644.
[30] 胡海清, 魏书精, 孙龙. 大兴安岭2001- 2010年森林火灾碳排放的计量估算. 生态学报, 2012, 32(17): 5373- 5386.
[31] 胡海清, 魏书精, 孙龙. 大兴安岭呼中区2010年森林火灾碳排放的计量估算. 林业科学, 2012, 48(10): 109- 119.
[32] Crutzen P J, Andreae M O. Biomass burning in the tropics: impact on atmospheric chemistry and biogeochemical cycles. Science, 1990, 250(4988): 1669- 1678.
[33] Andreae M O, Merlet P. Emission of trace gases and aerosols from biomass burning. Global Biogeochemical Cycles, 2001, 15(4): 955- 966.
[34] De Groot W J, Pritchard J M, Lynham T J. Forest floor fuel consumption and carbon emissions in Canadian boreal forest fires. Canadian Journal of Forest Research, 2009, 39(2): 367- 382.
[35] Blackstone N W. Allometry and relative growth: pattern and process in evolutionary studies. Systematic Zoology, 1987, 36(1): 76- 78.
[36] 胡海清, 魏书精, 金森, 孙龙. 森林火灾碳排放计量模型研究进展. 应用生态学报, 2012, 23(5): 1423- 1434.
[37] Neary D G, Klopatek C C, DeBano L F, Ffolliott P F. Fire effects on belowground sustainability: a review and synthesis. Forest Ecology and Management, 1999, 122(1/2): 51- 71.
[38] Isaev A S, Korovin G N, Bartalev S A, Ershov D V, Janetos A, Kasischke E S, Shugart H H, French N H F, Orlick B E, Murphy T L. Using remote sensing to assess Russian forest fire carbon emissions. Climatic Change, 2002, 55(1/2): 235- 249.
[39] Dixon R K, Krankina O N. Forest fires in Russia: carbon dioxide emissions to the atmosphere. Canadian Journal of Forest Research, 1993, 23(4): 700- 705.
[40] González-Pérez J A, González-Vila F J, Almendros G, Knicker H. The effect of fire on soil organic matter-a review. Environment International, 2004, 30(6): 855- 870.
[41] Amiro B D, MacPherson J I, Desjardins R L, Chen J M, Liu J. Post-fire carbon dioxide fluxes in the western Canadian boreal forest: Evidence from towers, aircraft and remote sensing. Agricultural and Forest Meteorology, 2003, 115(1/2): 91- 107.
[42] Levine J S, Cofer W R Ⅲ, Cahoon D R Jr, Winstead E L. Biomass burning: a driver for global change. Environmental Science & Technology, 1995, 29(3): 120- 125.
[43] 徐化成. 森林生态与生态系统经营. 北京: 化学工业出版社, 2004: 26- 33.
[44] Zhou G Y, Liu S G, Li Z, Zhang D Q, Tang X L, Zhou C Y, Yan J H, Mo J M. Old-growth forests can accumulate carbon in soils. Science, 2006, 314(5804): 1417- 1417.
[45] 孙玉军, 张俊, 韩爱惠, 王雪军, 王新杰. 兴安落叶松(Larix gmelini)幼中龄林的生物量与碳汇功能. 生态学报, 2007, 27(5): 1756- 1762.
[46] Keeling C D, Chin J F S, Whorf T P. Increased activity of northern vegetation inferred from atmospheric CO2measurements. Nature, 1996, 382(6587): 146- 149.
[47] 王绍强, 周成虎, 罗承文. 中国陆地自然植被碳量空间分布特征探讨. 地理科学进展, 1999, 18(3): 238- 244.
[48] 蒋延玲, 周广胜. 兴安落叶松林碳平衡和全球变化影响研究. 应用生态学报, 2001, 12(4): 481- 484.
[49] 方精云, 陈安平. 中国森林植被碳库的动态变化及其意义. 植物学报, 2001, 43(9): 967- 973.
[50] 王效科, 冯宗炜. 中国森林生态系统中植物固定大气碳的潜力. 生态学杂志, 2000, 19(4): 72- 74.
[51] 李斌, 方晰, 项文化, 田大伦. 湖南省杉木林植被碳贮量、碳密度及碳吸存潜力. 林业科学, 2013, 49(3): 25- 32.
[52] 魏书精, 罗碧珍, 孙龙, 胡海清. 黑龙江省温带森林火灾碳排放的计量估算. 生态学报, 2014, 34(11): 3048- 3063.
[53] 胡海清, 罗碧珍, 魏书精, 孙龙, 魏书威, 文正敏. 1953—2011年小兴安岭森林火灾含碳气体排放的估算. 应用生态学报, 2013, 24(11): 3065- 3076.
[54] 郗婷婷, 李顺龙. 黑龙江省森林碳汇潜力分析. 林业经济问题, 2006, 26(6): 519- 526.
[55] 伏鸿峰, 闫伟, 陈晶晶. 内蒙古大兴安岭林区森林碳储量及其动态变化研究. 干旱区资源与环境, 2013, 27(9): 166- 170.
Estimating biological carbon storage of five typical forest types in the Daxing′anling Mountains, Heilongjiang, China
HU Haiqing1, LUO Bizhen1,WEI Shujing1,2,3, WEI Shuwei4, WEN Zhengmin2,3,SUN Long1, LUO Sisheng1, WANG Liming1, MA Hongbin1,*
1CollegeofForestry,NortheastForestryUniversity,Harbin150040,China2CollegeofCivilEngineeringandArchitecture,GuilinUniversityofTechnology,Guilin541004,China3GuangxiKeyLaboratoryofNewEnergyandBuildingEnergySaving,Guilin541004,China4CollegeofDesignArt,LanzhouUniversityofTechnology,Lanzhou730050,China
As global climate change continues to accelerate, biological carbon storage, which plays an important ecological role in forest ecosystems, have a very significant effect on carbon emissions and carbon sinks and also play an important role in carbon cycle. Forest ecosystems, as a principal component of terrestrial ecosystems, are the world′ s largest carbon (C) pool and C sink. The amount of C storage in vegetation plays an important role in global C cycle and C balance. Scientifically and effectively measuring biological C storage provides important data needed for understanding the significance of forest biomass in the C cycle as well as for understanding climate change. This study analyzed biological C storage in typical forest types in the Daxing′anling Mountains in Heilongjiang Province, China, using forest inventory data and geographic information system technology. Five typical forest types in the Daxing′anling Mountains were studied using various age groups and different forest components (trees, shrubs, herbs and litter), specificallyLarixgmelinii,Betulaplatyphylla,Pinussylvestrisvar.mongolica,Quercusmongolica, andPopulusdavidianaforests. For each forest type, tree, understory shrub, herb, and litter layers were surveyed to determine and measure biomass per unit area, C biomass, and C forest stocks. At the stand level, age groups were classified so that estimates of forest biomass and forest C stocks in the study area could be calculated. The biomasses in different age groups of the five typical forest types in the Daxing′anling Mountains including young forest, middle-aged forest, near mature forest, and mature forest were analyzed:. Biomass per unit area ofLarixgmeliniiforests for these four age groups was 31.00 t/hm2, 101.29 t/hm2, 188.46 t/hm2, and 215.23 t/hm2, respectively. Similarly, the same four age groups ofBetulaplatyphyllaforests held 33.13 t/hm2, 65.64 t/hm2, 88.67 t/hm2, and 136.38 t/hm2of biomass per unit area; the four age groups ofPinussylvestrisvar.mongolicaforests had 61.22 t/hm2, 120.30 t/hm2, 179.10 t/hm2, and 229.43 t/hm2of biomass per unit area; the four age groups ofQuercusmongolicaforests had 23.89 t/hm2, 25.00 t/hm2, 70.70 t/hm2, and 126.20 t/hm2of biomass per unit area; and, the four age groups ofPopulusdavidianaforests had 47.28 t/hm2, 61.71 t/hm2, 91.16 t/hm2, and 135.53 t/hm2of biomass per unit area, respectively. Our study determined that biological C storage of the five typical forest types in different age groups varied widely in the Daxing′anling Mountains. C storage per unit area for young forest, middle-aged forest, near mature forest, and mature forest listed in respective order, for each forest type are as follows: 15.20 t/hm2, 50.96 t/hm2, 95.80 t/hm2, and 109.33t/hm2forLarixgmeliniiforests; 15.36 t/hm2, 30.67 t/hm2, 41.62 t/hm2, and 64.35t/hm2forBetulaplatyphyllaforests; 29.89 t/hm2, 59.92 t/hm2, 90.01 t/hm2, and 117.08 t/hm2forPinussylvestrisvar.mongolicaforests; 11.17 t/hm2, 11.90 t/hm2, 34.94 t/hm2, and 59.49 t/hm2forQuercusmongolicaforests; and, 21.81 t/hm2, 28.58 t/hm2, 42.84 t/hm2, and 64.39 t/hm2forPopulusdavidianaforests. These results show that biological C stocks in the Daxing′anling Mountains play an important role in the C cycle and regional C balance. Different age groups in five typical forest types serve as forest C stocks based on forest biological age with the C stock increasing with forest growth and aging. Nevertheless, the type of forest C sink function varies in different forest types, although the same types of large differences were observed in biological C forest reserves in stands of different ages among the five forest types. Because most of the growth in the five major forest types occurs in young and middle-aged forest, forests at these ages have a great potential to provide C storage in forest vegetation. This significant C sink function is further enhanced in the Daxing′anling Mountains area with the development and restoration of areas designed to provide specific ecological services including important role as C sinks. In order to achieve sustainable development of these forest ecosystem, a defined C management strategy should be developed that includes an increasing use of these potential C sinks and simultaneously includes plans for the management of economic growth. Our findings are important for land managers and other stakeholders who need to gain correct understanding of biological effects of forest C stocks and C balance as part of regional ecological analysis. Our results also provide reference data related to the full effect of forest plantations as C sinks as it relates to future silvicultural and reforestation activities.
forest biomass; carbon storage; typical forest types; Daxing′anling Mountains; forest ecosystem management; carbon sink management measures
黑龙江省博士后基金(LBH-Z13012); 广西自然科学基金(2014GXNSFBA118108); 国家科技支撑计划项目(2011BAD37B01); 国家自然科学基金项目(51208244, 31070544); 黑龙江省科技攻关重点项目(GA09B201-06); 国家973项目(2011CB403203); 国家公益性行业科研重大专项(201404402)
2013- 12- 29;
日期:2014- 11- 03
10.5846/stxb201312293051
*通讯作者Corresponding author.E-mail: weishujing2003@163.com
胡海清, 罗碧珍, 魏书精, 魏书威, 文正敏, 孙龙, 罗斯生,王立明, 马洪斌.大兴安岭5种典型林型森林生物碳储量.生态学报,2015,35(17):5745- 5760.
Hu H Q, Luo B Z,Wei S J, Wei S W, Wen Z M,Sun L, Luo S S, Wang L M, Ma H B.Estimating biological carbon storage of five typical forest types in the Daxing′anling Mountains, Heilongjiang, China.Acta Ecologica Sinica,2015,35(17):5745- 5760.

