松嫩草地4种植物功能群土壤微生物碳源利用的差异
曲同宝, 王呈玉, 庞思娜, 张建峰
吉林农业大学, 长春 130118
松嫩草地4种植物功能群土壤微生物碳源利用的差异
曲同宝, 王呈玉, 庞思娜, 张建峰*
吉林农业大学, 长春 130118
为了探讨草地不同植物功能群土壤微生物碳源利用差异,利用Biolog-ECO微平板检测法,研究了松嫩放牧草地禾草 (Grass)、羊草(Leymuschinensis)、杂类草 (Forb) 和豆科牧草(Legume) 4种植物功能群土壤微生物碳源代谢的多样性变化特征。结果表明,在培养的240 h内,4种不同植物功能群的土壤微生物对碳源的利用程度均随着时间的延长而升高,表明微生物代谢活性随着时间而增强;不同植物功能群土壤微生物总体活性(AWCD) (P<0.001)、Shannon-Wiener指数(H)(P<0.001)、物种丰富度(R) (P= 0.005)、Pielou均匀度指数(E) (P<0.001)差异显著;其中禾草的各项指数明显高于其他3种(P<0.01),杂类草的各指标均最低。禾草、羊草对糖类、氨基酸类、羧酸类、多聚物类有较好的利用,豆科牧草除羧酸类外对其他碳源都有更好的利用,杂类草只对酚类碳源利用率最高,而对其他碳源利用率极低。总体得出4种功能群土壤微生物的碳源利用率顺序为:禾草 > 羊草 > 豆科牧草 > 杂类草。
土壤微生物; 植物功能群; 多样性; 松嫩草地; Biolog-ECO
生态系统是由地上和地下两个部分组成的一个有机整体,地上草地植被情况可以直接影响土壤微生物群落生态过程[1],植物功能群及其物种多样性的变化也往往导致土壤微生物群落多样性的变化或功能的改变。地下生态系统是土壤生物群落及其生存环境共同组成的动态平衡系统,而土壤微生物群落也能直接驱动植物群落的改变[2]。土壤微生物的分布和活动情况,不仅能反映各种环境因素对微生物的影响和作用,也可反映草地所处状况[3- 4]。找出草地生态系统中植物功能群和土壤微生物类群的协同演替规律,可为科学探索草地生态恢复途径提供理论依据。
微生物多样性在维持土壤质量、维护陆地生态系统稳定方面的重要作用日益引起人们的关注[5]。微生物代谢特征的变化受植物与土壤协同作用的影响[6],植物群落的结构和组成的变化对土壤微生物产生重大影响[7- 8],可以明显改变植物根际土壤微生物的群落结构和多样性[9]。长期协同进化导致植物可以选择那些有利于自身凋落物快速分解的分解者[10],即植物和分解者之间存在协同作用。微生物对环境的作用主要是通过群落代谢功能差异来实现的,因此微生物功能多样性信息对于明确不同环境中微生物群落的作用、深入了解生态系统内部结构和功能变化具有重要意义[11]。Biolog-ECO法常用来研究不同植物群落土壤微生物群落的功能多样性,通过微生物对31种碳底物的不同利用情况来反应微生物群落代谢功能多样性[12],近年来在国内外得到广泛应用[13- 16]。
松嫩草地是我国北方生态环境较好的重要牧区之一,是东北平原的天然生态屏障,因受到人类活动与环境变化的影响,松嫩草地生态系统出现破坏与退化趋势。松嫩草地植被类型为羊草草原,羊草(Leymuschinensis)群落占绝对优势,分布着禾草、杂类草和豆科牧草等不同植物功能群。研究表明,羊草草原土壤微生物的数量和生物量与植物种类有关[17],但植被对微生物多样性的影响机制非常复杂,需要在种群、群落和生态系统多个层面上研究土壤微生物多样性的响应与适应,目前有关松嫩草地植物功能群与土壤微生物功能多样性关系仍不清楚。
本研究以松嫩草地为研究对象,通过Biolog-ECO法研究4种不同植物功能群土壤微生物群落的主要碳源利用差异,明确土壤微生物功能多样性对环境条件的敏感程度,探讨松嫩草地生态恢复过程中植物功能群与地下土壤微生物之间的协同演替规律,以期为草地生态系统的恢复与重建提供理论依据。
1 材料与方法
1.1 研究区概况
研究地区位于吉林省长岭县境内(44°32′44″—58″ N, 123°39′52″— 40′17″ E),平均海拔130—140 m,属于温带半干旱季风气候,年均气温4—9 ℃,年降水量280—450 mm,多集中在6—9月,占全年80%以上。土壤类型为碱化与盐化草甸土。植被类型为羊草草原,羊草群落占绝对优势,其次还分布着芦苇(Phragmitesaustralis)、贝加尔针茅(Stipabaicalensis)虎尾草(Chlorisvirgata)、拂子茅(Calamagrostisepigeios)、碱茅(Puccinelliatenuiflora)、兴安胡枝子(LespedezadavuricaSchindler)、黄花草木犀(Melilotusofficinalis)、全叶马兰(Kalimerisintegrifolia)和碱蓬(Suaedaauca)等植物,形成镶嵌分布格局。
土壤理化性质见表1。pH值采用pH计(雷磁 PHS- 3C)测定;电导率采用电导率仪(雷磁 DDS- 307)测定;土壤含水量测定采用烘干法,105 ℃烘12 h后称重得到质量含水量;土壤有机碳测定采用重铬酸钾容量法(外加热法);土壤全氮测定采用凯氏定氮法(FOSS TECATOR2300全自动凯氏定氮仪)。
表1 供试土壤的理化指标
采用Ducan′s multiple range test 方法分析,同一行不同字母表示显著性差异(P<0.05,n=3)。4个植物功能群土壤理化指标均存在显著差异(P<0.05),pH值(P= 0),电导率(P= 0),含水量(P= 0.012),有机碳 (P= 0),全氮 (P= 0),C/N (P= 0)。禾草和羊草土壤样品pH值和电导率表现一致,杂类草和豆科牧草一致,前者高于后者;含水量在羊草样品较高,其他样品相同;有机碳在杂类草和豆科牧草中表现最高,羊草次之,禾草最少;全氮杂类草最高,豆科牧草较低,而禾草和羊草最少;碳氮比在豆科牧草 > 杂类草 > 羊草 > 禾草,但杂类草与豆科牧草和羊草差异不显著。禾草与羊草因具有相似植物物种组成其理化性质也相近,杂类草与豆科牧草功能群表现出较大差异。
1.2 样品采集
2011年的8月,在样地植物盖度和均匀度最高时进行植被调查和土样的采集。设定样地大小为100 m×100 m, 3个样地重复。每个样地选取禾草、羊草、杂类草和豆科牧草4个植物功能群,每个植物功能群样方大小为1 m×1 m,采用“五点混合法”取样(土钻直径2 cm,取样深度20 cm),3次重复。先剔除新鲜土样中石砾及植物残茬等杂物,然后5点混匀后(约600 g),装入封口袋中,用冰盒将样品带回实验室,过2 mm筛,置于4℃冰箱保存。
1.3 土壤微生物功能多样性测定
采用Biolog ECO微孔板培养法,测定土壤细菌群落对31种单一碳源的利用能力:称取5g土壤样品,用灭菌生理盐水按10倍稀释法制成10-4的土壤稀释液,用振荡器混匀(5 min,180 r/min)。稀释液颜色较深时,采用1500 r/min离心3 min。将土壤稀释液导入样品槽,吸取150 uL接种液,注入ECO微平板的每个微孔,确保每个微孔移入量相等。将微平板放入培养箱,在25 ℃下培养240 h,每12 h在590 nm和750 nm下biolog仪读数。
微孔板的颜色变化采用单孔颜色平均值(AWCD)来表示,小于0.06的值按零处理,计算公式为:
AWCD=∑(C590-C750)/31
式中,C590为单孔590 nm吸光度值减去对照孔吸光度值;C750为单孔750 nm吸光度值减去对照孔吸光度值。
培养180 h的数据用于计算土壤微生物群落功能多样性,计算公式如下:
(1)Shannon-Wiener指数(H)
H=-∑(Pi×lnPi)
(2)物种丰富度(R)
R=S
(3)Pielou均匀度指数(E)
EH=H/Hmax=H/lnS
式中,Pi=C590-C750/∑(C590-C750),S为ECO板中颜色变化孔的数目。
1.4 统计分析
采用SPSS 16.0 对数据进行单因子方差分析(one-way ANOVA),并用LSD法进行差异显著性检验,利用Pearson相关系数评价AWCD值、Shannon-Wiener 指数、物种丰富度、均匀度指数与土壤理化性质(pH、电导率、含水量、有机碳、全氮、碳氮比)的相关关系,应用Canoco 4.5 软件对土壤生物代谢指标和理化性质进行冗余分析(RDA),以样方-环境变量(土壤理化性质)作图。
2 结果
2.1 不同植物功能群土壤微生物的平均吸光值比较
各土壤样品的平均孔颜色变化率(AWCD)随培养时间增加而逐渐升高,土壤微生物AWCD随时间变化呈平坦的“S”型曲线(图1)。各土壤样品在0—36 h内 AWCD值为0,表明在36h内碳源基本未被利用,而在36—180 h,AWCD随着微生物生长进入指数期而急剧升高,碳源开始被大幅度利用,180—240 h 时间段内微生物生长进入稳定期,对碳源的利用趋于平缓。
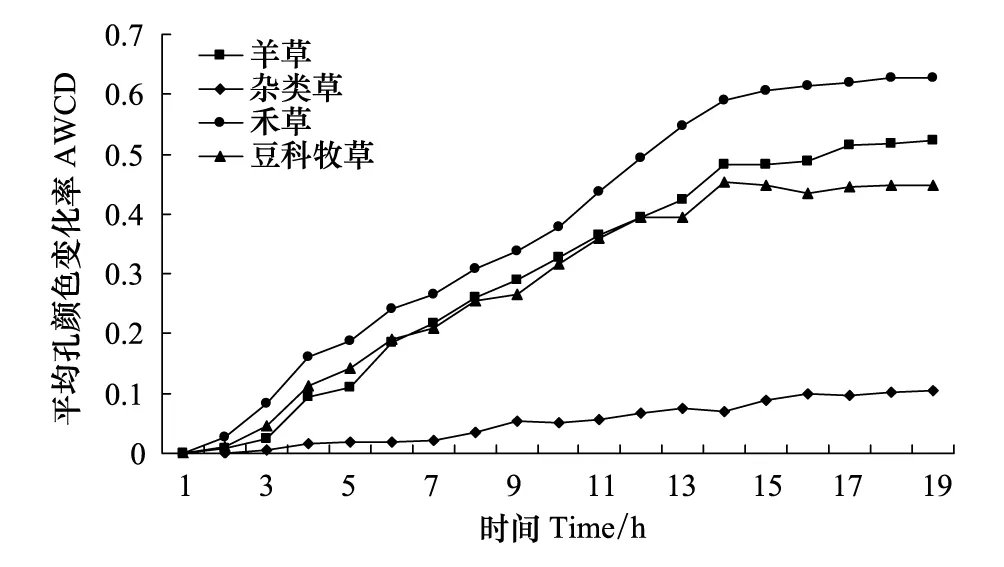
图1 土壤微生物群落单孔平均光密度变化 Fig.1 Variation in AWCD of soil bacterial community over time for different plant functinal groupsAWCD: average well color development
不同植物功能群土壤微生物的平均吸光值比较,禾草最高,其次为羊草和豆科牧草,这两种功能群土样生长曲线较为接近,只是羊草略高于豆科牧草,杂类草土壤微生物AWCD一直维持较低水平,且远低于其他3类。通过对AWCD值随时间变化曲线变化可以看出,各样品对碳源的利用程度随着时间的延长而升高,说明微生物代谢活性随着时间而增强。禾草土壤微生物代谢周期较其他样品长,利用碳源类型也较丰富。杂类草土壤微生物种类和代谢活性最低。
2.2 不同植物功能群土壤微生物碳源利用多样性指数分析
植物功能群土壤微生物碳源利用多样性指数结果表明(图2),禾草微生物总体活性(AWCD)(P<0.001)、Shannon-Wiener指数(P<0.001)、物种丰富度(P= 0.005)、Pielou均匀度指数(P<0.001)明显高于其他3种,而杂类草的各指标均最低。
相关分析结果表明(表2):AWCD、Shannon-Wiener指数、物种丰富度、均匀度指数与土壤有机碳和全氮均呈显著相关,AWCD、物种丰富度与电导率呈显著相关,说明对微生物碳源利用有重要影响,而土壤水分含量、pH和C/N与多样性指数之间均无显著相关关系。
2.3 不同植物功能群土壤微生物对碳源的利用情况比较
图3所示Biolog-ECO微平板的31种碳源利用情况,依次为糖类、氨基酸类、羧酸类、多聚物类、酚类和胺类。
不同植物功能群土壤对6类碳源的利用程度不同,禾草、羊草和豆科牧草土样能对其中5类进行很好利用,而杂类草土样只能很好利用1种碳源,对其他碳源利用率均最低。羊草土壤微生物对胺类利用率最高,豆科牧草仅次之。禾草和羊草土壤样品对多聚物的利用率高于其他碳源,豆科牧草对羧酸类利用率最低,而杂类草只对酚类利用率最高。

表2 土壤理化指标与AWCD,多样性指数之间相关系数

图3 土壤微生物对不同碳源利用Fig.3 AWCD change with different carbon sources
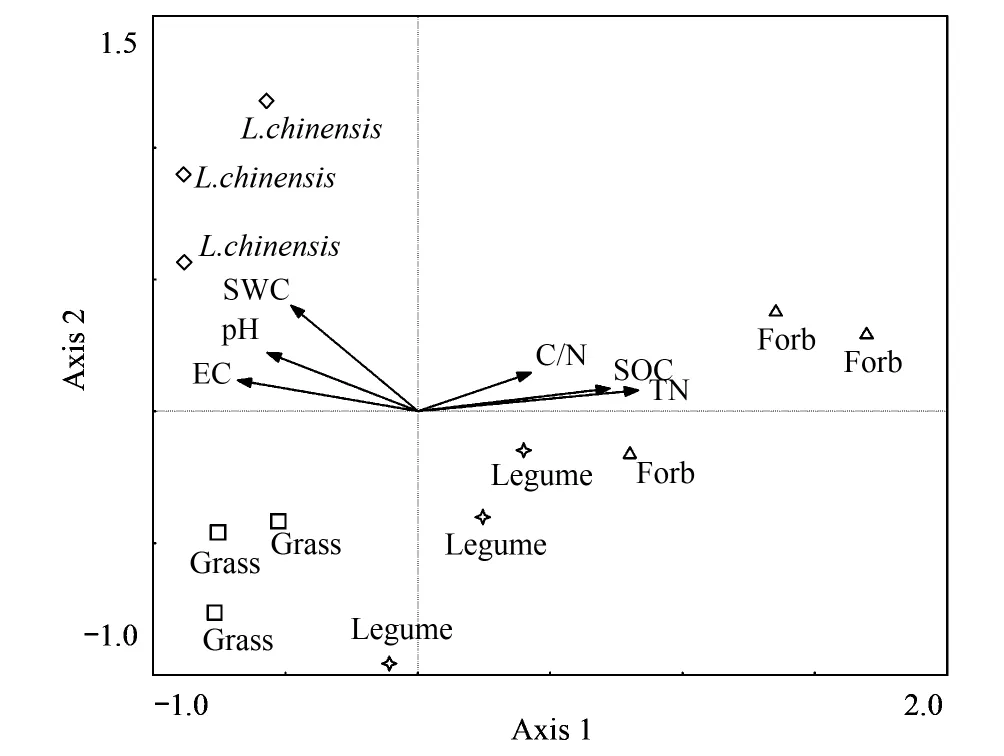
图4 土壤微生物功能多样性RDA分析 Fig.4 Bioplots diagram of the redundancy analysis (RDA) on soil microbial community constrained by soil data
2.4 不同植物功能群土壤微生物功能多样性冗余分析
对土壤功能群多样性数据首先进行DCA分析,确定排序方式为线性模型RDA。不同样方分布与土壤各理化指标关系如图4所示,样方垂直投影在射线(延长线)上,沿着变量箭头方向环境变量值逐渐增大。把复杂的数据通过二维图标表现出来,相似的样品分布位置相近,可以直观感受到群落差异。图中第1,2,3和4轴对响应变量的解释比例分别为55.0%,16.2%,9.8%和0.8%,其中第1轴解释了土壤微生物功能群的大部分变量(图4)。第1轴解释的环境变量对应为:TN (r=0.52,P<0.001),SOC (r=0.42,P<0.001),EC (r=0.38,P<0.001),pH (r=0.29,P<0.001),SWC (r=0.24,P<0.001),C/N (r=0.21,P<0.001)。所有土壤变量可以解释土壤微生物功能群变化总变量的82.9%(蒙特卡罗置换检验999,P=0.001)。从图上可以看出,除杂类草和豆科牧草各有一个点离散较大外,其余各点都按植物功能群不同而有规律分布,说明对底物碳源的代谢功能产生的差异主要由植物功能群决定,而按照RDA第一主成分TN分析能解释变量的55%,发现样方按照TN值大小排序为:禾草、羊草、豆科牧草及杂类草,而禾草与羊草值极为相似。
3 讨论
贾夏等[18]认为采用Biolog Eco微平板分析环境微生物群落特征时,建议微平板选择240 h培养并连续读数,再根据AWCD曲线“拐点”进行数据合理地选取和分析,得出的结论相对可能会与实际环境情况更为接近。本实验AWCD曲线研究结果符合这一规律, 4种植物功能群土壤微生物群落在培养36—180 h 时间内呈指数级增长,与王光华等[19]研究结果相同,与其他学者[20- 25]研究结果略有不同,可能与研究地点及土壤利用方式不同有关,松嫩草原是从东部森林与西部内蒙古典型草原之间的过渡类型,属低湿草甸草原。
羊草功能群是松嫩草甸草原的主要优势群落,其次是由羊草和芦苇组成禾草功能群,杂类草和豆科牧草功能群生长在土壤肥沃的草甸土上,但这 2 类群落在松嫩草甸草原上分布的面积很小。从不同植物功能群土壤微生物群落碳源利用模式及碳源利用多样性指数分析来看,禾草功能群土壤微生物群落对研究中多种单一碳源利用能力较强,其次为羊草和豆科牧草,杂类草利用能力最差。土壤微生物多样性变化特征与植被类型有直接联系,植物生长过程中会向根部土壤释放大量糖类、氨基酸等有机物,土壤微生物依靠其作为碳源生存繁殖[22],这些有机物质不仅提供了丰富的碳源,并且极大地改变了根际物理和化学环境,从而对根际微生物的种类和数量产生显著影响[9]。waid等[26]认为植物与土壤微生物之间通过植物的凋落物和根系分泌物建立起密切的联系,导致植物和微生物之间的协同进化,促进土壤微生物的多样性[27]。不同植物功能群特性能够影响植物的光合作用和呼吸作用,使根系分泌物的物理化学性质不同,在分解过程中释放物质有很大的差异,通过对土壤微生物的生长选择性刺激作用来影响其群落功能多样性[28],Grayston等[29]认为不同植被下土壤微生物群落对各碳源具有不同的利用能力,是因为这些碳源在不同根系土壤中的有效性不一样,后者能影响微生物群落中利用此类碳源的微生物的生长。
地上植物多样性可以引起作为地下生物资源的凋落物质量和类型的多样性,而资源的异质性则可以引起分解者 (土壤微生物) 的多样性[23]。土壤微生物的多样性和变异性也可以反映它们对环境因子的适应性[30]。4种功能群土壤微生物的AWCD、Shannon-Wiener指数、物种丰富度、均匀度指数与土壤有机碳和全氮均呈显著相关。从多样性指数结果推测,禾草土壤中上述碳源的含量应较为丰富,能促使对这些碳源有较强周转能力的微生物群落生长,其次为羊草,杂类草为最低。但是,从土壤有机碳和全氮的变化规律来看,杂类草 > 豆科牧草 > 羊草 > 禾草。通常认为,有机质含量低的土壤存活下来的微生物种类可能很少,而本研究中正好相反。究其原因,可能由于有机质的缺乏使微生物的生长和繁殖会受到一定的影响,但仍有很多能适应贫瘠环境条件的种类存活,微生物多样性维持较高水平,该适应于贫瘠条件的优势种类多数可能是r-对策种[31]。从6类碳源利用情况分析,禾草、羊草和豆科牧草土样能对其中5类进行很好利用,禾草微生物群落的利用情况好于其他3种,而杂类草土样只能很好利用1种碳源,对其他碳源利用率均最低。禾草和羊草土壤样品对多聚物的利用率高于其他碳源,说明样地中利用多聚物的微生物的代谢活动和数量高于其他微生物。在松嫩草地存在有限资源的竞争,一些土壤微生物成为优势种,而另一些种类随着条件恶化而消失,土壤微生物通过营养元素的周转调节养分的供应来影响植物营养的吸收,植物根际土壤微生物功能的差异性将影响到植物所需营养物质的提供,这些物质的供给又将影响到植物之间的竞争,从而影响植物的多样性[32]。Liu等[33]认为虽然土壤微生物类群与植物功能群之间有显著相互作用,但是植物多样性不能很好预测土壤微生物多样性。
4 结论
(1)松嫩草地4种植物功能群土壤微生物碳源利用的差异较大,对相同碳源的利用、对碳源消耗量及速率上存在差异,也说明4种植物功能群根际土壤微生物代谢强度不同。禾草功能群土壤微生物碳源利用最好,其次为羊草和豆科牧草,而杂类草土壤微生物对碳源利用最低。
(2)4种植物功能群根际土壤微生物主要碳源利用类型中,禾草、羊草对糖类、氨基酸类、羧酸类、多聚物类有较好的利用,豆科牧草除羧酸类外对其他碳源都有更好的利用,杂类草只对酚类碳源利用率最高,而对其他碳源利用率极低。
(3)4种功能群土壤微生物的AWCD、Shannon-Wiener指数、物种丰富度、均匀度指数与土壤有机碳和全氮均呈显著相关,AWCD、物种丰富度与电导率呈显著相关。
[1] Viketoft M, Bengtsson J, Sohlenius B, Berg M P, Petchey O, Palmborg C, Huss-Danell K. Long-term effects of plant diversity and composition on soil nematode communities in model grasslands. Ecology, 2009, 90(1): 90- 99.
[2] Birkhofer K, Wise D H, Scheu S. Subsidy from the detrital food web, but not microhabitat complexity, affects the role of generalist predators in an aboveground herbivore food web. Oikos, 2008, 117(4): 494- 500.
[3] 贺纪正, 葛源. 土壤微生物生物地理学研究进展. 生态学报, 2008, 28(11): 5571- 5582.
[4] 孔维栋, 朱永官, 傅伯杰, 陈保冬, 童依平. 农业土壤微生物基因与群落多样性研究进展. 生态学报, 2004, 24(12): 2894- 2900.
[5] Nannipieri P, Ascher J, Ceccherini M T, Landi L, Pietramellara G, Renella G. Microbial diversity and soil functions. European Journal of Soil Science, 2003, 54(4): 655- 670.
[6] Papatheodorou E M, Efthimiadou E, Stamou G P. Functional diversity of soil bacteria as affected by management practices and phenological stage of Phaseolus vulgaris. European Journal of Soil Biology, 2008, 44(4): 429- 436.
[7] Groffman P M, Eagan P, Sullivan W M, Lemunyon J L. Grass species and soil type effects on microbial biomass and activity. Plant and Soil, 1996, 183(1): 61- 67.
[8] Tilman D, Wedin D, Knops J. Productivity and sustainability influenced by biodiversity in grassland ecosystems. Nature, 1996, 379(6567): 718- 720.
[9] Kowalchuk G A, Buma D S, de Boer W, Klinkhamer P G L, van Veen J A. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. Antonie van Leeuwenhoek, 2002, 81(1/4): 509- 520.
[10] Hansen R A. Red oak litter promotes a microarthropod functional group that accelerates its decomposition. Plant and Soil, 1999, 209(1): 37- 45.
[11] 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用. 环境科学与技术, 2011, 34(3): 50- 57.
[12] Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 1991, 57(8): 2351- 2359.
[13] Wang Q, Dai J L, Wu D Q, Yu Y, Shen T L, Wang R Q. Statistical analysis of data from BIOLOG method in the study of microbial ecology. Acta Ecologica Sinica, 2010, 30(3): 817- 823.
[14] Li S H, Liu K X, Liao Z W. Method for simplification of characteristic carbon sources for Biolog analysis of soil microbial community and its application. Scientia Agricultura Sinica, 2010, 43(3): 523- 528.
[15] 黄元元, 曲来叶, 曲秀春, 杜淑芹. 镜泊湖岩溶台地不同植被类型土壤微生物群落特征. 生态学报, 2012, 32(9): 2827- 2836.
[16] Bradley R L, Shipley B, Beaulieu C. Refining numerical approaches for analyzing soil microbial community catabolic profiles based on carbon source utilization patterns. Soil Biology and Biochemistry, 2006, 38(3): 629- 632.
[17] 郭继勋, 祝廷成. 羊草草原土壤微生物的数量和生物量. 生态学报, 1997, 17(1): 78- 82.
[18] 贾夏, 董岁明, 周春娟.微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响. 应用基础与工程科学学报, 2013, 21(1): 10- 19.
[19] 王光华, 刘俊杰, 齐晓宁, 金剑, 王洋, 刘晓冰. Biolog和PCR-DGGE技术解析施肥对德惠黑土细菌群落结构和功能的影响. 生态学报, 2008, 28(1): 220- 226.
[20] 董立国, 袁汉民, 李生宝, 袁海燕, 潘占兵. 玉米免耕秸秆覆盖对土壤微生物群落功能多样性的影响. 生态环境学报, 2010, 19(2): 444- 446.
[21] 曹成有, 姚金冬, 韩晓姝, 张颖. 科尔沁沙地小叶锦鸡儿固沙群落土壤微生物功能多样性. 应用生态学报, 2011, 22(9): 2309- 2315.
[22] 李骁, 王迎春. 土壤微生物多样性与植物多样性. 内蒙古大学学报: 自然科学版, 2006, 37(6): 708- 713.
[23] Sulkava P, Huhta V. Habitat patchiness affects decomposition and faunal diversity: a microcosm experiment on forest floor. Oecologia, 1998, 116(3): 390- 396.
[24] 张海芳, 李刚, 宋晓龙, 刘红梅, 张静妮, 杨殿林, 赵树兰, 多立安. 内蒙古贝加尔针茅草原不同利用方式土壤微生物功能多样性. 生态学杂志, 2012, 31(5): 1143- 1149.
[25] Zhang Q C, Shamsi I H, Xu D T, Wang G H, Lin X Y, Jilani G, Hussain N, Chaudhry A N. Chemical fertilizer and organic manure inputs in soil exhibit a vice versa pattern of microbial community structure. Applied Soil Ecology, 2012, 57: 1- 8.
[26] Waid J S. Does soil biodiversity depend upon metabolic activity and influences? Applied Soil Ecology, 1999, 13: 151- 158.
[27] Jones D L, Nguyen C, Finlay R D. Carbon flow in the rhizosphere: carbon trading at the soil-root interface. Plant and Soil, 2009, 321(1/2): 5- 33.
[28] 毕江涛, 贺达汉. 植物对土壤微生物多样性的影响研究进展. 中国农学通报, 2009, 25(9): 244- 250.
[29] Grayston S J, Wang S Q, Campbell C D, Edwards A C. Selective influence of plant species on microbial diversity in the rhizosphere. Soil Biology Biochemistry, 1998, 30(3): 369- 378.
[30] Zak D R, Holmes W E, White D C, Peacock A D, Tilman D. Plant diversity, soil microbial communities, and ecosystem function: are there any links? Ecology, 2003, 84(8): 2042- 2050.
[31] Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria. Ecology, 2007, 88(6): 1354- 1364.
[32] Read D J, Perez-Moreno J. Mycorrhizas and nutrient cycling in ecosystems-a journey towards relevance? New Phytologist, 2003, 157(3): 475- 492.
[33] Liu Z F, Fu B J, Zheng X X, Liu G H. Plant biomass, soil water content and soil N: P ratio regulating soil microbial functional diversity in a temperate steppe: A regional scale study. Soil Biology & Biochemistry, 2010, 42(3): 445- 450.
Utilization of carbon sources by soil microbial communities of four plant functional groups in Songnen Steppe
QU Tongbao, WANG Chengyu, PANG Sina, ZHANG Jianfeng*
JilinAgriculturalUniversity,Changchun130118,China
The soil physical-chemical properties and the soil microbial functional diversity for carbon source utilization may vary depending on plant functional groups and be susceptible to soil surface disturbance. The objective of this study was to assess the effect of plant functional groups on the potential activities of soil microbial communities and to evaluate the association with soil properties under different plant functional groups (grass,Leymuschinensis, forb, and legume) in Songnen steppe. Soil samples were collected in August 2011. Physiological profiles (CLPP) (Biolog EcoplatesTM) at community levels were measured for each plot to determine the capability of soil microorganisms in utilizing 31 types of carbon source. Furthermore, soil physiochemical properties (pH, electrical conductivity [EC], soil water [SW], soil organic carbon [SOC], total nitrogen [TN], and C∶N ratio [C/N]) were determined in rhizosphere soil under different plant functional groups.The results showed that carbon source utilization and microbial metabolic activity increased with time from 36 to 180 hours. There was a significant difference in the soil microbial community structure among plant functional groups. Significant difference was observed in AWCD (the average well color development) (P<0.001), Shannon-Wiener index (P<0.001), richness (P= 0.005) and Pielou evenness index (P<0.001), and they were significantly higher for grass than other functional groups at the latest stage of incubation (P<0.01). Carbon source utilization was highest for microbial community under grasses, and it was lowest under forbs. The difference in microbial community structure may result in the difference in utilization of the six types of carbon sources. Grasses andLeymuschinensishad higher utilization ability for sugar, amino acids, carboxylic acids, and polymers, and legumes had higher utilization ability for carbon sources except for carboxylic acids. Forbs had highest utilization ability for phenolic compounds but had lower utilization ability for other carbon sources. SOC and TN of the soil were closely associated with the value of AWCD, Shannon-Wiener index, Richness and Pielou evenness index, and EC of the soil was associated with AWCD and richness, while the effect of SW, pH, and C/N were not significant. For further determination of microbial communities under different plant functional groups, Biolog data after 180 h were subjected to redundancy analysis (RDA), and the results showed that TN, SOC, and EC were the most important indices to represent soil quality under the four plants functional groups in this steppe. Carbon source utilization of soil microbial function changed among the four plant functional groups as follows: grass >Leymuschinensis> legume > forb. This result will improve the understanding of the underground carbon cycle and will benefit the grassland management in Songnen steppe by providing a scientific guide for preservation and improvement of soil quality, soil fertility, and nutrient use efficiency, and for enhancing protection of the ecological environment.
soil microbial; plant functional groups; diversity; Songnen steppe; Biolog-Eco
国家自然科学基金重点项目(31230012); 中国博士后科学基金项目(20110491286)
2013- 11- 12;
日期:2014- 11- 03
10.5846/stxb201311132727
*通讯作者Corresponding author.E-mail: 419730800@qq.com
曲同宝, 王呈玉, 庞思娜, 张建峰.松嫩草地4种植物功能群土壤微生物碳源利用的差异.生态学报,2015,35(17):5695- 5702.
Qu T B, Wang C Y, Pang S N, Zhang J F.Utilization of carbon sources by soil microbial communities of four plant functional groups in Songnen Steppe.Acta Ecologica Sinica,2015,35(17):5695- 5702.

