东北次生杨桦林土壤碳氮动态特征
汲常萍, 王文杰,*, 韩士杰, 祖元刚
1 东北林业大学森林植物生态学教育部重点实验室, 哈尔滨 150040 2 中国科学院沈阳应用生态研究所, 沈阳 110016
东北次生杨桦林土壤碳氮动态特征
汲常萍1, 王文杰1,*, 韩士杰2, 祖元刚1
1 东北林业大学森林植物生态学教育部重点实验室, 哈尔滨 150040 2 中国科学院沈阳应用生态研究所, 沈阳 110016
土壤分级组分是研究其碳氮动态的基础,次生杨桦林作为东北地区主要的天然林类型,目前相关数据的欠缺状态要求对此进行深入研究。为此,采集 0—10 cm、10—20 cm、20—30 cm长白山次生杨桦林土壤,通过土壤颗粒组分物理化学分级方法,将土壤分成5种组分:沙和稳定团聚体土壤组分(SA)、酸不溶土壤组分(AI)、易氧化土壤组分(EO)、颗粒态土壤组分(P)和可溶性土壤组分(S),进而分析了不同组分的质量分数、碳氮含量、碳氮分配比例及红外光谱5类官能团相对含量,旨在探讨次生杨桦林土壤固碳、氮供应机制。结果显示,接近90%的土壤质量集中在稳定组分AI(66.21%)和SA(22.11%)上,导致稳定组分中碳截获量最大(占土壤总碳量的2/3),而且其C/N比活跃组分(P和EO)大2—9倍;与碳不同,由于活跃组分中N含量比稳定组分大4—80倍,致使活跃组分P和EO氮的分配比例最大,分别占土壤总氮的33.1%和26.0%;除了占土壤质量很少的P和S外,组分间以及组分内的碳氮间多具有显著相关关系。这种土壤碳、氮在不同组分间贮存方式的差异使得土壤碳储存稳定性更高、而N肥力供应更快速。伴随不同组分碳氮储存的变化,不同组分间红外官能团存在显著差异,AI组分中绝大多数官能团相对含量均最低,而P和S组分中绝大多数官能团相对含量均较高,绝大多数官能团相对含量与碳含量、氮含量呈现显著的正相关关系,反映了官能团具有维持土壤碳氮的功能。同时,官能团与土壤C/N具有显著相关关系,反映出组分官能团相对含量的高低具有指示组分化学活性高低的作用。研究发现对于林分土壤的碳截获与氮供应的机制阐明具有重要的科学意义,这为深入了解东北次生杨桦林碳氮动态及对未来气候的响应提供基础数据。
碳截获; 土壤氮; 土壤组分区分; 碳氮比; 红外线光谱官能团组成
东北林区面积占全国面积的31.4%,是中国的主要林区之一[1],而作为主要林型之一的杨桦林,在本区分布了全国总面积70%左右[2],鉴于森林土壤碳、氮循环研究已经成为持续热点,对杨桦林土壤碳氮动态进行系统研究,对评估东北森林生态系统碳汇潜力和土壤养分供应特点具有重要意义。
在有机碳周转和营养元素循环中,不同粒级和密度组分中土壤有机碳具有不同的特征[3],而据此区分的土壤颗粒组分成为国内外研究者建立了机理模型的基础,也是阐明土壤碳氮周转机理的关键。例如Zimmerman等[4]证明了利用物理化学方法分离出的5种土壤颗粒组分与土壤碳周转机理模型(RothC模型)组分具有紧密相关性:模型中有机碳两个活跃组分与颗粒态有机质和溶解性有机质匹配,两种慢性组分与颗粒分级中的团聚体组分和与粉砂粘土有关的有机质紧密相关,而惰性有机质与模型中的难分解组分一致。国内外学者经过大量研究证明RothC模型可以很好的模拟耕层土壤有机碳的动态,目前已经拓展到森林、草地等多个生态系统,但是针对东北地区典型林分——次生杨桦林这方面的研究显有报道,急需深化研究其土壤不同物理化学组分差异及其碳氮相关特征差异。选择适宜的物理化学方法[4],对土壤进行分级,成为杨桦林土壤碳氮循环研究的重要内容。
此外,对土壤不同物理化学组分区分并对其化学性质,如碳、氮含量、官能团组成特征等研究,有利于从机理上揭示土壤碳氮循环与贮存的机制[5]。红外光谱技术的发展使得对土壤有机质官能团特征研究成为可能,不同耕作措施及植被恢复年限对土壤水溶性有机质组分、腐殖酸的官能团组成影响明显,而且红外线光谱法官能团特征可揭示土壤的肥力状况[6-7]。在测定不同土壤组分碳氮含量的基础上,使用红外光谱法测定土壤有机物组分组成变化,对其不同官能团组成差异进行分析,有助于从官能团组成角度揭示其碳截获、肥力周转动态发生过程。
本文的科研假设:土壤组分分级特征对于揭示土壤碳截获、氮养分供应的机制具有科学意义。基于此,本文选取东北地区典型次生杨桦林为研究对象,运用物理化学分级方法区分不同功能组分分级的基础上,对其组分C、N、红外线官能团组成进行分析,对RothC模型参数化的基础上,探讨长白山次生杨桦林土壤碳截获与肥力(氮)供应的机制差异。
1 研究区概况及研究方法
1.1 研究区概况
研究地点位于我国吉林省东南部中国科学院长白山森林生态系统定位站(地理坐标为42°21′—42°24′ N,127°59′—128°05′ E),该地区属于温带大陆性季风气候,冬季漫长而寒冷,夏季短暂而温暖,年平均气温3.6 ℃,最冷月为1月,平均气温为-15.6 ℃,最热月为7月,平均气温为19.7 ℃,降水较丰富,多集中在植物生长期,年平均降水量600—900 mm,土壤为山地暗棕色森林土[8]。
根据地势和环境特征相近原则,在相同坡向、坡位的立地条件下,选取5个典型次生杨桦林林分,林分主林层山杨、白桦平均年龄40a,胸高直径30 cm、树高20 m。坐标为42°12′21.3″—42°24′3.1″ N,127°5′54.1″—127°59′0.7″ E,平均海拔为891.8 m,最高海拔为1008 m,最低海拔为763.8 m,地势较为平缓。主要乔木树种为山杨(Populusdavidiana)、白桦(Betulaplatyphylla) 等,林下灌木有东北山梅花(Philadelphusschrenkii)、绢毛绣线菊(Spireasericea)、黄花忍冬(Lonicerachrysantha)等,草本植物常见的有山茄子(Brachybotrysparidiformis)、小叶樟(Deyeuxiaagustifolia) 等。
1.2 土壤样品采集
2011年10月下旬进行土样采集,在上述每个林分内设置样地1块,大小20 m×20 m,随机开挖3个土壤剖面,在去除可分辨的枯枝落叶层后,每个剖面分层0—10 cm、10—20 cm和20—30 cm 采集土样,装布质土壤袋400 cm3左右,带回室内自然风干后,将同一样地同一深度的3个土样混匀,去除根系、可见植物残体和石块等,部分土壤木棍碾碎并过2 mm筛,装瓶备用于土壤颗粒组分分级。剩余部分土壤粉碎机粉碎,过0.25 mm筛,得到原始土样,备用于土壤碳氮含量测定分析。
1.3 土壤颗粒组分物理化学分级方法[4]
本研究方法是将Zimmerman等分离土壤组分的方法略加改进而来,通过土壤颗粒组分物理化学分级方法,可以得到5种具有不同物理化学性质的组分,即沙和团聚体土壤组分(SA)、酸不溶土壤组分(AI)、易氧化土壤组分(EO)、颗粒态土壤组分(P)和水溶性土壤组分(S)。具体方法如下,(1)30 g风干土样(<2 mm),置于烧杯,加入150 mL蒸馏水,使用超声波破碎仪(Scientz—ⅡD,中国)破碎,超声时间1 min,频率6次/min,确保输出能量约为22 J/mL。(2)过筛分离:(1)中土壤浑浊液,湿筛(63 μm),直至筛出水清澈为止;筛内为>63 μm土壤,筛下为<63 μm土壤。(3)NaI密度分级:将100 mL NaI加入到>63 μm的土壤中,缓慢摇匀[9],静置2 h,离心(3500 r/min,15 min),抽吸收回上清液。重复提取,两次抽回液体混合抽滤(0.45 μm滤膜),先后分别用0.01 mol/L CaCl2溶液和蒸馏水离心洗涤数次,烘干称重,此为P组分。(4)将上述第一次离心沉淀物加入蒸馏水,先震荡10 min,再离心洗涤至少3次,烘干称重,该组分为SA组分。(5)0.45 μm抽滤:上述<63 μm土壤浑浊液,离心(3500 r/min,15 min),上清液在0.45 μm滤膜下抽滤,滤液为S组分,部分冻干称重获得S组分质量,部分低温储存用于multi N/C3100碳氮分析仪(耶拿,德国)法测定碳氮含量。(6)将(5)中>0.45 μm的组分,在60 ℃下烘干称重,得到粉砂粘土。(7)次氯酸钠氧化:从粉砂粘土中取出7 g,按照每g土壤加入50 mL 6% pH =8 NaClO溶液氧化(18 h),离心(3500 r/min,15 min),倾倒上清液,水洗3次,烘干称重,此为AI组分。EO组分不能直接得到,其质量为粉砂粘土减去AI组分的质量。
1.4 土壤碳氮指标测定
土壤碳测定:S土壤组分,在溶液状态下使用multi N/C3100碳氮分析仪测定有机碳含量(耶拿,德国)[10]。其它4个组分(粉砂粘土、SA、AI、P组分)和混合土样(<0.25 mm)采用重络酸钾-外加热法[11]测定碳含量。
土壤氮测定:可溶性土壤组分中氮含量通过测定溶液中氮含量来实现,所用仪器是multi N/C3100碳氮分析仪(耶拿,德国),其它3个组分(粉砂粘土、SA、AI组分)和原始土样(<0.25 mm)采用凯氏定氮法测定氮含量。
易氧化土壤组分(EO)不能直接得到,其碳氮含量通过计算得到,为粉砂粘土土壤组分中碳氮含量与AI土壤组分碳氮含量之差。P土壤组分质量过低,凯氏定氮法不易测得,其氮含量为原始土样氮含量与其它组分氮含量之差。
上述土壤原样和每一个组分样品中C、N含量测定3个重复。
1.5 红外光谱官能团组成测定
将溴化钾置于烘箱中,120 ℃烘干(约4 h),将充分烘干的土壤组分和溴化钾置于真空干燥器中干燥48 h左右,待完全干燥后,取1.6 mg 干燥的土壤各组分与200 mg 溴化钾混合研磨,压片,然后进行红外光谱观察。红外光谱仪型号为IRAffinity-1(SHIMADZU, Japan),波谱范围4000—500 cm-1。

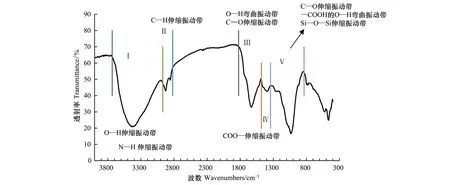
图1 土壤组分红外光谱吸收峰位置Fig.1 IR absorption peak position of soil components
1.6 数据分析
每个土壤组分的质量占原始土样的百分比称为该组分的质量分数。各组分中C的含量占原土样C的含量定义为该组分中C的分配比例,各组分N的分配比例与C的定义类似。数据整理与计算在Excel 2007中进行。
利用Spss17.0软件进行方差分析与Duncan多重比较统计,分析同一土层不同土壤组分间的质量分数、C/N、碳氮含量的差异及显著性水平检验,此方法也同样用于对于同一组分不同土层间的各项指标差异水平检验以及同一官能团不同土层和不同组分间的差异水平检验。
对于各组分C、N之间以及原土样C、N与各组分C、N之间使用Pearson相关分析的方法表示;各组分C、N、C/N与各官能团之间的关系使用线性回归分析的方法表示。
2 结果与分析
2.1 不同组分所占质量分数(占总土壤的百分比)比较
不同组分的质量分数存在明显的差异(表1)。主要表现在:AI组分的质量分数最大,在53%—75%之间,平均为66.21%;S组分质量分数最小,多在0.1%—0.4%之间,平均为0.23%;第二大组分为SA,平均达到22%,其次为EO和P,平均占8.25%和3.20%。不同层AI均与其它组分存在显著差异,P和S在深层(>10 cm)表现为差异不显著。
各组分的质量分数的垂直剖面分布有差异(表1)。主要表现在:AI和EO的质量分数随土壤深度增加显著增加,而SA、P则出现显著下降趋势,这种显著变化多发生在0—10 cm 和更深层次上(P<0.05)。S随深度有下降趋势,但是未达到显著水平。
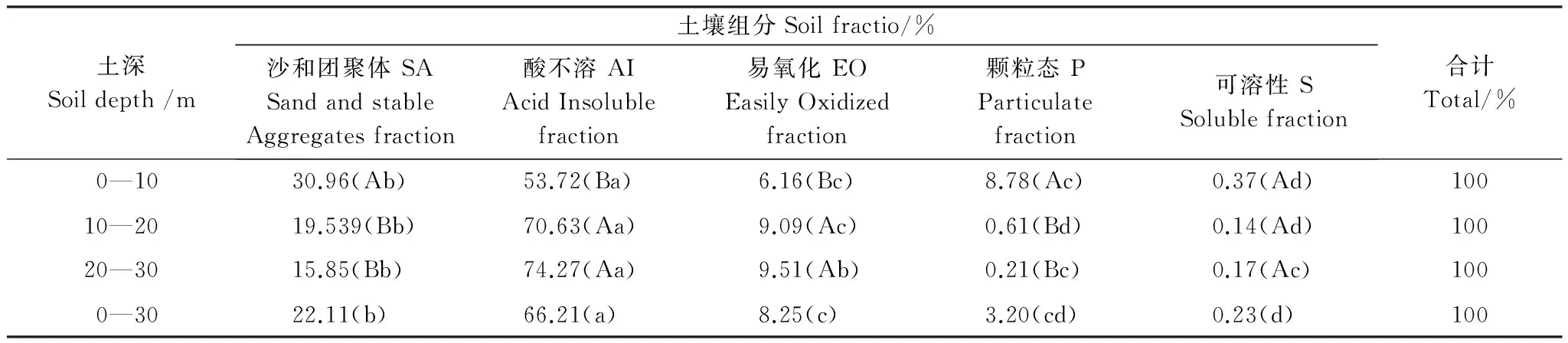
表1 不同土层各组分质量分数差异
2.2 不同组分碳含量比较
原土样及其各组分中碳含量的垂直变化规律(表2)表现为:随着土壤深度的增加,SA、AI、EO组分含量和原土样碳含量均显著降低,表层0—10 cm与深层20—30 cm相比,四者分别下降了83.8%、77.8%、71.9%和83.4%,差异多达到显著水平。P和S组分中碳含量较高,但是不同层之间的差异未达到显著水平。
不同组分间的碳含量有差异,但是不同层多表现出类似的规律各土层多表现为P和S>EO≈SA >AI,其中比原土样碳含量低的只有AI。对于0—10 cm土层,P和S碳含量显著高于原土样和其它组分含量,与原土样相比,P、S、EO和SA碳含量分别高出3.3倍、2.3倍、21%和19%,而AI碳含量约为原土样的1/2。在10—20 cm土层,S、P、SA和EO碳含量分别为原土样的21.4倍、8.0倍、2.4倍和1.9倍,AI碳含量接近原土样的1/2。在20—30 cm土层,原土样及其组分碳含量大小顺序与0—10 cm相同,即S>P>EO>SA>原土样>AI,其中S、P、EO和SA碳含量分别是原土样的20.8倍、15.6倍、2.0倍和1.1倍,AI碳含量比原土样低约1/3。
综合0—30 cm平均来看,S、P、EO和SA碳含量是原土样的6.2、1.8、1.3和1.4倍,AI碳含量为原土样的2/3。
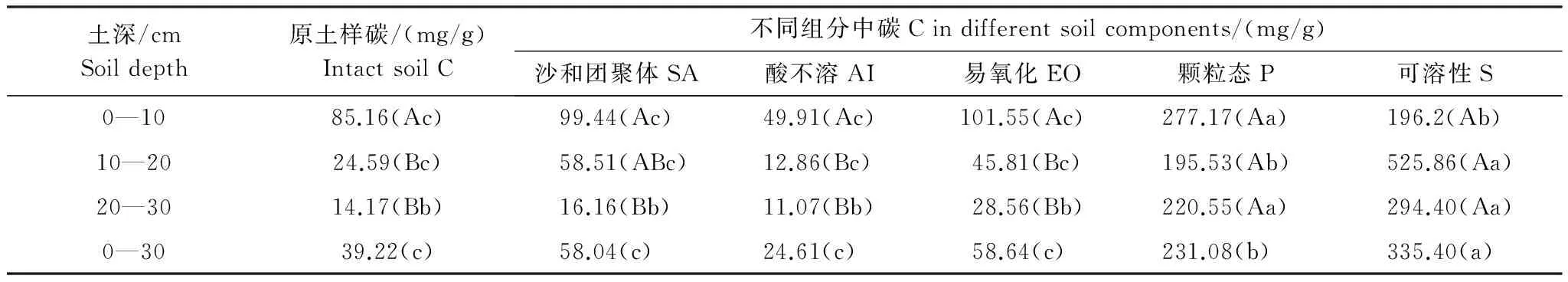
表2 不同土层各组分碳含量差异
2.3 不同组分氮含量比较
原土样及其组分氮含量在土壤剖面上有差异表现为(表3):随土层深度的加深,SA、EO、AI和原土样氮含量均显著降低。P和S氮含量较高,但是不同土层间差异不显著。
与不同组分中碳含量的差异相似,不同组分氮含量差异明显,且不同层表现类似规律,即P>S>EO>SA,而AI最低(表3)。在表层0—10 cm,与原土样氮含量相比,S、P和EO含量较高,SA相差不大,而AI含量则降低明显。10—20 cm土层与0—10 cm结果类似,P> S >EO>SA >原土样>AI,高出者分别为原土样氮含量的54.7倍、13.7倍、5.6倍和1.3倍。在20—30 cm土层,P氮含量显著高于其它,是原土样的91.2倍, S、EO和SA氮含量分别为原土样氮的9.8—1.2倍,AI氮含量为原土样的17.7%。
从整个剖面0—30 cm均值来看,原土样及其组分氮含量大小次序为P>S>EO>SA>原土样>AI,仅P氮含量显著高于其它,而SA、AI、EO、原土样、S中氮含量变化在0.9—17 mg/g,但差异不显著(表3)。
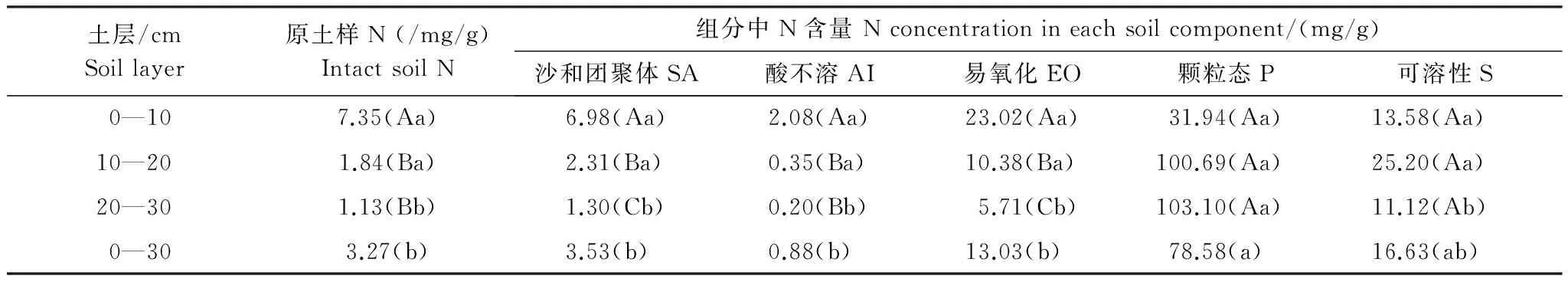
表3 不同土层各组分氮含量差异
2.4 不同组分碳氮比差异比较
各土壤组分的碳氮比在垂直剖面上的分布有差异,但多不显著,仅S组分在表层0—10 cm与20—30 cm达到显著水平,碳氮比增加80%(表4)。
从不同土壤组分的碳氮比的差异来看,0—30 cm均值碳氮比最大发生在AI组分上,其次是S和SA,分别是原土样的2.7倍、1.5倍和1.3倍,而EO和P为原土样的65.3%和33.5%。不同土层基本规律与此一致。
表4 不同土层各组分碳氮比差异
2.5 不同组分中碳、氮量占土壤相应值的比例差异(分配比例差异)
AI和EO组分碳的分配比例均随深度增加而增加,前者由表层的28.9%增加到深层的57%,后者由6.7%增加到18.7%;可溶性组分S中碳的分配比例变化不大(3%);氮的分配比例垂直变化规律表现为P组分和SA组分下降明显,前者由表层37.4%降低为深层的18.7%,后者由27.6%降低为18.0%,随深度加深而上升的主要是EO,由18%上升到48%(图2)。
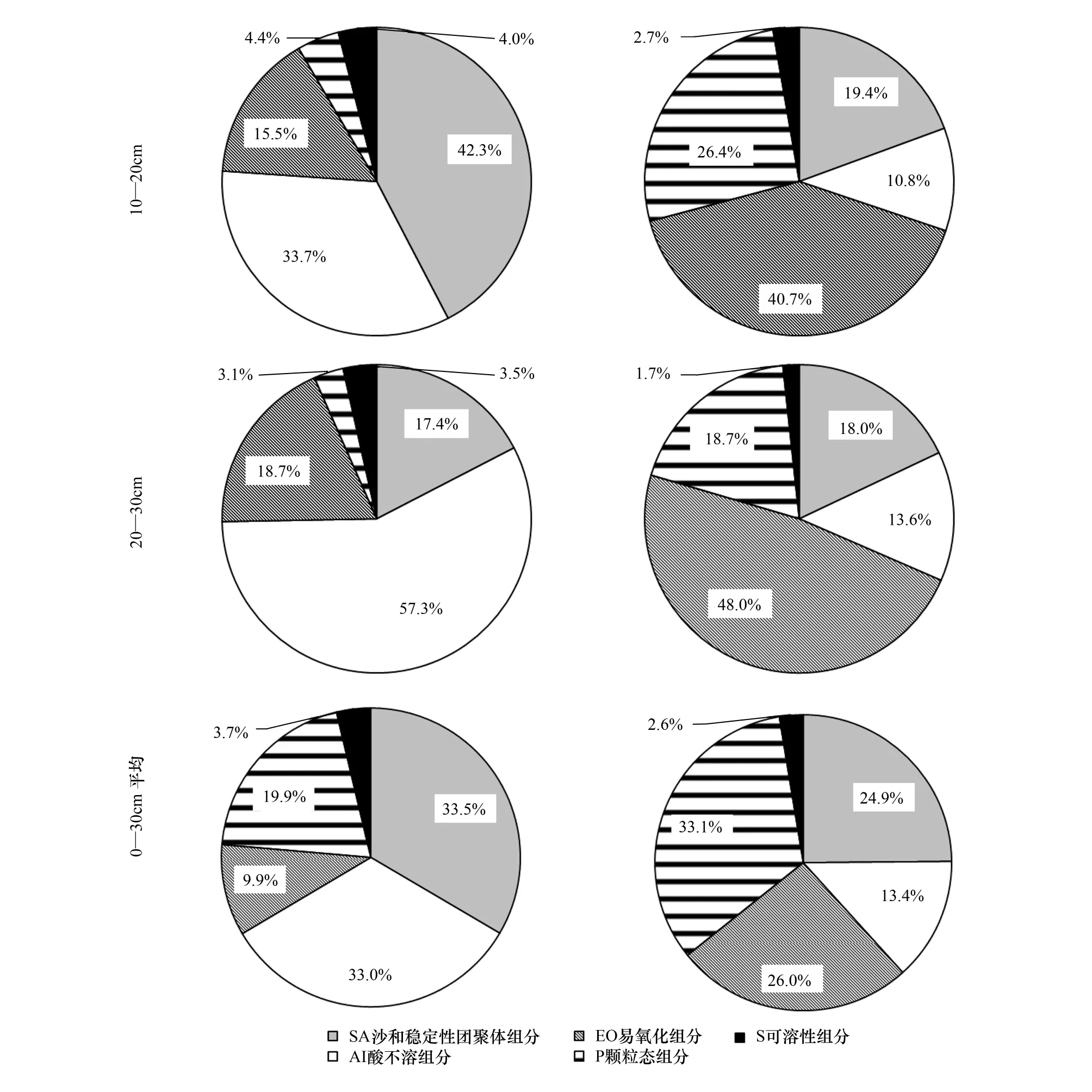
图2 不同组分中碳、氮对原土样的贡献比较及其不同土壤深度间的差异Fig.2 Contribution of different soil components to intact soil C and N, and their differences in different soil layers
不同组分间比较,30 cm均值SA和AI组分C的分配比例最大(33.5%)和(33.0%),其次分别为P(19.9%)、EO(9.9%)和S(3.7%),这一规律在不同土层基本一致。氮的分配与此不同,SA和AI组分N的分配比例(24.9%和13.4%)较低,最高者为P(33.1%)和EO(26.0%)组分,最低者为S(2.6%)组分,在不同土壤层中基本一致。
2.6 不同组分各官能团的相对含量比较
总而言之,AI组分中绝大多数官能团相对含量均最低,而P和S组分绝大多数官能团含量均较高。
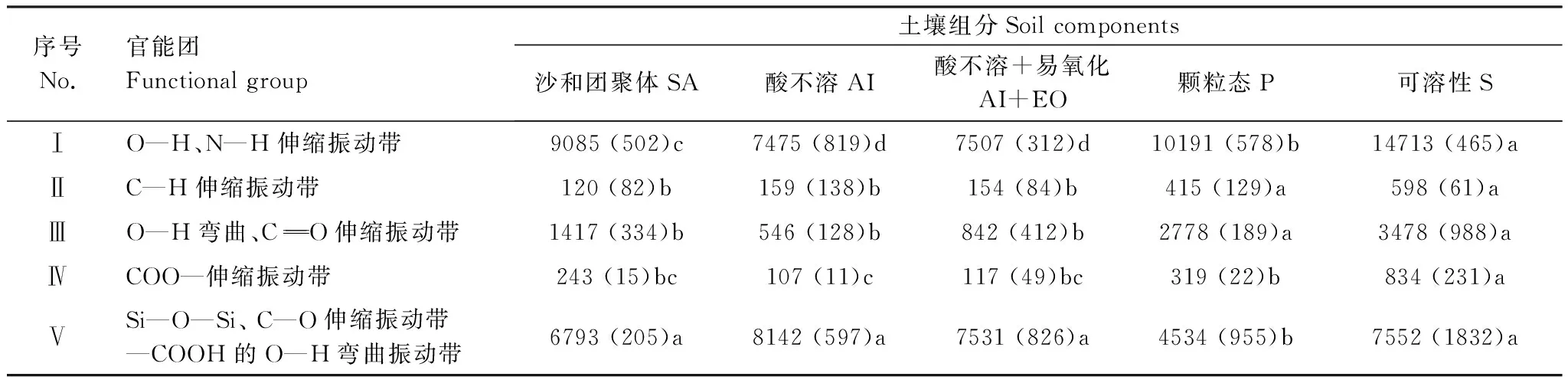
表5 红外线光谱法不同组分中各官能团峰面积大小比较(0—30 cm均值)
2.7 原土样及不同组分中碳含量、氮含量、官能团相对含量的相关关系比较
Pearson相关分析结果显示,除了P组分外,其它各组分和原土样中的碳氮呈极显著正相关(P<0.01)。而且,除P和S组分外,原土样中的碳氮与组分中的碳氮呈现显著或极显著的正相关关系(表6)。
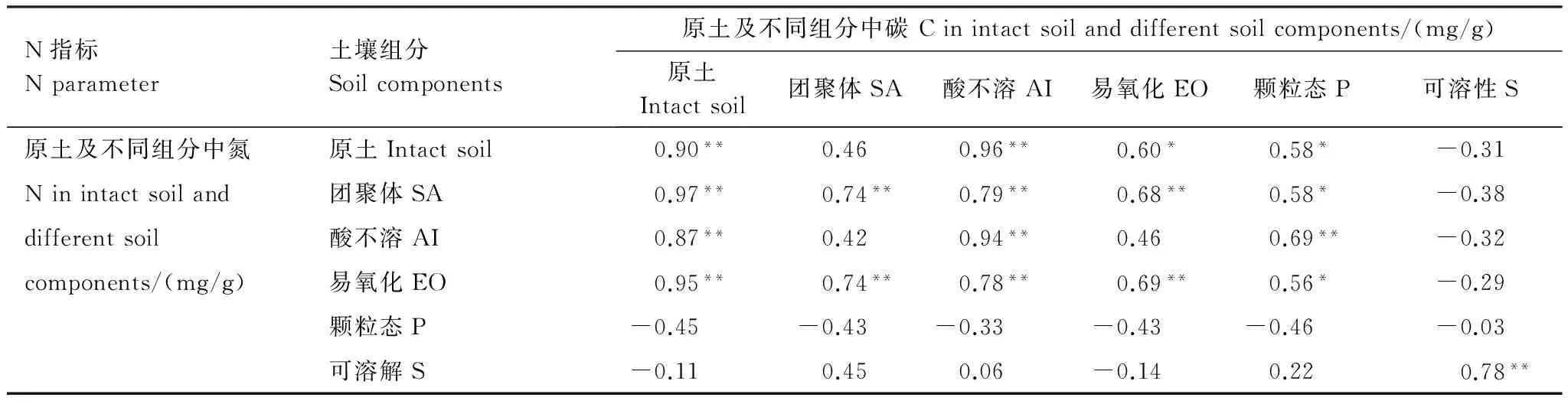
表6 原土样及不同组分内碳、氮含量的Pearson相关分析
各组分官能团含量与相关组分碳、氮、碳氮比含量的相关关系,如表7所示。结果显示,与C达到极显著正相关的有官能团Ⅰ、Ⅱ、Ⅲ和Ⅳ,而官能团Ⅰ与碳的线性相关系数最高,达到0.714;官能团Ⅱ、Ⅲ与N呈显著正相关,显著性最高的是官能团Ⅲ,官能团Ⅴ与N呈极显著负相关,相关系数为0.454;官能团Ⅲ与C/N呈显著正相关(P<0.05,R2=0.363),官能团Ⅴ与C/N呈现极显著负相关(P<0.01,R2=0.471)(表7)。

表7 碳、氮、碳氮比与官能团间的线性回归分析
3 讨论
3.1 杨桦林不同组分间碳氮储存的差异决定了土壤碳截获、氮肥力供应和土壤质量维持
利用物理化学方法对土壤组分进行分级可以揭示土壤对植被变化、土地利用方式改变的响应机制。对草原放牧和不放牧土壤碳氮及相关组分试验,没有放牧地区,表层0—20 cm有机碳和总氮保持不变,但是颗粒有机碳(POC)和颗粒有机氮(PON)显著增加,显示二者对人为活动比有机碳和总氮更为敏感,是土壤肥力变化的早期指标[5]。研究发现杨桦林不同组分间碳氮差异能够决定土壤碳截获质量与肥力供应的状况。
长白山次生杨桦林土壤氮的主体为活跃组分(P和EO),周转快,供应氮的潜力大。有研究表明,一般土壤有机质碳氮比与其分解速度呈反比关系[13],有机物C∶N比值越低,微生物分解速度就越快。易氧化组分(EO)的碳氮比最低(表3),显示其为土壤中周转最快的组分[14]。颗粒态有机碳(P碳)是进入土壤中动、植物半分解的产物,具有较高的生物活性,是土壤中不稳定的有机碳库[15],本研究确定P的碳氮比大约为9.0(表4),仅高于EO组分,反映了P组分的微生物分解速率也较快。本研究中P和EO氮含量远远高于其它土壤组分数十倍甚至数几十倍(4—80倍)(表3),导致其氮的分配比例最大(33.1%和26.0%)(图2),成为土壤氮的主体,由于P和EO组分自身的化学性质相对活跃,不稳定易矿化分解,说明长白山次生杨桦林土壤营养物质(氮素)周转快。
长白山次生杨桦林土壤碳氮结构有利于土壤碳的长期累积。AI是一种不被酸分解的惰性土壤组分,化学性质稳定,其碳氮比最大(表4),这与它不易被分解的化学性质吻合。SA组分是一种受物理保护的土壤组分,能够抵制微生物的分解[4],化学性质较稳定。本研究中AI碳的分配比例为33.5%,SA碳的分配比例仅次于AI组分(33.0%)(图2),鉴于二者是土壤中难分解的组分,说明杨桦林土壤碳主要截获于稳定组分,固碳潜力大。本研究中,P碳氮比呈现随土层加深而减小的趋势,AI和S碳氮比随土层加深而增大,其它组分碳氮比没有显著变化(表4)。所以,作为土壤氮的主体之一的P氮(图2),随根系的加深越来越容易被吸收利用,而有机碳主体之一的AI碳随土层深度的加深,越不容易分解,利于累积,说明土壤碳氮结构不仅适宜植物生长而且有利于碳的长期累积。产生这种碳截获结构主要是由AI和SA较高的质量分数所决定。本研究中,AI和SA组分碳含量很低,比原土样小了50%左右(表3),这与Golchin等[16]的研究结果相似。但是两者质量分数接近90%(表2),致使AI和SA土壤组分碳的分配比例最大(33.5%和33.0%)(图2)。王文颖等[17]对高寒草甸研究发现其稳定组分占土壤质量的比例比活跃组分高了近3倍,而本研究高出近9倍(表1),进一步说明杨桦林土壤有机碳主要禁锢在稳定组分是由其很高的质量分数所决定。
长白山次生杨桦林S土壤组分中碳占原土样的比例及其含量高于一般森林生态系统和耕地生态系统。新近凋落物,土壤腐殖质、植物残体、根系分泌物及微生物的代谢产物是土壤S碳的重要来源[18- 20]。有研究表明森林土壤S碳含量一般不超过表层土壤总有机碳含量的2%[21],而东北地区落叶松林0—40 cm土壤S组分碳的分配比例多在1.1%—1.7%之间[22],本研究中,S碳的分配比例在3.5%—4.0%之间(图2),超出耕地和一般森林生态系统近1倍。本研究中S组分中碳含量平均为335.40 mg/g,显著高于其它组分(表2)。为了便于与前人研究结果相比较,将S组分中碳含量换算为占总土壤质量的碳含量,为(738±471) mg/kg。这一含量明显高于其它研究,如Sinsabaugh等[23]报道美国密歇根州马尼斯蒂国家森林的糖枫椴木林土壤溶液介于60—100 mg/kg,王连峰等[24]测定庐山森林生态系统(落叶阔叶林和次生针叶林)土壤溶液S碳含量为(289.85±111.04) mg/kg。较高的可溶性组分可能来自于较多的新进凋落物和腐殖质及其快速周转[25],对于较多的腐殖质这一点也可从本研究中的土壤团聚体组分含量较高(表1)看出,较多的新进凋落物可能是与长白山次生杨桦林迅速更新代谢有关[26- 28]。土壤可溶性有机碳含量与土壤质量密切相关[29],这种高可溶性碳含量也有助于杨桦林土壤质量的维持。
3.2 红外光谱官能团特征与不同组分碳氮及化学活性紧密相关
利用红外线光谱方法对土壤有机质进行官能团区分能够反映耕作措施的影响机理以及土壤肥力变化的深层原因。如:不同耕作措施对水溶性土壤有机质组分的红外光谱特征受种植作物影响明显,而不同土壤腐殖酸具有特征吸收峰,但是相对含量差异明显。土壤腐殖酸及其组分(富里酸和胡敏酸)的红外线光谱特征峰受植被恢复年限的影响明显[6],对耕地土壤中疏水和亲水有机组分的红外线光谱官能团特征可揭示土壤的肥力状况[7]。结果显示红外光谱官能团特征与不同组分碳氮及化学活性具有紧密相关关系,对不同组分的化学特征具有一定的指示作用。
红外线光谱法能够对化合物内官能团的量和组成进行分析[30],这些小分子官能团的多少能够反映物质化学活性的高低。根据物理化学分组法,可以确定不同稳定性组分的多少[4],这些组分中官能团的多少可以一定程度上反映出官能团与土壤稳定性组分的关系。研究发现:土壤稳定最高组分AI中,官能团Ⅰ、Ⅱ、Ⅲ、Ⅳ区域面积最小,而Ⅴ区域面积最大。而活性较高组分(P、S)中,表现出不同的趋势:对于S组分而言,5个官能团面积均最大,对于P组分,官能团Ⅱ、Ⅲ区域面积最大,官能团Ⅴ面积最小。可以看出,特征官能团相对含量越少,土壤组分化学活性越低,尤其表现在Ⅰ、Ⅱ、Ⅲ、Ⅳ红外官能团区域(图2)。针对土壤而言,红外光谱法可以区分出很多官能团区域,这些官能团的大小与土壤物理化学稳定性的关系,至今尚没有明确结论,上述定量化结果对此有一定指示意义。
官能团具有土壤碳、氮含量指示的功能,同时还能反映土壤组分的性质也是本研究的一个重要发现。土壤碳与Ⅰ、Ⅱ、Ⅲ、Ⅳ官能团相对含量呈极显著正相关,但是与Ⅴ官能团不相关(P>0.05),而且与Ⅰ官能团相对含量相关性最高(R2=0.714,P<0.01);土壤氮与Ⅱ、Ⅲ官能团显著正相关,与官能团Ⅴ呈极显著负相关(R2=-0.454,P<0.01);土壤C/N与Ⅲ官能团显著负相关,与Ⅴ官能团呈极显著正相关(表7)。因此,可以基于红外线光谱法官能团的半定量分析可对碳、氮含量及C/N大小进行初步判断,这对于研究土壤碳氮动态具有重要的生态学意义。
4 结论
长白山次生杨桦林的土壤碳氮在不同组分中的分布特征揭示了土壤养分供应与碳的长期累积的机制。SA、AI碳氮比都比P、EO碳氮比高出几倍到几十倍,说明前者难于分解易于碳库长期维持,而后者易于微生物分解、养分快速供应。虽然稳定组分(AI和SA)内含碳量在所有组分中最低,但是土壤质量接近90%集中在稳定组分(SA和AI)中,导致稳定组分SA 和AI组分碳的分配比例分别为33.5%和33%,成为土壤有机碳累积的主体,而且随土壤深度的加深,AI组分作为有机碳累积的重要性进一步提高。由于化学性质相对活跃的组分(P和EO)中的氮含量比其它组分高出4—80倍,导致活跃组分(P和EO)氮的分配比例分别为33.1%和26.0%,而且随土层深度的加深,P组分中的氮的分配比例增大,显示活跃组分是林分土壤肥力(氮库)的主体。S土壤组分碳的分配比例和含量高于一般森林生态系统和耕地生态系统,说明长白山次生杨桦林土壤质量优于一般森林生态系统和耕地生态系统。此外,红外光谱结果显示,不同组分内官能团相对含量的高低可以反映各组分的化学活性高低;官能团含量具有维持土壤碳氮的功能,同时还能反映土壤组分的化学性质,这对于研究土壤碳氮动态具有重要的生态学意义。
[1] 杨金艳, 王传宽. 东北东部森林生态系统土壤碳贮量和碳通量. 生态学报, 2005, 25(11): 2875- 2882.
[2] 陈遐林. 华北主要森林类型的碳汇功能研究[D]. 北京: 北京林业大学, 2003.
[3] 赵鑫, 宇万太, 李建东, 姜子绍. 不同经营管理条件下土壤有机碳及其组分研究进展. 应用生态学报, 2006, 17(11): 2203- 2209.
[4] Zimmermann M, Leifeld J, Schmidt MWI, Smith P, Fuhrer J. Measured soil organic matter fractions can berelated to pools in the RothC model. European Journal of Soil Science, 2007, 58(3): 658- 667.
[5] Wen H Y, Niu DC, Fu H, Kang J. Experimental investigation on soil carbon, nitrogen, and their components under grazing and livestock exclusion in steppe and desert steppe grasslands, Northwestern China. Environmental Earth Sciences, 2013, 70(7): 3131- 3141.
[6] 张玉兰, 孙彩霞, 段争虎, 陈利军, 武志杰, 陈晓红, 张艾明, 刘兴斌, 王俊宇. 光谱法分析固沙工程对土壤腐殖质及组分的影响. 光谱学与光谱分析, 2010, 30(1): 179- 183.
[7] Matejkova S, Simon T. Application of FTIR spectroscopy for evaluation of hydrophobic/hydrophilic organic components in arable soil. Plant Soil and Environment, 2012, 58(4): 192- 195.
[8] 王存国, 韩士杰, 张军辉, 王树堂, 徐媛. 长白山阔叶红松林表层土壤水分空间异质性的地统计学分析. 应用生态学报, 2010, 21(4): 849- 855.
[9] 王刚, 王春燕, 王文颖, 王启基. 子午岭森林灰褐土保护有机碳的能力及各密度组分生化特征. 科学通报, 2004, 49(24): 2562- 2567.
[10] Froberg M, Berggren D, Bergkvist B, Bryant C, Knicker H. Contributions of Oi, Oe and Oa horizons to dissolved organic matter in forest floor leachates. Geoderma, 2003, 113(3/4): 311- 322.
[11 ] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000.
[12] Johnson C T, Aochi Y O. Fourier transform infrared and Raman spectroscopy. Soil Science Society of America, part 3, 1996: 269- 321.
[13] 王绍强, 于贵瑞. 生态系统碳氮磷元素的生态化学计量学特征. 生态学报, 2008, 28(8): 3937- 3947.
[14] Zou X M, Ruan H H, Fu Y, Yang X D, Sha L Q. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biology and Biochemistry, 2005, 37(10): 1923- 1928.
[15] Camberdella C A, Elliott E T. Methods for physical separation and characterization of soil organic matter fractions. Geoderma, 1993, 56(1/4): 449- 457.
[16] Golchin A, Clarke P, Oades J M, Skjemstad J O. The effects of cultivation on the composition of organic matter and structural stability of soils. Australian Journal of Soil Research, 1995, 33(6): 975- 993.
[17] 王文颖, 王启基, 鲁子豫. 高寒草甸土壤组分碳氮含量及草甸退化对组分碳氮的影响. 中国科学D辑: 地球科学, 2009, 39(5): 647- 654.
[18] Kalbitz K, Solinger S, Park JH, Michalzik B, Matzner E. Controls on the dynamics of dissolved organic matter in soils: a review. Soil Science, 2000, 165(4): 277- 304.
[19] Zsolnay A. Dissolved humus in soil waters//Piccolo A. Humic Substances in Terrestrial Ecosystems. Amsterdam: Elsevier, 1996: 171- 223.
[20] McDowel W H, Zsolnay A, Aitkenhead-Peterson J A, Gregorich E G, Jones D L, Jodemann D, Kalbitz K, Marschner B, Schwesig D. A comparison of methods to determine the biodegradable dissolved organic carbon from different terrestrial sources. Soil Biology and Biochemistry, 2006, 38(7): 1933- 1942.
[21] 李玲, 肖和艾,苏以荣, 黄道友, 吴金水. 土地利用对亚热带红壤区典型景观单元土壤溶解有机碳含量的影响. 中国农业科学, 2008, 41(1): 122- 128.
[22] 苏冬雪, 王文杰, 邱岭, 王洪岩, 安静,郑广宇, 祖元刚. 落叶松林土壤可溶性碳、氮和官能团特征的时空变化及与土壤理化性质的关系. 生态学报, 2012, 32(21): 6705- 6714.
[23] Sinsabaugh R L, Zak D R, Gallo M, Lauber C, Amonette R. Nitrogen deposition and dissolved organic carbon production in northern temperate forests. Soil Biology and Biochemistry, 2004, 36(9): 1509- 1515.
[24] 王连峰, 潘根兴, 石盛莉, 黄明星, 张乐华. 酸沉降影响下庐山森林生态系统土壤溶液溶解有机碳分布. 植物营养与肥料学报, 2002, 8(1): 29- 34.
[25] Wang Y, Dai L M, Yu D P, Zhou L. Productivity and turnover of fine-roots of Betula platyphylla forest in Chang-bai Mountain. Hunan Agricultural Sciences, 2010, (7): 113- 115.
[26] 李飞. 红松阔叶林及其次生杨桦林生物生产力的研究. 生态学杂志, 1984, 3(2): 8- 12.
[27] 栾士波, 范玉清, 周希利, 李传生. 天然杨桦林生长规律的研究. 吉林林业科技, 1999, 139(2): 3- 8.
[28] 栾士波, 肖玉杰, 王汝才. 杨桦林经营密度的研究. 东北林业大学学报, 1999, 27(3): 7- 9.
[29] Tipping E, Woof C, Rig E. Climatic influences on the leaching of dissolved organic matter from upland UK moorland soils, investigated by a field manipulation experiment. Environment International, 1999, 25(1): 83- 95.
[30] Vohland M, Besold J, Hill J, Frund H C. Comparing different multivariate calibration methods for the determination of soil organic carbon pools with visible to near infrared spectroscopy. Geoderma, 2011, 166(1): 198- 205.
Features of soil C and N dynamics in a typical secondary poplar-birch forest in Northeast China
JI Changping1, WANG Wenjie1,*, HAN Shijie2, ZU Yuangang1
1KeyLaboratoryofForestPlantEcology,MinistryofEducation,NortheastForestryUniversity,Harbin150040,China2ResearchInstituteofAppliedEcology,ChineseAcademyofSciences,Shenyang110016,China
Precise classification of soil organic fractions is the basis for studying soil organic carbon (C) and nitrogen (N) dynamics. However, relevant information about the secondary poplar-birch forest (SPBF) is scarce, although it is one of the main natural forests in Northeast China. In this study, we discuss the potential of soil C sequestration and soil fertility in this forest. For this purpose, soils were sampled from layers at depths of 0—10, 10—20, and 20—30 cm in a typical SPBF in Changbai Mountain. Collected soils were divided into five fractions according to their physicochemical stabilities, which included sand and stable aggregates soil fraction (SA), acid insoluble soil fraction (AI), easily oxidized soil fraction (EO), particle soil fraction (P), and soluble soil fraction (S). Mass fraction (percentage of each component in the intact soil), concentration of organic C and N, allocation proportions of organic C and N, C/N ratio, and five infrared functional groups in all fractions were analyzed. Results showed that nearly 90% of all soil fractions was classified as AI (66.21%) and SA (22.11%), which resulted in the highest amount of soil C sequestration (about 2/3 of the entire soil C). This amount was occluded in stable fractions of soil with a 2—9 fold higher C/N ratio than the active fractions of P and EO. The 4—80 fold higher N concentration in the active fractions of P and EO resulted in higher allocation proportion of N in these two fractions (33.1% and 26.0%, respectively). Close correlation between organic C and N was generally found among fractions or within each of the fractions, with the exception of those in the P and S fractions owing to their extremely low proportion in the total intact soil. This difference in storage pattern of organic C and N among different fractions favors the long-term storage of C in soil with rapid N supply for plant growth. Together with the changes in organic C and N in different soil fractions, different infrared functional groups were observed in different soil fractions. The relative contents of most of infrared functional groups in the AI fraction were the lowest, while the relative contents of most of infrared functional groups in the P and S fractions were higher than those in other groups. Significant positive correlations among each couple of organic C, N, and most of the infrared functional groups in the same fraction were determined, indicating that the infrared functional groups can probably maintain the functions of soil C and N. Otherwise, significant correlations between the infrared functional groups and C/N ratio indicated the relative contents of infrared functional groups of the soil fractions, revealing various chemical activities of different soil fractions. Our findings indicate the importance of clarifying the mechanism of soil C sequestration and N availability in soils in SPBF. These data provide a basis for understanding changes in soil C and N dynamics in the SPBF and their possible performance in response to global warming process.
carbon sequestration; soil N; soil components fraction; soil C/N; infra-red spectrum and functional group identification
国家“973”课题资助项目(2011cb403205); 中央高校业务资金项目(dl12da03); 国家自然科学基金项目(41373075)
2013- 10- 07;
日期:2014- 11- 03
10.5846/stxb201310072410
*通讯作者Corresponding author.E-mail: wjwang225@hotmail.com
汲常萍, 王文杰, 韩士杰, 祖元刚.东北次生杨桦林土壤碳氮动态特征.生态学报,2015,35(17):5675- 5685.
Ji C P, Wang W J, Han S J, Zu Y G.Features of soil C and N dynamics in a typical secondary poplar-birch forest in Northeast China.Acta Ecologica Sinica,2015,35(17):5675- 5685.

