九种交配组合鳢生长和消化酶指标的比较分析
■吕子君 谢少林 王 超 周爱国,2 邹记兴
(1.华南农业大学动物科学学院,广东广州 510642;2.清远市北江水产科学研究所,广东清远 511510)
消化酶是指由消化系统和消化腺分泌的,起营养和消化作用的酶类[1]。不同的消化酶在鱼类各消化器官内的分布存在差异,同一种酶在不同消化器官中的分布也存在明显差异。消化酶活力可以反映鱼类消化系统的发育状况和基本的消化生理特征,也可以据此来看鱼类对饵料的吸收情况[2-4]。目前,对鱼类消化酶的研究主要是集中于蛋白酶、脂肪酶、淀粉酶三大类。鱼类的胃中最强的消化酶是胃蛋白酶[5],胰脏也是鱼体内分泌蛋白酶的主要器官[6]。另外,肠内也有来源于幽门垂和肝胰脏的胰蛋白酶。鱼类的脂肪酶主要是在肝胰脏中分泌的。现有的研究表明,脂肪酶几乎存在于鱼类所有的消化组织器官中,且其活性与鱼摄食的食物脂肪含量正相关。肝胰脏是大部分鱼类的淀粉酶分泌器官,还有部分鱼类的肠道也起着分泌淀粉酶的功能。目前,国内对乌鳢消化酶的研究报道相对于斑鳢和杂交鳢较多,但对三者的杂交组合研究仍未有报道。
乌鳢(Channa argus)和斑鳢(C.maculate)均属于鲈形目(Perciformes)、鳢科(Channidae)、鳢属(Chan⁃na)。杂交鳢是以乌鳢(♂)×斑鳢(♀)杂交获得的F1代。由于乌鳢的养殖主要以动物性饵料为主,所以养殖成本偏高,而常常带来病害,对自然环境也造成了破坏。斑鳢的人工驯化取得一定成效,但其品种本身抗病能力差、生长慢,导致种质退化严重。到2002年后,珠三角地区最先开始了杂交鳢[乌鳢(♂)×斑鳢(♀)]的养殖,因其生长快、适应性强、驯化容易、产量高等优势,得到了很大的养殖推广[7-8]。但近几年也出现生长速度下降和病害频发等问题。因此,筛选优质、高产的鳢科鱼类新品种是中国鳢科鱼类养殖业迫切需要解决的问题。本文对以乌鳢、斑鳢和杂交鳢各自进行近交、回交、反交及杂交繁殖出的九种鳢的生长和消化酶进行比较研究,以选育出生长速度快、成活率高、饵料转化率高的鳢。
1 材料与方法
1.1 试验材料
养殖试验于广东省中山市三角镇裕荣水产繁殖场进行。用于试验的九种组合鳢来源于乌鳢、斑鳢及杂交鳢[斑鳢(♀)×乌鳢(♂)]作为亲鱼彼此之间交配繁殖的同一批次的F1代,每组设三个平行,每个平行放养50尾鱼,网箱规格:2 m×2 m×1.5 m,网箱水位1 m左右,每组的体重(68.34±6.26)g,养殖期为90 d,养殖期间定期对每组鱼进行过筛分养,以减少组内残食。
1.2 样品收集与测定
1.2.1 生长指标
采样前禁食24 h,再进行样品采集。清点每个平行的鱼数量并进行称重,计算成活率、总增重、特定生长率和饵料系数。
成活率(Survival rate,SR)(%)=100×终末鱼尾数/初始鱼尾数;
特定生长率(Specific growth rate,SGR)(%/d)=100×(Ln终末平均体重-Ln初始平均体重)/饲养天数;
饵料系数(Feed coefficient,FE)=总摄食量(g)/鱼净增重(g)。
1.2.2 消化酶指标
每个网箱随机取8尾鱼,迅速在冰上解剖鱼体,采集肝胰脏、胃、幽门盲囊、前肠、后肠等消化组织,于-80℃冰箱中保存备用。测定消化酶活性前,在组织样品中加入9倍0.8%生理盐水,用电动匀浆器在冰浴条件下充分匀浆,匀浆液在4℃、4 000 r/min条件下离心8 min,吸取上清液,于-80℃冰箱中保存备用。本试验测试肠道、胃、肝脏消化酶指标包括:胃蛋白酶、胰蛋白酶、脂肪酶、淀粉酶。按照南京建成试剂盒说明书的测定方法进行操作。
①淀粉酶单位定义:组织中每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。
② 胰蛋白酶单位定义:在pH值8.0,37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位。
③胃蛋白酶单位定义:每毫克组织蛋白37℃每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位。
④脂肪酶单位定义:在37℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。
1.3 数据处理
数据采用SPSS18.0软件进行one-way ANOVA分析,组间数据用Duncan's法比较。结果用“平均值±标准差(Mean±SE)”表示,P<0.05表示差异显著。
2 试验结果
2.1 九种交配组合鳢的生长指标比较(见表1)
由表1可知,九组合中G1的成活率最高,达到82.33%,且显著高于其他组。G5的成活率最低,仅为70.69%。G2、G4、G6、G8、G9之间无显著差异(P>0.05),均显著高于G3、G5、G7(P<0.05);G3、G5、G7各组之间无显著差异(P>0.05)。
从总增重的数据可看到,G2增重最多,其次为G1、G4,最少的是G5,G1、G2显著高于G3、G5、G8、G9,但与G4、G6、G7之间差异不显著。

表1 九种交配组合鳢部分生长指标
G2的特定生长率最大,其次为G1、G4。特定生长率的大小顺序为 G2>G1>G4>G7>G6>G3>G8>G9>G5。G2显著大于G5,但与其他各组之间差异不显著;其余各组之间差异不显著(P>0.05)。
九种组合中饵料系数最高的为G6,其次是G7,最低的为G5,G6比G5高42.6%,G6、G7之间差异不显著,显著高于其他各组。G2、G3、G8、G9之间差异不显著,显著高于G1、G4、G5。G1、G4、G5之间差异不显著。
2.2 九种交配组合鳢消化酶活性比较
2.2.1 淀粉酶活性(见表2)
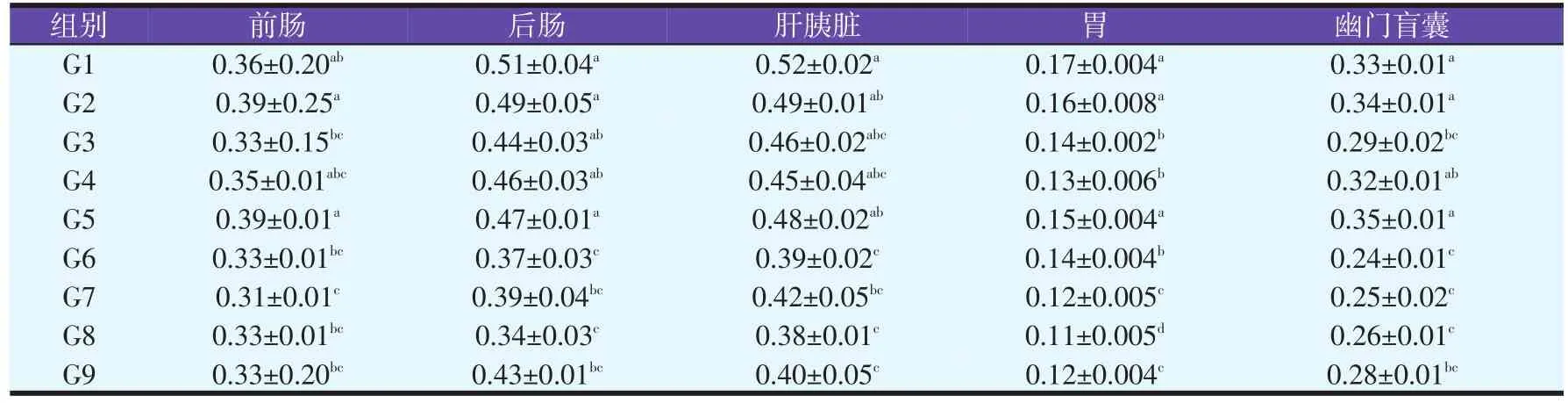
表2 九种交配组合鳢各组织淀粉酶活性(U/ml)
由表2中可知,在前肠中G7的淀粉酶活性最低,G2最高,比G7高25.8%。前肠淀粉酶的活性的大小顺序为 G2>G5>G1>G4>G9>G3>G6=G8>G7。G2、G5显著高于G3、G6、G7、G8、G9,与G1、G4之间差异不显著;G1与G3、G4、G6、G8、G9之间差异不显著,显著高于G7。G3、G4、G6、G7、G8、G9各组间差异不显著。
在后肠中,G1的淀粉酶活性最高,其次为G2,G8最低,分别比G1、G2低33.3%、30.6%。G1、G2、G5与G3、G4之间差异不显著,显著高于G6、G7、G8、G9。G3、G4与G7、G9之间差异不显著,显著高于G6、G8。G6、G7、G8、G9各组间差异不显著。
在肝胰脏中,淀粉酶的活性大小为G1>G2>G5>G3>G4>G7>G9>G6>G8,G1的淀粉酶活性最高,G8最低。G1与G2、G3、G4、G5各组间的差异不显著,显著高于G6、G7、G8、G9。G2、G5显著高于G6、G8、G9,与G3、G4、G7各组间差异不显著。G3、G4、G6、G7、G8、G9各组间差异不显著。
在胃中,淀粉酶的活性大小为 G1>G2>G5>G6>G3>G4>G7>G9>G8,G1中淀粉酶活性最高,G8最低。G1、G2、G5之间差异不显著,显著高于G3、G4、G6、G7、G8、G9。G3、G4、G6之间差异不显著,显著高于G7、G8、G9。G7、G9显著高于G8,G7、G9之间差异不显著。
在幽门盲囊中,淀粉酶活性大小为G5>G2>G1>G4>G3>G9>G8>G7>G6,G5中淀粉酶活性最高,G2、G1其次,G6中最低,比G1、G2、G5分别低27.2%、29.4%、31.42%。G1、G2、G5 与G4间差异不显著,显著高于G3、G6、G7、G8、G9。G4显著高于G6、G7、G8,与G3、G9之间差异不显著。G3、G6、G7、G8、G9各组之间差异不显著。
2.2.2 胰蛋白酶活性(见表3)
由表3可知,在前肠中各组胰蛋白酶活性最高的是G1,其次为G2、G5,G7最低,G1、G2、G5分别比G7高46.5%、31.5%、31.4%。G1显著高于G6、G7、G8,与G2、G3、G4、G5、G9之间差异不显著。G2、G3、G4、G5、G9与G6、G8之间差异不显著,显著高于G7。G6、G7、G8各组间差异不显著。

表3 九种交配组合鳢各组织胰蛋白酶活性(U/ml)
在后肠中,G5的胰蛋白酶活性最高,G1、G2次之,G7最低,胰蛋白酶活性的大小为G5>G1>G2>G9>G6>G4>G8>G3>G7。G1、G2、G5、G9与G4、G6之间差异不显著,显著高于 G3、G7、G8。G4、G6显著高于G7,与G3、G8之间差异不显著。G3、G7、G8之间差异不显著。
在肝胰脏中,胰蛋白酶的活性大小为G1>G2>G5>G4>G3>G7>G8>G6>G9,G1 的胰蛋白酶活性最高,G9最低,比G1低36.2%。G1显著高于其他各组。G2、G4、G5之间差异不显著,显著高于G3、G6、G7、G8、G9。G3、G7、G8之间差异不显著,显著高于G6、G9。G6、G9之间差异不显著。
在胃中,G5胰蛋白酶活性最高,G1、G2次之,G7最低。G5显著高于G3、G4、G6、G7、G8、G9,与G1、G2之间差异不显著。G1与G2、G4、G5之间差异不显著,但显著高于G3、G6、G7、G8、G9。
在幽门盲囊中,胰蛋白酶活性在G2中最高,G1、G5次之,G7中最低。大小顺序为G2>G1>G5>G9>G4>G3>G8>G6>G7,G1、G2、G5各组间差异不显著,显著高于G3、G4、G6、G7、G8、G9;G3、G4与G9之间差异不显著,显著高于G6、G7、G8;G6、G7、G8组间差异不显著。2.2.3 胃蛋白酶活性(见表4)

表4 九种交配组合鳢胃蛋白酶活性(U/ml)
由表4可知,胃蛋白酶在前肠中的活性大小顺序G1>G5>G2>G4>G3>G6>G9>G8>G7,胃蛋白酶的活性在G1中最高,G7中最低。G1显著高于G3、G6、G7、G8、G9,与G2、G4、G5各组间差异不显著。G5显著高于 G7、G8、G9,与 G2、G3、G4、G6之间差异不显著。G2显著高于G7,与其他各组间差异不显著。G4与其他各组间差异不显著。G3、G6、G7、G8、G9各组间差异不显著。
在后肠中,胃蛋白酶活性最高的是G2,其次是G4、G5,最低的是G7,G2比G7高52.9%。G1、G2、G3、G4、G5显著高于G7,G2、G4显著高于G7、G8,G1、G2、G3、G4、G5、G6、G9各组间差异不显著。G1、G3、G5显著高于G7,与G6、G8、G9各组间差异不显著。G6、G7、G8、G9各组间差异不显著。
胃蛋白酶的活性在肝胰脏中相对于其他组织来说是最小的,其中G1最高,G2、G5次之,G8中最低。胃蛋白酶的活性的大小顺序为G1>G2>G5>G4>G3>G6>G9>G7>G8,G1与G2、G5差异不显著,显著高于G3、G4、G6、G7、G8、G9。G2、G5显著高于G7、G8、G9,与G3、G4、G6各组之间差异不显著。G3、G4、G6、G7、G8、G9各组间差异不显著。
胃蛋白酶在胃中的活性远远大于其他组织中的活性,在九个组合中活性最高的是G5,最低的是G6,G5比G6高90.64%。G5与G1、G2、G4各组间差异不显著,但显著高于G3、G6、G7、G8、G9。G6和G7又显著低于G9。胃蛋白酶的活性的大小顺序为G5>G4>G1>G2>G9>G8>G3> G7>G6。
在幽门盲囊中,胃蛋白酶的活性大小为G5>G2>G1>G6>G7>G8>G9>G3>G4。G5 与 G1、G2 之间差异不显著,显著高于G3、G4、G6、G7、G8、G9。G1、G2与G5、G6、G7差异不显著,但显著高于G3、G4、G8、G9。G6与G7差异不显著,但显著低于G5。G3、G4、G6、G7、G8、G9各组间差异不显著。
2.2.4 脂肪酶活性(见表5)

表5 九种交配组合鳢各组织脂肪酶活性(U/ml)
由表5知,在前肠中脂肪酶活性大小为G1>G5>G2>G6>G9>G4>G8>G3>G7,脂肪酶活性最高的为G1,最低的为G7。G1显著高于G2、G3、G4、G6、G7、G8、G9,与G5之间差异不显著。G5显著高于G3、G4、G7、G8、G9,与G2、G6之间差异不显著。G2显著高于G7、G3、G4、G8,与G6、G9差异不显著。G6显著高于G7,与其他各组之间差异不显著(G1除外)。G3、G4、G7、G8、G9各组之间差异不显著。
脂肪酶在后肠中活性比在其他组织中的要低,九组合中活性最高的为G2,其次是G5、G1,最低的为G7。G2显著高于G4、G6、G7、G8,与G1、G3、G5、G9各组间差异不显著。G1、G5显著高于G6、G7,与其他各组间差异不显著。G3、G4、G6、G7、G8、G9各组之间差异不显著,其中G3、G9与其他各组之间差异均不显著。
在肝胰脏中脂肪酶活性最高的为G5,最低的为G7,G5比G7高38.13%,九组合中大小顺序为G5>G1>G2>G9>G3>G8>G6>G4>G7。G1、G2、G5之间差异不显著,显著高于G3、G4、G6、G7、G8、G9。G3、G4、G6、G7、G8、G9各组之间差异不显著。
在胃中,脂肪酶的活性大小顺序为G1>G2>G5>G8>G3>G4>G9>G6>G7,最高的为G1,G2、G5次之,最低的为G7。G1、G2、G5之间差异不显著,显著高于G3、G4、G6、G7、G8、G9。G8显著高于G7,与G3、G4、G6、G9各组之间差异不显著。G3、G4、G6、G7、G9各组之间差异不显著。
在幽门盲囊中脂肪酶活性最高的为G1,G2、G5次之,最低的为G7,G1、G2、G5分别比G7高74.5%、71.5%、65.6%。G1、G2、G5之间差异不显著,显著高于G3、G4、G6、G7、G8、G9。G3显著高于G4、G6、G7、G8,与G9之间差异不显著。G9显著高于G4、G6、G7、G8。G4、G6、G7、G8各组间差异不显著。
3 讨论
3.1 九种交配组合鳢生长指标
成活率的高低对产值有巨大的影响,本试验中的G1成活率最高,比其他杂交组合有显著的优势。总增重增加的大小就是对产量的体现,特定生长率是衡量生长状况的一个常用指标,特定生长率越大,体重增长越快。本试验中G5总增重显著低于其他组合,特定生长率显著低于G2,说明该组合在此养殖阶段生长缓慢。饵料系数是能效转换的体现,试验中G1、G4和G5的饵料系数较小,生长效率高。综合上述分析可知,G1[斑鳢(♀)×斑鳢(♂)]的成活率最高,可能试验的场地比较接近斑鳢的自然栖息地环境。但是从总增重、特定生长率这两个指标上来看,G1、G2、G4、G6和G7都显示了较大的优势,体现出一定的“杂种优势”。结合饵料系数来看,G1和G4的生长效果优于其他组合。G5[乌鳢(♀)×乌鳢(♂)]中成活率、总增重和特定生长率均显著低于其它组合,这可能与驯化投喂膨化饲料的效果不好所致。
3.2 九种交配组合鳢消化酶指标
消化酶活性是反映鱼类消化机能的一项重要指标。根据消化对象的不同,鱼类的消化酶主要分为淀粉酶、蛋白酶及脂肪酶等几类。消化酶活性随鱼的种类、健康状况和生长阶段等不同而异[9]。
3.2.1 九种交配组合鳢淀粉酶活性
淀粉酶普遍存在于鱼类的各种消化器官中,但是不同消化器官中的活性差别比较大,不同鱼类也有差异[10]。一般认为鱼类的唾液腺会随着进化而逐渐退化,肝胰脏是主要的淀粉酶分泌器官[11,5],在胃内淀粉酶的活性较低,明显低于肠、肝胰脏和幽门垂等器官淀粉酶活性。本试验的研究发现,不同的组织中九种交配组合鳢都有淀粉酶活力,但有一定的差异。从结果来看,G1、G2、G5在本试验所测的组织中都具有较高的淀粉酶活力,相互之间无显著差异。综上分析可知,G1[斑鳢(♀)×斑鳢(♂)]、G2[斑鳢(♀)×乌鳢(♂)]和G5[乌鳢(♀)×乌鳢(♂)]相对其他组来说淀粉酶活性较强。
3.2.2 九种交配组合鳢胰蛋白酶活性
胰蛋白酶一般需要在肠激活酶的作用下才能成为有活性的蛋白酶,而且要在最适pH值下才可以发挥最大的活性,肠液有增强胰蛋白酶活性的功能[12]。莫桑比克罗非鱼的肝胰脏蛋白酶的活性比肠蛋白酶活性高[13]。本试验的九种交配组合鳢在不同组织中的胰蛋白酶活力有较大差异。G1[斑鳢(♀)×斑鳢(♂)]和G2[斑鳢(♀)×乌鳢(♂)]在不同的组织中具有较高的胰蛋白酶活力。G2[斑鳢(♀)×乌鳢(♂)]和G5[乌鳢(♀)×乌鳢(♂)]除了在肝胰脏中的胰蛋白酶活力较低之外,在其他组织中也有着较高的胰蛋白酶活力。
3.2.3 九种交配组合鳢胃蛋白酶活性
鱼类的蛋白酶主要来自胃部(或幽门盲囊)和肝胰脏,胃蛋白酶活性以胃黏膜中的最大,其它组织器官中活性很弱。对于有胃鱼类来说,胃和前肠是鱼类对食物进行消化的主要场所[14],本文的研究中,胃蛋白酶活性顺序:胃>前肠>幽门盲囊>后肠>肝胰脏。胃蛋白酶一般在强酸性的pH值下发挥最大活性。G1[斑鳢(♀)×斑鳢(♂)]、G2[斑鳢(♀)×乌鳢(♂)]和G5[乌鳢(♀)×乌鳢(♂)]在不同的组织中都有着很高的胃蛋白酶活性。
3.2.4 九种交配组合鳢脂肪酶活性
脂肪在脂肪酶的作用下,分解成甘油酯和自由脂肪酸的混合物而被鱼类吸收。在鱼类很多消化器官都有脂肪酶发现,目前一般认为肝胰脏是分泌脂肪酶的主要器官,而主要消化部位则是肠道[15-16]。根据试验数据可知,G1[斑鳢(♀)×斑鳢(♂)]和G5[乌鳢(♀)×乌鳢(♂)]在不同的组织中都有最高的脂肪酶活性。G2[斑鳢(♀)×乌鳢(♂)]除了在前肠中的活性较低之外,在其他组织都与G1、G5的活性相当。
从九种交配组合鳢的生长性能和消化酶活性分析,发现G1[斑鳢(♀)×斑鳢(♂)]、G2[斑鳢(♀)×乌鳢(♂)]和G4[乌鳢(♀)×斑鳢(♂)]在生长和消化酶方面与其他各组相比有较大的优势。G5[乌鳢(♀)×乌鳢(♂)]有较高的消化酶活性,但在实验阶段的生长缓慢,没有表现出优势,但广东地区的养殖效果表明乌鳢比斑鳢的生长快,这可能因为这种组合的鱼在前期生长缓慢,在养殖后期才会有较高的生长率。综上所述,在本研究的鱼种阶段,九种交配组合鳢中,以G1[斑鳢(♀)×斑鳢(♂)]、G2[斑鳢(♀)×乌鳢(♂)]和G4[乌鳢(♀)×斑鳢(♂)]组合最好,但是否适宜作为主要养殖品种进行大面积推广,还需要对后期的生长情况进行研究;而杂交鳢的自交及回交后代在本实验中的结果显示,各方面的指标反而比亲本的要差,而且这些品种对环境的适应能力比较差,不宜大面积推广,但杂交鳢[斑鳢(♀)×乌鳢(♂)]自身的生长表现出较大的优势。