孕早、晚期接受七氟醚麻醉对大鼠子代大脑神经发育的影响
陈弦 陶凡 黄丽霞 范皓
孕早、晚期接受七氟醚麻醉对大鼠子代大脑神经发育的影响
陈弦 陶凡 黄丽霞 范皓
目的钼研究孕早、晚期Wistar大鼠母体接受七氟醚吸入麻醉对子代大脑神经发育的影响。方法钼将12只孕鼠按随机数字表法分为孕6d用药组(A组)、孕19d用药组(B组)和对照组(C组),每组各4只。A、B组分别于孕6d、孕19d时吸入2.4%七氟醚6h,C组饲养于空气条件下。应用Nissl染色法观察仔鼠在出生后第1、14、21天脑组织海马CA1区神经元尼氏体的表达情况。在仔鼠出生后第32天采用Morris水迷宫实验对各组仔鼠学习记忆功能进行测定。 结果 出生后第1天,B组仔鼠海马CA1区神经元损伤程度明显高于A组及C组仔鼠;出生后第14天,B组仔鼠神经损伤减轻,A组仔鼠神经损伤加重;出生后第21天,B组仔鼠神经损伤程度较轻,A组仔鼠神经损伤较重。出生后第32天,A组和B组仔鼠逃避潜伏期、穿越目标象限次数、穿越平台次数与对照组仔鼠相比均无统计学差异(均P>0.05)。 结论 在本实验条件下,孕早、晚期母体接受2.4%七氟醚麻醉对Wistar大鼠子代大脑神经发育的影响随时间变化而改变,并不造成子代远期学习记忆功能异常。
七氟醚 子代 学习记忆 尼氏体 孕早期 孕晚期 大鼠
七氟醚是临床常用的吸入麻醉剂,其理化性质稳定,诱导迅速,刺激性小,对循环抑制轻。随着产科微创手术的广泛开展,越来越多的孕产妇需要使用麻醉药,甚至在某些紧急情况下需要接受全身麻醉。目前,七氟醚对孕期胎儿是否安全尚无定论。本实验旨在评价孕早期、孕晚期母体接受七氟醚麻醉后对子代大脑神经发育及远期认知功能的影响,为临床麻醉提供依据。
1 材料和方法
1.1 动物模型制备与分组 成年性成熟未交配雌性Wistar大鼠(由浙江中医药大学动物中心提供)24只,体重180~210g。成年性成熟雄性Wistar大鼠(由浙江中医药大学动物中心提供)24只,体重300g。雌鼠与雄鼠1∶1合笼饲养。应用托盘阴栓检查法于次日早晨观察托盘中是否有阴栓,发现阴栓当天记为受孕第0日。排除不孕及假孕雌鼠,将12只怀孕雌鼠采用随机数字表法分为3组,孕6d用药组(A组)、孕19d用药组(B组)以及对照组(C组),每组各4只。A、B组分别在孕鼠怀孕第6、19天给予七氟醚吸入,浓度2.4%,时间6h,氧流量0.5L/min。C组一直饲养于空气条件下。
1.2 自制麻醉箱 将A、B组孕鼠分别于孕6d及孕19d放入20cm×12cm×10cm自制小盒内,在盒的两侧各有一小孔,一端接小动物麻醉机(浙江中医药大学动物中心提供),输入100%氧气和七氟醚气体。另一端为出气端,接废气吸收罐以吸收CO2等。氧流量0.5L/min,七氟醚吸入浓度2.4%,持续时间6h。后将孕鼠置于空气条件下自然苏醒。
1.3 组织切片制备 孕鼠自然分娩,A组、B组和C组仔鼠中分别取出生后第1、14、21天仔鼠各6只,断头取脑,固定于10%中性甲醛溶液中72h。切取包含海马部位的脑组织块,进行梯度乙醇脱水,二甲苯透明,石蜡包埋,行冠状位连续切片,片厚约4μm。
1.4 Nissl染色 组织切片脱蜡至水,加1%甲苯胺蓝水溶液后浸染25min,95%乙醇快速分色,无水乙醇脱水,二甲苯透明,中性树胶封固。光镜下观察海马CA1区神经元的形态学变化。
1.5 Morris水迷宫实验 分别从A、B、C组仔鼠中再选取7只、8只、7只,待长大至第32天行Morris水迷宫实验。Morris水迷宫由一个直径120cm、高50cm的圆形水池构成,水池内壁为黑色,水池划分为4个象限,每个象限设置入水点标记,于第4象限内放置直径12cm,高29cm的透明平台,槽内水深30cm,使平台没于水下1cm,水温控制在23~25℃,水池上方安装自动摄像系统。参照文献[1],Morris水迷宫实验包括定位航行实验5d以及空间探索实验1d。将平台所在象限定为目标象限。在5d的定位航行实验中,各组仔鼠每日在规定时间内训练3次,每次间隔1h。将仔鼠分别从除目标象限以外的其余3个象限入水点面向池壁放入水中,第1次入水选择离目标象限最远的象限,第2、3次入水选择目标象限毗邻象限入水。记录120s内寻找到平台的时间(逃避潜伏期),并让仔鼠在平台上停留10s,超过120s未能找到平台者,将其轻柔引导上平台并停留在台上10s,将其寻找平台的时间定为120s,取每天第1次训练的结果为当天的逃避潜伏期;在第6天的空间探索实验中,撤去平台,将仔鼠从最远象限面向池壁放入水中,计数仔鼠在1min内穿越平台原址的次数及穿越目标象限的次数。
1.6 统计学处理 采用SPSS 17.0统计软件,计量资料以示,组间比较用单因素方差分析,若方差齐,两两比较采用LSD检验,若方差不齐,两两比较采用Dunnett’s T3检验。
2 结果
2.1 3组仔鼠脑组织海马CA1区神经元的形态学变化出生后第1天,与C组仔鼠相比,B组仔鼠海马CA1区神经元排列稀疏,细胞间隙增大,有神经元缺失,细胞质内尼氏体数目减少或消失,A组仔鼠海马CA1区神经元排列稍显松散,细胞略肿胀,细胞质着色稍浅,尼氏体数目略有减少,详见图1。出生后第14天,与C组仔鼠相比,B组仔鼠海马CA1区神经元排列整齐,细胞数目较多,细胞质着色深,尼氏体数目大致正常;A组仔鼠海马CA1区神经元排列紊乱,细胞肿胀,染色较浅,细胞质内尼氏体数目减少,详见图2。出生后第21天,与C组仔鼠相比,B组仔鼠海马CA1区神经元排列尚整齐,细胞层数偏少,细胞未见明显肿胀,细胞质着色稍浅,尼氏体数目大致正常;A组仔鼠海马CA1区神经元排列较稀疏,细胞肿胀,细胞质着色浅,尼氏体数目减少,详见图3。
2.2 3组仔鼠逃避潜伏期比较 在定位航行试验中,3组仔鼠在逃避潜伏期比较差异均无统计学意义(均P>0.05),详见表1。

表1 3组仔鼠逃避潜伏期比较(s)
2.3 3组仔鼠穿越目标象限和平台次数比较 在空间探索试验中,3组仔鼠穿越目标象限及平台次数的比较差异均无统计学意义(均P>0.05),详见表2。

表2 3组仔鼠穿越目标象限和平台次数比较
3 讨论
七氟醚是临床常用的吸入麻醉剂。研究表明所有吸入麻醉药均可通过胎盘作用于胎儿,若浓度大,血药浓度高,则会对胎儿产生抑制作用[2]。本研究选择浓度为2.4%(=1MAC)[3]七氟醚吸入6h作用于孕鼠,观察此麻醉浓度是否会对仔鼠造成认知功能的影响。
光镜下尼氏体为嗜碱性斑块或细颗粒,均匀分布于神经元细胞质中。若尼氏体大而数量多,说明神经元合成蛋白质的功能较强,相反,在神经元受到损伤时,尼氏体从核周开始崩解为细尘状颗粒,进而溶解消失,光镜下表现为尼氏体数量会减少甚至消失。在本实验中,在出生后第1天,B组仔鼠海马CA1区神经元损伤程度明显高于A组及C组仔鼠;出生后第14天,B组仔鼠海马CA1区神经元损伤程度较前减轻,A组仔鼠海马CA1区神经元呈现损伤逐渐加重趋势;出生后第21天,与C组仔鼠相比,A组仔鼠海马CA1区神经元仍然呈现严重损伤表现,B组仔鼠损伤程度较轻。该结果提示,孕晚期吸入七氟醚所导致的子代神经损伤可能具有“可逆性”,孕早期吸入七氟醚对子代神经发育可能具有“延迟损伤效应”。

图1 出生后第1天各组仔鼠海马CA1区神经元形态(A:A组仔鼠;B:B组仔鼠;C:C组仔鼠;Nissl染色,×400)

图2 出生后第14天各组仔鼠海马CA1区神经元形态(A:A组仔鼠;B:B组仔鼠;C:C组仔鼠;Nissl染色,×400)
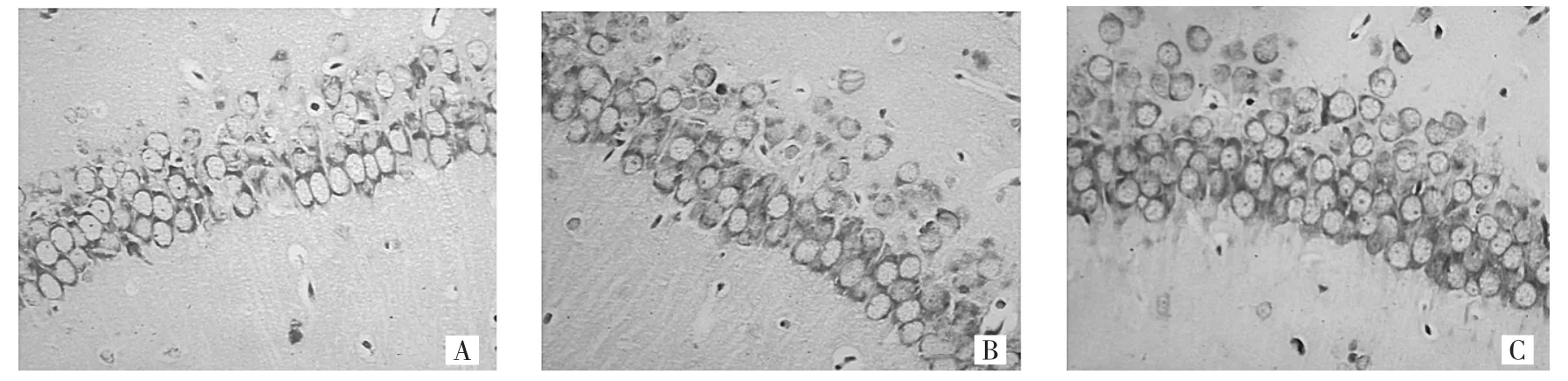
图3 出生后第21天各组仔鼠海马CA1区神经元形态(A:A组仔鼠;B:B组仔鼠;C:C组仔鼠;Nissl染色,×400)
Morris水迷宫实验是评价与海马功能相关的空间参考记忆的主要行为学实验方法之一。Wistar大鼠32天龄相当于人类8岁,为学龄期的起始段,本实验选择在这个时间段进行认知功能测定。定位航行实验的逃避潜伏期可以反映实验动物获取空间信息的能力。随着每天训练次数的增加,实验动物的瞬时记忆得到强化,为更准确地反映其学习记忆能力,排除瞬时记忆对结果的干扰,本实验选择每天的第1次数据结果作为对其前1天学习内容的记忆能力考评依据[1]。空间探索实验反映了实验动物对反复训练所获取信息的储存和再现能力。本实验中,在第1天的定位航行实验中,3组仔鼠首次入水后的逃避潜伏期无明显差异;在第2、3、4、5天的定位航行实验中,与C组仔鼠相比,A、B组仔鼠的逃避潜伏期均无统计学差异,说明3组仔鼠对前1天学习内容的记忆能力无明显差异。在空间探索实验中,3组仔鼠穿越平台次数及穿越目标象限次数无统计学差异,说明孕早、晚期孕鼠吸入2.4%七氟醚6h并不会导致子代在学习记忆能力等行为学表现上出现明显差异。
目前关于七氟醚对神经系统的影响褒贬不一。有研究认为七氟醚对缺血缺氧性脑损伤具有神经保护作用[4-5],另有研究认为七氟醚不会对大脑神经元发育造成影响[6],亦有研究认为七氟醚会对发育期大脑神经元产生毒性影响[7-11],其中部分学者认为这种有害影响仅短期存在,不会持续至远期[9-11],但亦有学者认为这会导致远期认知功能障碍[7]。本实验发现3组仔鼠在出生后32d行水迷宫实验中并未出现学习记忆能力方面的差异,这与李梦圆等[12]的研究结果相符。结合各组仔鼠在出生后不同阶段海马CA1区尼氏体染色结果,考虑可能是神经损伤已经修复,也可能是神经损伤程度较轻并不至于引起行为学上异常表现。
综上所述,孕早期及孕晚期Wistar大鼠母体接受2.4%七氟醚麻醉对子代大脑神经发育的影响随时间变化呈动态改变,并不造成子代远期的学习记忆功能异常。其原因也许是七氟醚对大脑发育影响仅为一过性,或是该影响不足以产生行为学上的学习记忆能力异常,具体机制仍需进一步研究以证实。
[1] 罗小泉,骆利平,陈海芳,等.Morris水迷宫检测大鼠记忆力方法的探讨[J].时珍国医国药,2010,21(10):2667-2669.
[2] 庄心良,曾因明,陈伯銮.现代麻醉学[M].3版.北京:人民卫生出版社, 2004:2608.
[3] Obal D,Preckel B,Scharbatke H,et al.One MAC of sevoflurane provides protection against reperfusion injury in the rat heart in vivo[J].Br J Anaesth,2001,87(6):905-911.
[4] Codaccioni J L,Velly L J,Moubarik C,et al.Sevoflurane preconditioning against focalcerebralischemia:inhibition of apoptosis in the face of transient improvement of neurological outcome[J]. Anesthesiology,2009,110(6):1271-1278.
[5] Luo Y,Ma D,Ieong E,et al.Xenon and sevoflurane protect against brain injury in a neonatalasphyxia model[J].Anesthesiology,2008, 109(5):782-789.
[6] Berns M,Zacharias R,Seeberg L,et al.Effects of sevoflurane on primary neuronalcultures ofembryonic rats[J].Eur J Anaesthesiol, 2009,26(7):597-602.
[7] Fang F,Xue Z,Cang J,et al.Sevoflurane exposure in 7-day-old rats affects neurogenesis,neurodegeneration and neurocognitive function[J].NeurosciBull,2012,28(5):499-508.
[8] Wang Y,Cheng Y,Liu G,et al.Chronic exposure ofgestation rat to sevoflurane impairs offspring brain development[J].Neurol Sci, 2012,33(3):535-544.
[9] LiY,Liu C,Zhao Y,et al.Sevoflurane induces short-term changes in proteins in the cerebral cortices of developing rats[J].Acta AnaesthesiolScand,2013,57(3):380-390.
[10] Feng X,Liu J J,Zhou X,et al.Single sevoflurane exposure decreases neuronal nitric oxide synthase levels in the hippocampus of developing rats[J].British Journal of Anaesthesia,2012, 109(2):225-233.
[11] Liu A,LiY,Tan T,et al.Early exposure to sevoflurane inhibits Ca2+channels activity in hippocampalCA1 pyramidalneurons of developing rats[J].Brain Res,2014,1557:1-11.
[12] 李梦圆,赵为禄,汤洋,等.孕早期七氟醚麻醉对子代大鼠认知功能的影响[J].中华麻醉学杂志,2011,31(12):1431-1433.
Effect of sevoflurane inhalation anesthesia during early and late pregnancy on offspring brain neural development in rats
CHEN Xian,TAO Fan,HUANG Lixia,et al.Department of Anesthesiology,Hangzhou Red Cross Hospital,Hangzhou 310003,China
【 Abstract】 Objective To investigate the effect of sevoflurane inhalation anesthesia during early and late pregnancy on offspring brain neural development in rats. Methods Twelve pregnant Wistar rats were randomly divided into group A(6-day gestation),group B(19-day gestation)and group C(control group)with 4 animals in each group.The rats in groups A and B received 2.4%sevoflurane(0.5L/min)oxygen for 6 h at 6th and 19th day of pregnancy,respectively,while those in control group had no any treatment.The expression of Nissl body in the CA1 region of hippocampus of the offspring at postnatal d1,d14 and d21 were observed with Nissl staining technique.The learning and memory function of the offspring was tested by Morris water maze test at postnatal d32. Results At postnatal d1,the injury in the CA1 region of hippocampus of the offspring in group B was more serious than that in group A and C.At postnatal d14,the neural injury of the offspring in group B was alleviated,but that in group A was worse.At postnatal d 21,the neural injury of the offspring in group B was mild,but that in group A was serious. There were no significant differences in escape latency,explore number in the target quadrant and platform of among the offspring of groups A,B and C(P>0.05). Conclusion The effect of sevoflurane inhalation during early and late pregnancy on offspring brain neural development is time-dependent,but has no significant effect on the learning and memory function.
Sevoflurane Offspring Learning and memory Nissl body Early pregnancy Late pregnancy Rats
2015-01-28)
(本文编辑:严玮雯)
杭州市卫生科技计划项目(2012A044)
310003 杭州市红十字会医院麻醉科
陶凡,E-mail:461226058@qq.com

