淀粉对转移因子胶囊质量控制方法的影响
殷书平,张国柱,卢 勤,杨雅媛(.陕西医药控股集团生物有限公司,汉中 723000;2.汉中市食品药品检验所,汉中723000)
淀粉对转移因子胶囊质量控制方法的影响
殷书平1,张国柱2*,卢 勤1,杨雅媛1(1.陕西医药控股集团生物有限公司,汉中 723000;2.汉中市食品药品检验所,汉中723000)
目的 考查淀粉对转移因子胶囊在251与280nm波长处的吸光度的比值(纯度检查)的影响。方法 选取不同的淀粉并对比2种不同的样品处理方法对测定结果的影响。结果 淀粉的存在确实能使转移因子胶囊在251与280nm波长处的吸光度的比值降低,且造成结果不稳定。结论 测定含淀粉转移因子胶囊的样品时,宜先将样品制成较高质量浓度,滤去不溶或微溶辅料后,稀释至适宜的质量浓度测定,以尽可能减少辅料的干扰。
转移因子胶囊;分光光度法;吸光度比值
转移因子胶囊为免疫调节药,可用于某些抗生素难以控制的病毒性或霉菌性细胞内感染的辅助治疗,也可作为恶性肿瘤的辅助治疗剂[1]。
本品收载于《国家食品药品监督管理局国家药品标准化学药品地方标准上升国家标准第十六册》,系用健康猪或牛脾脏为原料,经去脂肪、细胞破碎、透析或超滤制成的相对分子质量小于6 000道尔顿的多肽、氨基酸和多核苷酸混合物的溶液,经冷冻干燥与淀粉或经制粒的淀粉混匀后装胶囊而成[1]。该药品标准规定其鉴别为:取装量差异项下细粉,加水制成每1mL中含多肽1.5mg的溶液,滤过,滤液用水制成每1mL中含多肽20μg的溶液,照分光光度法测定(即先过滤再稀释),在251±2nm(猪脾)或261± 2nm(牛脾)与280nm波长处吸光度的比值不得低于1.9[1]。笔者在实际工作中发现,大多数的检验人员都是直接取样品,加水制成每1mL中含多肽20μg的溶液,滤过,照分光光度法测定(即先稀释再过滤)。与同行交流时大多数人也认为,后一种方法没有什么问题,且更为简便。但按照后一种方法,某生物有限公司生产的数批转移因子胶囊都存在冻干原粉的251与280nm吸光度的比值(以下简称比值或写为A251/A280)均在1.90以上,且结果稳定,而与淀粉混合后所得混合粉或成品比值有所降低,有的甚至低于1.85而成为不合格品,且重复性差,严重影响了该生物研究所的正常生产。对生产过程进行了解,证实冻干原粉除了与适量淀粉混匀外,未作任何加工。为证实淀粉对其是否存在影响,笔者选取了不同的淀粉并按不同的方法制备了样品进行了考察,发现造成该现象的原因隐蔽,易于疏忽,也容易被实验人员误解,且这类紫外分光光度法测定吸光度比值测不准的现象较为常见,但尚未见文献对其解释。现将分析结果报道如下,与同行商榷,并为此类用分光光度法测定吸光度比值的鉴别实验提供思路及借鉴。
1 仪器与试药
1.1 仪器 美国PE lambda 35型紫外分光光度计;德国赛多利斯CPA225D型电子天平。
1.2 试药 HZ淀粉(批号分别为20110311,20130201,20130315,20130407与AK淀粉(批号分别为130407,130505)均由陕西医药控股集团生物有限公司提供;转移因子冻干原粉(批号分别为130408,130412,130501,130503,130307,130507,130509,130601),转移因子胶囊分别由上述冻干原粉与淀粉或经制粒的淀粉混合装胶囊制成,均由陕西医药控股集团生物有限公司提供;纯化水,汉中市食品药品检验所化学室提供。
2 方法与结果
2.1 方法1 取约相当于多肽3mg的不同批号的冻干原粉加水150mL,制成每1mL中含多肽20μg的溶液,滤过,取续滤液照分光光度法测定;另取由同批原粉制得的胶囊内容物适量,加水150mL,制成每1mL中含多肽20μg的溶液,滤过,取续滤液照分光光度法测定。结果见图1、表1和表2。
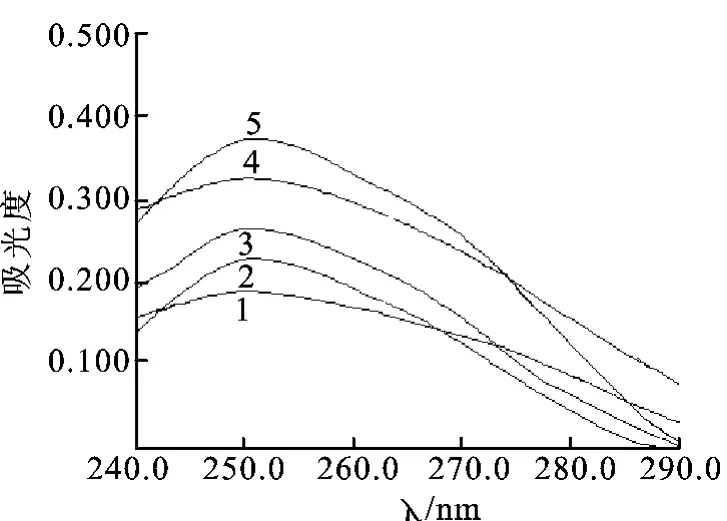
图1 部分样品的典型紫外图谱1.比值低于1.8的样品;2~4.比值约为1.9的样品;5.比值大于2.3的样品Fig.1 Ultraviolet spectra of different samples1.sample of ratio less than 1.8;2-4.sample of ratio around 1.9;5.sample of ratio exceed 2.3

表1 冻干粉的测得结果(方法1)Tab.1 Results of freeze-dried powder(method 1)

表2 胶囊的测得结果(方法1)Tab.2 Results of capsules(method 1)
2.2 方法2 取约相当于多肽30mg的冻干原粉加水20mL,制成每1mL中含多肽1.5mg的溶液,滤过,取续滤液2mL,加水至150mL摇匀,照分光光度法测定,另取由同批原粉制得的胶囊内容物适量,加水20mL,制成每1mL中含多肽1.5mg的溶液,滤过,取续滤液2mL,加水至150mL,摇匀,照分光光度法测定,结果见表3和表4。

表3 冻干粉的测得结果(方法2)Tab.3 Results of freeze-dried powder(method 2)
表4 胶囊的测得结果(方法2)Tab.4 Results of capsules(method 2)
2.3 淀粉对样品测定的影响 取淀粉或经制粒的淀粉约0.3g,加水150mL,振摇,制成悬浊液,放置,取上层清液滤过,取续滤液照分光光度法测定,结果见表5和图2。
表5 不同淀粉的溶液在251和280 nm的吸光度Tab.5 Absorbance of different starches at 251and 280nm
由表1和表2可知,冻干原粉制成胶囊后,用2.1方法制样测定,其在251和280nm的比值相应减小;由表3和表4可以看出,用2.2方法测定,冻干原粉制成胶囊后,其在251和280nm的比值则无明显变化;了解生产过程证实冻干原粉除了与适量淀粉混匀外,未作任何其他加工;且李华等认为转移因子稳定性良好[2];党昶永等认为转移因子热稳定性好[3];充分说明,淀粉是影响其比值变化的关键因素。
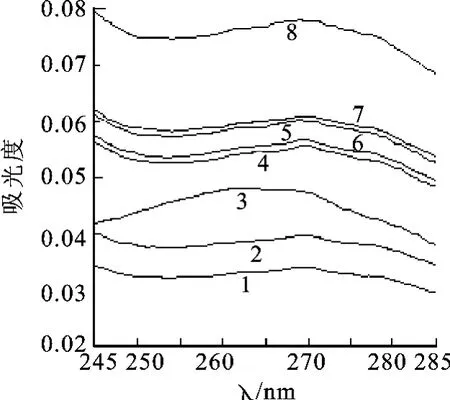
图2 不同淀粉的紫外吸收图谱1.AK淀粉130407;2.AK淀粉130505;3.AK淀粉130505制粒;4.HZ淀粉20130315;5.HZ淀粉20130201;6.HZ淀粉20130315制粒;7.HZ淀粉20130201制粒;8.HZ淀粉20110311Fig.2 Ultraviolet spectra of different starches1.AK starch 130407;2.AK starch 130505;3.AK starch 130505 granulated;4.HZ starch 20130315;5.HZ starch 20130201;6.HZ starch 20130315granulated;7.HZ starch 20130201granulated;8.Hz starch 20110311
淀粉不溶于冷水[4],但对表3数据及图谱3进行观察,发现不同的淀粉在200~300nm之间均有不同程度的紫外吸收,吸光度大约为0.03~0.08,吸收曲线几乎为一条直线,在251和280nm均无吸收峰值,其在251和280nm的吸光度基本相同。这是多数实验人员认为淀粉对实验结果没有影响、可以按2.1的制样方法直接将胶囊内容物稀释成每1mL中含多肽20μg的溶液测定的依据。
淀粉对转移因子紫外吸收曲线的形状无影响,但对其吸收值有影响,通常每1mL中含多肽20μg的转移因子溶液,在251nm的吸光度A约为0.3,当比值为1.9时,280nm的吸光度则应为0.157 9,假设溶液中淀粉的吸光度分别为0.03,0.04,0.05,0.06,0.07和0.08,按2.1方法制备的转移因子胶囊的溶液的紫外吸收图谱中,均含有0.03~0.08的淀粉的吸收,则样品的理论吸光度及其在251和280nm的吸光度比值应如表6所示。
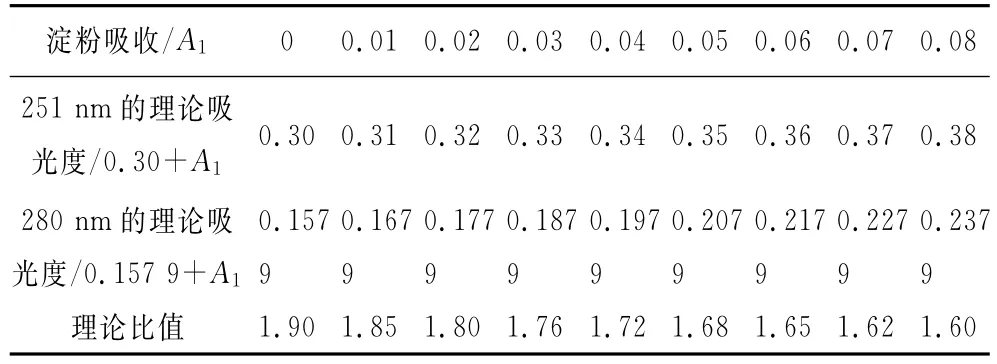
表6 淀粉的吸收对样品吸光度比值的影响Tab.6The influence of starch on the absorbance ratio
由表6可知,淀粉的存在的确能使吸光度比值降低,而且淀粉水溶液本身的吸光度越大,比值降低越严重。我们曾做过转移因子质量浓度与比值的关系的考察,将同一批转移因子胶囊按2.1方法分别制成每1mL中含多肽80,60,40,20,10及5μg的溶液,测定其在251和280nm波长处吸光度的比值,发现质量浓度越大,比值越高,其原因是淀粉在水中的溶解度虽然极其微小,吸光度只有0.03~0.08,但随着转移因子质量浓度的增加和吸光度的相应增加,淀粉产生的吸收对比值的影响就会越来越小,这一点在数学上能够简单地证明。这同时解释了同一样品多次测定得不到稳定的比值的原因。
结合表1和表2数据发现,转移因子冻干原粉按2.1制样和按2.2制样测定,其比值无明显变化,是因为冻干原粉中不含淀粉,没有淀粉的影响,按2.1制样和按2.2制样均可。这也进一步证实了淀粉是影响比值的主要因素。
3 讨论
转移因子不止一种物质,它含有多种游离氨基酸、多肽、多核苷酸、多种碱基及核酸降解产物、前列腺素、叶酸、组织胺等[5]。蛋白质、多肽因为其结构中含有丝氨酸、酪氨酸残基等共轭体系,在280nm波长处有最大吸收[6];而多核苷酸则因含有嘌呤、嘧啶等共轭系统在260nm波长附近对紫外光有较强吸收,而不同的碱基其最大吸收波长不同[6]。因此一般认为,251nm的吸收(猪脾)主要与转移因子中多核苷酸的量有关,而280nm的吸收则主要与样品中蛋白质、多肽、游离氨基酸等的量有关。251和280nm吸光度的比值理论上与产品中核酸和多肽这两类物质的量的相对量有相关性。转移因子中的蛋白质越少越好,比值则可以反映转移因子的纯度,比值应该越大越好,如宋愿智等认为紫外分光光度法测定的是多肽和核酸两者之间的比值[7]。生产中发现,部分样品比值可以达到2.3,如图1中的5;也有的样品比值达不到1.8,如图1中的1;而对于图1中类似2,3,4一类的样品,则需按照2.2中的方法准确测定其吸光度的比值,否则可能将合格药品判为不合格药品;如果生产出的冻干原粉比值达不到1.9,则应从生产中找原因,提高生产工艺进而提高药物的质量。
在实验过程中,251nm的吸收取的是转移因子样品紫外光谱的最大吸收峰值,而其在280nm无最大吸收峰值(图1)。因此280nm的吸收是一个固定波长处的吸收,考虑到仪器误差可能带来的影响,实验前应对仪器进行校准,以免产生较大的误差。
本文只考察了淀粉对转移因子胶囊鉴别的影响,但其他药物成分或辅料对这种通过吸光度比值进行鉴别的实验方法也可能造成类似的影响。希望本文为此类方法提供思路及借鉴。
4 结论
综上所述,要得到正确的实验结果,应该按照方法2.2制备样品溶液,即取约相当于多肽30mg的冻干原粉或取胶囊10粒,倾出内容物,加水20mL,制成每1mL中约含多肽1.5mg的溶液,滤过,取续滤液2mL,加水至150mL,摇匀,照分光光度法测定。将淀粉滤除后再稀释滤液,这样就将淀粉在水中的质量浓度稀释约75倍,淀粉产生0.03~0.08的吸收理论上变成0.000 4~0.001,这样的吸收对比值的影响可以忽略不计。而按1.1的制样方法直接将胶囊内容物稀释成每1mL中含多肽20μg的溶液测定的做法是不妥当的,是造成从冻干原粉到成品后251和280nm吸光度比值降低的主要原因。
[1] 国家药典委员会.国家药品标准:第十六册[S].2003:103-111.
[2] 李华,谢忠平,柯华昕,等.转移因子的稳定性考查[J].中国药业,2006,15(2):39.
[3] 党昶永,程建杰,殷书平,等.转移因子耐热性的研究[J].中国药师,2011,14(9):1363-1364.
[4] 国家药典委员会.中国药典2010年版[S].二部.北京:中国医药科技出版社,2010:1228.
[5] 宋愿智,蔡晓民,崔玉绵,等.转移因子质量标准异同浅析[J].西北药学杂志,2000,15(5):219-220.
[6] 查锡良.生物化学[M].7版.北京:人民卫生出版社,2008:11-60.
Influence of starch on the quality control method of Transfer Factor Capsules
YIN Shuping1,ZHANG Guozhu2*,LU Qin1,YANG Yayuan1(1.Shaanxi Pharmaceutical Holding Group Biological Products Limited Company,Hanzhong 723000,China;2.Hanzhong Institute for Food and Drug Control,Hanzhong 723000,China)
Objective To examine the starch′s influence on the UV absorbance ratio at 251and 280nm of Transfer Factor Capsules.Methods Different amount of starches were added and the influence was observed.Results Starch can influence the determination of absorbance ratio,causing the ratio unstable.Conclusion In the determination of absorbance ratio,when samples contained starch and other accessories,filtration is necessary to reduce the interference of accessories.
Transfer Factor Capsules;spectrophotometric method;absorbance ratio
2,ebook=35
10.3969/j.issn.1004-2407.2015.02.011
R917
A
1004-2407(2015)02-0141-04
2014-07-20)
殷书平,男,副主任药师
*通信作者:张国柱,男,副主任药师

