溶胶-凝胶法合成Li1.016Cr0.103Mn0.464Ni0.356O2
李艳艳,朱令之,韩恩山,马淑倩
(河北工业大学化工学院,天津 300130)
由 Li2MnO3和 LiMO2(M=Ni、Mn、Co、Cr等 Fe)形成复合结构组成的固溶体正极材料,具有比容量高、工作电压高、比能量高、充放电电压范围较宽、热稳定性良好及价格低廉等优点[1-2]。Li1.2Cr0.4Mn0.4O2的容量高、循环性能稳定,在循环过程中,Cr的价态在+3~+6可逆变化,而Mn保持在+4。C.W.Park 等[3]采用溶胶-凝胶法合成 LiCrxLi(1-x)/3Mn2(1-x)/3O2,并进行淬火处理,当x=0.328时,产物以0.05 C在2.8~3.5 V循环,首次放电比容量为 250 mAh/g。K.S.Kim等[4]报道的 LiCrO2-LiMnO2-Li2MnO3固溶体材料,以0.1 C在2.5~4.5 V,首次放电比容量为204 mAh/g。
溶胶-凝胶法合成固溶体正极材料时,反应温度主要影响水解与成胶的速度,进而影响颗粒的尺寸和分散度[5]。
本文作者用溶胶-凝胶法合成Li1.016Cr0.103Mn0.464Ni0.356O2(LiCrO2-LiMn0.5Ni0.5O2-Li2MnO3固溶体),并考察反应温度对产物的结构、形貌和电化学性能的影响。
1 实验
1.1 Li1.016Cr0.103Mn0.464Ni0.356O2的合成及分析
将按化学计量比配料的 LiAc·2H2O(天津产,AR)、Mn(Ac)2·4H2O(天津产,AR)、Ni(Ac)2·4H2O(天津产,AR)、Cr(NO3)3·9H2O(天津产,AR)和柠檬酸(天津产,AR)溶于少量的去离子水中,另取与总金属离子等物质的量的柠檬酸,溶于少量去离子水中,边搅拌,边将柠檬酸溶液缓慢滴入金属溶液中,用NH3·H2O(天津产,AR)调节pH值至7左右。分别在55℃、75℃、85℃和100℃下,将溶液水浴蒸干成湿凝胶,再将湿凝胶在120℃下真空(133 Pa)干燥12 h,成为干凝胶。干凝胶充分研磨后,在马弗炉中、400℃下预烧4 h,冷却后取出。进一步充分研磨,再在马弗炉中、800℃下煅烧12 h,自然冷却后,研磨成粉末。合成出的样品用去离子水搅拌、洗涤,除去Li2CrO4,在110℃下干燥10 h,备用。
用D8 Focus型X射线衍射仪(德国产)进行XRD分析,CuKα,管压 40 kV、管流40 mA,扫描速度为 6(°)/min,步长为0.02°;用Prodigy型电感耦合等离子体(ICP)发射光谱仪(美国产)进行ICP分析;用Nano SEM 450型扫描电子显微镜(美国产)进行SEM分析。
1.2 电池的组装与电化学性能测试
将活性正极材料、乙炔黑(焦作产,AR)与聚偏氟乙烯(日本产,AR)按质量比8∶1∶1混合均匀后,加入适量的 N-甲基吡咯烷酮(天津产,AR)调浆,均匀涂覆在16 μm厚的铝箔(广东产,AR)上,在110℃下干燥3 h,最后冲成直径为8 mm的圆片(约含4 mg活性物质)。
在模拟电池底座内依次放入金属锂片(河北产,99.5%)、Celgard 2400膜(日本产)和正极片,注入1 mol/L LiPF6/EC+DMC+EMC(体积比1∶1∶1,韩国产,电池级),在手套箱(RH<4%)中组装电池(半径15 mm、高20 mm)。
用CHI 660C电化学工作站(上海产)进行循环伏安和交流阻抗测试。循环伏安测试的扫描速度为0.1 mV/s,电压为2.5~4.9 V;交流阻抗测试的频率范围为10-2~104Hz,交流振幅为5 mV。用CT2001A电池测试系统(武汉产)进行恒流充放电测试,电压为2.0~4.8 V,电流为0.1~1.0 C。
2 结果与讨论
2.1 样品的结构分析
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的XRD图见图1。
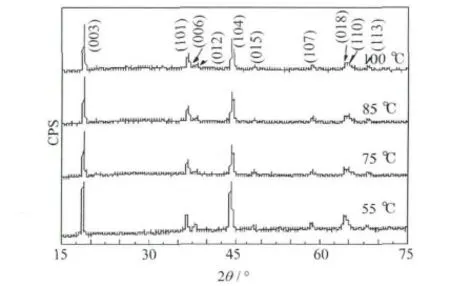
图1 在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的XRD图Fig.1 XRD patterns of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
从图1可知,样品经过水洗处理后,没有Li2CrO4的杂峰[2],均为典型的 α-NaFeO2结构,属R3m空间群。在20°~25°出现的较弱衍射峰,是Li[Li1/3Mn2/3]O2的超晶格结构引起的。在(006)/(012)与(018)/(110)处均有明显的分裂峰,说明样品具有良好的层状结构[6]。Li原子占据3a位,Ni、Cr和Mn交替逐层占据3b位,氧原子占据6c位。Li+的半径(0.076 nm)与Ni2+的半径(0.069 nm)相近,容易在3a和3b位之间造成阳离子混排,而(003)处的衍射峰是由Li引起的,(104)处的衍射峰是由过渡金属和氧原子引起的。(003)峰强度 I(003)与(104)峰强度 I(104)之比 I(003)/I(104),是描述阳离子混排的一个重要参数[7]。当I(003)/I(104)<1.2时,阳离子混排程度较高。当晶胞参数c/a大于理想立方密堆积结构的c/a值4.9时,说明样品具有较完整的层状结构[7]。
表1是由Jade软件分析得到的各样品的晶胞参数和I(003)/I(104)。

表1 不同温度下合成Li1.016Cr0.103Mn0.464Ni0.356O2的晶胞参数和I(003)/I(104)Table 1 Lattice parameters and I(003)/I(104)of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
从表1可知,各样品的c/a均在4.95以上,表明均具有较完整的层状结构。85℃合成样品的I(003)/I(104)最大,说明阳离子混排程度最小。
2.2 组成分析
C.W.Park 等[3]在研究 LiCrxLi(1-x)/3Mn2(1-x)/3O2系列化合物时,发现在空气中煅烧很难合成出目标产物,因为在高温下会使部分Cr3+氧化为Cr6+,生成Li2CrO4,但水洗处理可除去Li2CrO4。对水洗处理前后的85℃合成样品进行ICP测定,确定水洗处理对元素含量的影响,结果见表2。
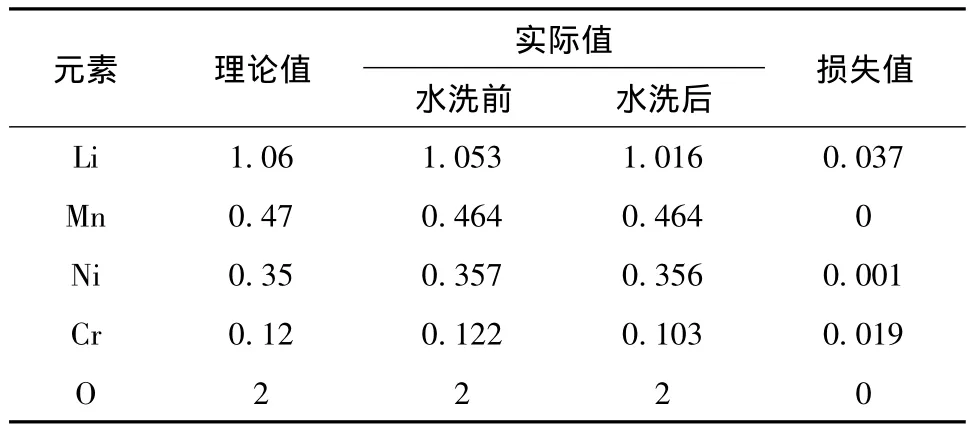
表2 水洗处理前后的85℃合成样品的ICP检测结果Table 2 Inductively coupled plasma(ICP)determination results of sample synthesized at 85℃before and after water treatment
从表2可知,水洗处理后损失最明显的元素是Cr和Li,Mn和Ni几乎没有损失。计算发现,Li元素经水洗处理流失的物质的量,约是Cr元素的两倍。
2.3 样品的形貌分析
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的SEM图见图2。

图2 在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的SEM图Fig.2 SEM photographs of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
从图2可知,在不同温度下合成的样品,颗粒大小、分散度均不相同。在55℃和75℃下合成的样品,颗粒过小,且团聚较严重,会导致Li+扩散阻力增大,影响材料的放电比容量和循环性能。在100℃下合成的样品,尺寸不均匀,原因是当温度过高时,溶液中的水解反应速率过快,且导致挥发组分的挥发速度提高,分子聚合反应也加快,成胶的时间缩短很多,由于缩聚产物碰撞过于频繁,形成的溶胶不稳定,合成的颗粒尺寸变大且分布范围会增加,同时,金属离子水解不够充分,过快的聚合可能会降低离子混合的均匀性[8]。在85℃下合成的样品,粒径均一,约为150 nm,颗粒的分散度好,为良好的倍率和循环性能提供了保证。
2.4 样品电化学性能测试
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的首次充放电曲线见图3。

图3 在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的首次充放电曲线Fig.3 Initial charge-discharge curves of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
从图3可知,在55℃、75℃、85℃和100℃下合成的样品以0.1 C充放电,首次放电比容量分别为158 mAh/g、187 mAh/g、190 mAh/g和184 mAh/g。随着温度的升高,比容量先增大、后减小,在85℃下合成的样品,放电比容量最高。
在85℃下合成的样品的充放电曲线见图4。

图4 在85℃下合成的样品的充放电曲线Fig.4 Charge-discharge curves of sample synthesized at 85℃
从图4可知,随着电压的提高,首次充放电过程中,在高于4.5 V出现了不可逆的平台,随着循环次数的增加,该平台消失。对于首次充电反应的机理,大部分人认为不可逆的平台是当充电电压高于4.5 V时,Li2MnO3组分得到活化,锂层和过渡金属层中的Li+一起脱出,并伴随氧的释放而形成层状的MnO2,在放电过程中,由于体相晶格中O2-脱出的空位被过渡金属离子占据,导致脱出的Li+不能全部回嵌至体相晶格中,产生首次不可逆容量损失形成的[9]。当充电电压未达到4.5 V时,Li+的脱嵌伴随有Ni2+/Ni4+之间的氧化还原。
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的倍率性能见图5。

图5 在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的倍率性能Fig.5 Rate capability of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
从图5可知,在85℃下合成的样品,倍率性能和循环性能最好,0.5 C和1.0 C放电比容量分别为110 mAh/g和95 mAh/g,以0.5 C和1.0 C循环20次,容量保持率分别为90%和88%。这是因为:在85℃下合成的样品具有良好的层状结构,阳离子混排程度最小;同时,颗粒尺寸均一,分散度好。
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的交流阻抗谱见图6。
图6中的曲线由两部分组成:高频区的半圆弧,反映的是Li+通过表面膜层的迁移电阻和表面膜层的电容,即电极表面形成的固体电解质相界面(SEI)膜所表现的阻抗;低频区的斜线,反映的是Li+在固体电极材料中的扩散能力,即Warburg阻抗(Zw)。对图6进行分析拟合[10],计算电荷转移电阻(Rct)和Li+扩散系数(DLi+),能更好地说明材料的电化学性能,其中DLi+主要影响库仑效率、放电容量和倍率性能。计算可得:在55℃、75℃、85℃和100℃下合成的样品,DLi+分别为 1.458 7 × 10-19cm2/s、1.928 0 × 10-19cm2/s、2.736 4 ×10-19cm2/s和 7.762 5 ×10-20cm2/s,Rct分别为690.4 Ω、642.7 Ω、557.9 Ω 和 815.4 Ω。在 85 ℃ 下合成的样品,Rct最小,DLi+最大,说明该样品的库仑效率和放电容量最高,倍率性能最好,与电化学测试的结果一致。
在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的循环伏安曲线见图7。
从图7可知,在3 V附近没有氧化还原峰,说明材料中不存在Mn3+,Mn以非电化学活性的+4价存在,不会发生氧化还原反应,只起到支撑结构的作用。在3.7 V/4.0 V附近的氧化还原峰对应Ni2+/Ni4+的氧化还原反应;在4.6 V附近的一个小氧化峰,可能是氧的不可逆脱出形成的。在85℃下合成的样品,氧化峰和还原峰最尖锐,电位差最小,表明极化最轻,电化学转化过程更容易进行,因此该样品应该具有较好的电化学性能。

图7 在不同温度下合成的Li1.016Cr0.103Mn0.464Ni0.356O2的循环伏安曲线Fig.7 CV curves of Li1.016Cr0.103Mn0.464Ni0.356O2synthesized at different temperatures
3 结论
用溶胶-凝胶法合成了Li1.016Cr0.103Mn0.464Ni0.356O2。结合XRD、SEM及电化学分析可知:Li1.016Cr0.103Mn0.464Ni0.356O2具有良好的层状结构;温度对材料颗粒的大小、分散度均有影响。在85℃下合成的样品,颗粒尺寸均一,约为150 nm,电化学性能最好。以0.1 C在2.0~4.8 V充放电,首次放电比容量达190 mAh/g;1.0 C最高放电比容量约为95 mAh/g,循环20次的容量保持率为88%。
[1]MENG Hai-xing(孟海星),XU Qiang(徐强),JIN Hui-fen(金慧芬),et al.不同温度下烧结制备 Li[Li0.17Ni0.17Co0.10Mn0.56]O2[J].Battery Bimonthly(电池),2014,44(1):18 -20.
[2]Park C W,Kim S H,Mangani I R,et al.Synthesis and materials characterization of Li2MnO3-LiCrO2system nanocomposite electrode materials[J].Mater Res Bull,2007,42(7):1 374 - 1 383.
[3]Park C W,Kim S H,Nahm K S,et al.Structural and electrochemical study of Li[CrxLi(1-x)/3Mn2(1-x)/3]O2(0 ≤ x≤0.328)cathode materials[J].J Alloy Compd,2008,449(1 - 2):343 -348.
[4]Kim K S,Lee S W,Moon H S,et al.Electrochemical properties of Li-Cr-Mn-O cathode materials for lithium secondary batteries[J].J Power Sources,2004,129(2):319 -323.
[5]ZHANG Jian-hong(张健泓),CHEN You-sheng(陈优生).溶胶-凝胶法的应用研究[J].Guangdong Chemical Industry(广东化工),2008,35(3):47 -48.
[6]Singh G,Thomas R,Kumar A,et al.Electrochemical and structural investigations on ZnO treated 0.5 Li2MnO3·0.5LiMn0.5Ni0.5O2layered composite cathode material for lithium ion battery[J].J Electrochem Soc,2012,159(4):A470 - A478.
[7]Yu C,Li G S,Guan X F.Composites Li1+xMn0.5+0.5xNi0.5-0.5xO2(0.1≤x≤0.4):optimized preparation to yield an excellent cycling performance as cathode for lithium-ion batteries[J].Electrochim Acta,2012,61:216 -224.
[8]YU Gui-yu(余桂郁),YANG Nan-ru(杨南如).溶胶-凝胶法简介[J].Bulletin of the Chinese Ceramic Society(硅酸盐通报),1993,6(6):61 -63.
[9]ZHAO Xue-ling(赵雪玲),TANG Dao-ping(唐道平),MAI Yongjin(麦永津).溶胶凝胶法合成富锂正极材料Li[Li0.2Ni0.2Mn0.6]O2及性能表征[J].Journal of Inorganic Chemistry(无机化学学报),2013,29(5):1 013 -1 014.
[10]Lin J,Mu D B,Jin Y,et al.Li-rich layered composite Li[Li0.2Ni0.2Mn0.6]O2synthesized by a novel approach as cathode material for lithium ion battery[J].J Power Sources,2013,230:76-80.

