细胞外基质对哮喘模型大鼠气道平滑肌细胞免疫调节作用
陈忠仁 梁梅兰
支气管哮喘是一种气道慢性炎症疾病,由多种细胞和细胞组分参与。作为维持气道结构和功能重要成分的气道平滑肌细胞(airway smooth muscle cell,ASMCs)和细胞外基质(extracellular matrix,ECM),在哮喘的疾病发生、发展 中 起了重要的作用[1,2]。ASMCs 在炎性反应中作用比较活跃,能够分泌多种炎性介质,产生一系列细胞因子,表达免疫细胞的黏附分子以及包括Fas 在内的一些细胞表面分子标志物,ASMCs 所分泌的这些因子能够促进ASMCs 自身的增殖[3~5]。ASMCs 还能够产生细胞外基质、基质金属蛋白酶和相关的抑制剂,促进有丝分裂的发生,是引起支气管哮喘气道狭窄的重要病理因素,如Ⅰ型胶原(type Ⅰcollagen,COL -1)、层黏蛋白(laminin,LA)等有显著增加,两者可相互影响。为了探讨这一问题,本实验将大鼠ASMCs 种植于用涂覆有ECM 的培养瓶中,采用Western blot 法检测哮喘ASMCs eotaxin、TGF-β1 蛋白的表达,探讨ECM 对哮喘大鼠ASMCs 免疫功能的调节作用。
材料与方法
1.材料:健康Wistar 雄性大鼠。卵清蛋白(ovalbumin,OVA)﹑COL-1、LA、胎牛血清(fetus bovine serum,FBS)、木瓜蛋白酶﹑Ⅰ型胶原酶﹑牛血清白蛋白(bovine serum albumin,BSA)购于美国Sigma 公司。小鼠抗肌动蛋白(α -actin)和Trizol 溶液购自美国GIBCO 公司。单去污剂裂解液、0.01mol/L PBS (pH7.3)、10%分离胶、4%浓缩胶、0.15mol/L NaCl 溶液、2 ×(5 ×)SDS 上样缓冲液、电泳缓冲液、转移缓冲液、10 ×丽春红染液、封闭液、TBST、TBS、洗脱抗体缓冲液、抗体、化学发光试剂。
2.大鼠哮喘模型的建立及分组:(1)哮喘模型的建立:参照文献[7]中的方法,在大鼠后腿内侧皮下注射1ml 体积的0.9%生理盐水混合液(含有10mg 的OVA 以及200mg 的氢氧化铝);注射后第8 天重复上述步骤;注射第15 天玻璃容器中进行含有2%OVA 生理盐水的喷雾试验,对大鼠进行喷雾处理,每次喷雾量控制在50ml,每周喷雾3 次,每次30min,共进行15 天。当大鼠出现躁狂、呛咳、呼吸急促症状时,即哮喘模型制备成功。(2)大鼠分组:16 只大鼠随机分为两组,每组8只。哮喘组,利用OVA 制备模型;对照组,生理盐水替代OVA。
3.大鼠气道平滑肌细胞(ASMCs)的培养、鉴定和分组:(1)大鼠ASMCs 的培养:根据文献[8]报道的方法分离大鼠肺叶支气管的ASMCs。在OVA 或生理盐水激发2 周后,在第24h 进行麻醉取材。取肺后移入超净台,置于冰盒上。倒入已加双抗的D-HANKS 液,清洗肺部。清洗后的肺组织切成1~2mm 的组织块,将其置于消化液(含1mg/mlⅠ型胶原酶、1mg/ml 木瓜蛋白酶、10mg/mlBSA 的D -HANKS 液)中,37℃消化15min。消化完毕后,加入无血清的DMEM 培养基,980r/min,离心10min。弃上清,加入约1ml 含20%FBS 的DMEM。移入细胞瓶中,37℃、5%CO2孵箱培养,每隔3 天换液1 次,大约1 周时间,当细胞长满单层后,胰酶消化传代培养。实验所用的细胞培养至第2 ~5 代。ASMCs 的鉴定主要在显微镜观察细胞形态,并通过α-actin 进行细胞免疫荧光染色。
4.培养瓶的处理:根据参考文献[9]报道的方法,取无菌细胞培养瓶(50ml),将同一浓度的COL -1 以及LA(10μg/ml)加入细胞瓶中,加入的体积覆盖瓶底即可,摇匀后放于37℃孵箱过夜培养。取出后无菌条件下加入0.1%的BSA 封闭,室温作用30min,弃掉液体,无血清DMEM 培养液清洗瓶底,吸干液体,再自然风干,可直接使用,或封好瓶口待用。
5.ASMCs 分组:分离培养得到两组大鼠的ASMCs,随机分为3 组。①空白组:细胞正常培养;②COL-1 组:将ASMCs传代接种在包被有COL -1(10μg/ml)的细胞瓶中;③LA 组:将ASMCs 传代接种在包被有LA(10μg/ml)的细胞瓶中。每组各3 瓶。
6. Western blot 法检测ASMCs 中eotaxin、TGF -β1 蛋白的表达:参照Santa Cruz 公司提供的蛋白提取方法,应用蛋白裂解缓冲液分别裂解细胞得到总蛋白。以牛血清蛋白作为标准品,绘制标准曲线,计算提取液的蛋白浓度。取总蛋白50μg,10%聚丙烯酰胺凝胶电泳进行蛋白分离,转膜、封闭,一抗的工作浓度1∶500,β -actin 作为内参照,封闭孵育二抗,工作浓度1∶1000。用ECL 化学发光试剂盒检测杂交信号。
7.统计学方法:采用SPSS 10.0 统计软件,实验数据均用均数±标准差(±s)表示,进行方差分析和q 检验,P <0.05为差异有统计学意义。
结 果
1.大鼠ASMCs 鉴定:如图1 所示,通过细胞形态及免疫荧光染色显示,分离得到的细胞形态长梭型,与平滑肌细胞形态形似,并且α -actin 的表达为阳性,可以判定培养的细胞为大鼠平滑肌细胞。

图1 气道平滑肌细胞α-actin DAB 染色阳性(SP,×400)
2.Western blot 法检测eotaxin、TGF -β1 蛋白的表达:如图2、图3 所示,通过分析每组条带的灰度值,对蛋白含量进行计算比较。从表1、图2、图3 中可看出,eotaxin、TGF-β1 蛋白在各组皆有表达,并且表达量各有不同:在哮喘模型组当中,哮喘干预组显著高于空白组,空白组含量显著高于正常对照组(P<0.05);在正常对照组中,表达差异无统计学意义(P >0.05)。
表1 大鼠气道平滑肌细胞eotaxin、TGF-β1 的表达含量(±s)
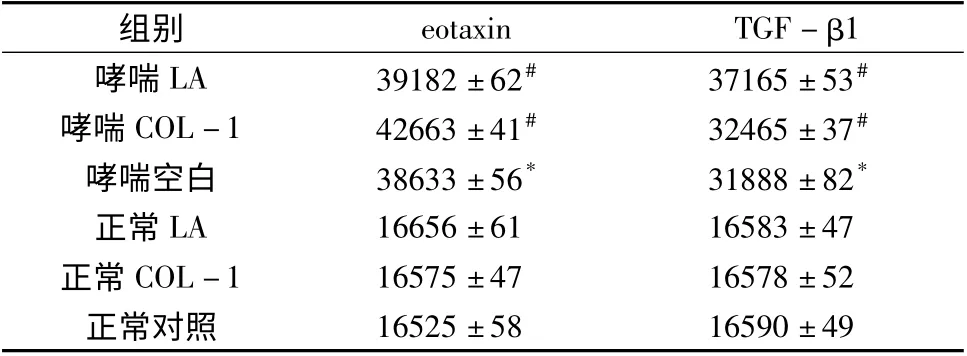
表1 大鼠气道平滑肌细胞eotaxin、TGF-β1 的表达含量(±s)
与哮喘空白组相比,#P <0.05;与正常对照组相比,* P <0.05
组别 eotaxin TGF-β1哮喘LA 39182 ±62# 37165 ±53#哮喘COL-1 42663 ±41# 32465 ±37#哮喘空白 38633 ±56* 31888 ±82*正常LA 16656 ±61 16583 ±47正常COL-1 16575 ±47 16578 ±52正常对照16525 ±58 16590 ±49

图2 eotaxin 蛋白电泳图

图3 TGF-β1 蛋白电泳图
讨 论
支气管哮喘是一种气道慢性非特异性炎症疾病,但随着疾病的进展,可出现气道重塑,这与ASMCs 的功能状况密切相关。ASMCs 是炎性因子的作用靶点,同时也可分泌多种细胞因子和免疫活性蛋白[10]。气道平滑肌细胞有两种表型:①以收缩功能为主的收缩型;②能合成、分泌及表达多种活性物质的合成型[11]。合成型气道平滑肌细胞可以旁分泌、自分泌等方式分泌多种活性物质参与支气管哮喘的病理、生理过程,启动和维持哮喘气道高反应,引起慢性炎症和气道重塑。以往观点认为,ASMCs 在哮喘发病过程中,在神经源性信号和炎性介质调控下,参与气管收缩和舒张的过程。随着不断地深入研究发现,ASMCs 不仅可以调节支气管的收缩和舒张,而且可分泌及表达多种免疫调节介质,参与气道慢性炎症和气道重塑的发生和发展。近年来发现ASMCs 有新的生物学功能,如向黏膜层迁移使平滑肌层增厚、合成及炎症网络调节功能及动力学异常等。ASMCs 与ECM 由于其组织结构特点,在哮喘的发生、发展过程中存在着紧密联系,它们相互作用,发挥其功能特点,以减少对支气管的不利影响。ASMCs 可分泌多种基质蛋白,减缓ECM 的降解,加速气道重建。受影响的ECM 又可调控ASMCs 的生存、增殖和迁移等生物学行为。研究表明,哮喘ASMCs 可分泌蛋白多糖、Ñ 型胶原、硫酸软骨素,使ECM 含量增加,这种作用不能被激素所抑制,并可分泌TIMP -1 和TIMP -2,抑制ECM 降解[12~14,15]。不同种类和数量的ECM 可影响ASMCs 的迁移速度、增殖效率、生存时间和上调平滑肌细胞的分泌功能,如FN 呈剂量依赖性促进ASMCs的增殖,种植于COL -1 和LA 的ASMCs 凋亡率下降[16]。目前还没有研究发现ECM 在ASMCs 免疫反应方面是否具有调节作用,以及怎样参与信号通路的转导。
在笔者的实验研究中,将eotaxin 及TGF -β1 作为探讨ASMCs 免疫功能的重要因素。嗜酸性粒细胞趋化因子(eotaxin)最早是在嗜酸性粒细胞浸润的支气管肺泡灌洗液中发现的,在人的多种组织中都能够检测到eotaxin mRNA 的表达,可由不同来源的细胞产生[17]。支气管哮喘的典型病理特征即嗜酸性粒细胞广泛浸润,而eotaxin 对嗜酸性粒细胞具有趋化作用,使其靶向迁移至炎性反应部位,加剧哮喘的炎性反应。同时,研究表明,eotaxin 也会影响ASMCs 在炎性反应时的迁移方向[18]。TGF -β 生物学主要功能与炎性反应相关,是一些炎性细胞的趋化剂,可由肺部多种免疫相关的细胞分泌;同时可以促进ECM 的表达并抑制其分解,对平滑肌细胞的增殖具有显著作用,并通过多种通路调控哮喘的疾病过程,气道平滑肌细胞可以分泌TGF -β[19,20]。基于这两种蛋白在免疫调节方面的功能,笔者将其作为研究ASMCs 的重要指标。
总之,本实验结果显示,ECM 对ASMCs 中eotaxin,TGF-β1 的表达有正调控作用,对哮喘气道平滑肌细胞的作用更为显著,这为今后防治哮喘提供了一个新的思路和方法。但ECM 通过何种途径调节哮喘ASMCs 的免疫功能还不是很清楚,这需要进行进一步研究。
1 Bhattacharya R,Gonzalez AM,Debiase PJ,et al.Recruitment of vimentin to the cell surface by beta 3 integrin and plectin mediates adhesion strength[J].Cell Sci,2009,122(9):1390 -1400
2 Yamauchi K,Noue H. Airway remodeling in asthma and irreversible airflow limitation ECM deposition in airway and possible therapy for remodeling[J].Allergol Int,2007,56(4):321 -329
3 Hmamid Q,Tulic MK. Nwe insights into the pathophysiology of the small airways in asthma[J].Ann Thorac Med,2007,2(1):28 -33
4 Chan V,Burgess JK,Ratoff JC,et al.Extracellular matrix regulates enhanced eotaxin expression in asthmatic airway smooth muscle cells[J].Am J Respir Crit Care Med,2006,174(4):379 -385
5 Woodruff PG.Gene expression in asthmatic airway smooth muscle[J].Proc Am Thorac Soc,2008,5(1):113 -118
6 Halwani R,Al - Muhwen S,Hamid Q. Airway remodeling in asthma[J].Curr Opin Pharmacol,2010,10(3):236 -245
7 Laura P,Chiara T,James GM,et al. Airway remodeling in allergen -challenged Brown Norway rats:distribution of proteoglycans[J].Am J Physiol Lung Cell Mol Physiol,2006,290(1):1052 -1058
8 Hirst SJ. Airway smooth muscle cell culture:application to studies of airway wall remodeling and phenotype plasticity in asthma[J]. Eur Respir J,1996,9(4):808 -820
9 Vivien C,Janette KB,Jonathan CR,et al.Extracellular matrix regulates enhanced eotaxin expression in asthmatic airway smooth muscle cells[J].Am J Respir Crit Care Med,2006,174(4):379 -385
10 Ito I,Fixman ED,Asai K,et al. Platelet - derived growth factor and transforming growth factor - beta modulate the expression of matrix metalloproteinases and migratory function of human airway smooth muscle cells[J]. Clinical and Experimental Allergy,2009,39(9):1370 -1380
11 Tliba O,Panettieri RA Jr. Noncontractilefunctions of airway smooth muscle cells in asthma[J].Annu Rev Physio1,2009,71(10):509 -535
12 Halayko AJ,Tran T,Gosens R. Phenotype and functional plasticity of airway smooth muscle:role of caveolae and caveolins[J]. Proc Am Thorac Soc,2008,5(1):80 -88
13 Damers G,Tliba O,Panettieri RA Jr.Airway smooth muscle as an immunomodulatory cell[J].Pulm Pharmacol Ther,2009,22(5):353 -359
14 Damera G,Panettieri RA Jr.Does airway smooth muscle express an inflammatory phenotype in asthma[J].Br J Pharmacol,2011,163(1):68 -80
15 Burgess JK,Ceresa C,Johnson SR,et al. Tissue and matrix inflences on airway smooth muscle function[J].Pulm Pharmacol Ther,2009,22(5):379 -387
16 Araujo BB,Dolhnikoff M,Silva LF,et al. Extracellular matrix components and regulators in the airway smooth muscle in asthma[J]. Eur Respir J,2008,32(1):61 -69
17 朱建波,许成芳,王文霞. 福莫特罗对过敏性哮喘大鼠气道中嗜酸性粒细胞浸润的抑制作用[J]. 实用医学杂志,2010,26(13):2304
18 Judith LB,Reynold AP Jr,Audreesh B,et al.Airway smooth muscle in asthma:just a target for bronchodilation?[J]. Clin Chest Med,2012,33(3):543 -558
19 Yang YC,Zhang N,Van Crombruggen K,et al. Transforming growth factor-beta1 in inflammatory airwaydisease:a key for understanding inflammation and remodeling[J].Allergy,2012,67(10):1193 -1202
20 李娟,沈奕,钱艳,等. 转化生长因子β1Ⅰ型受体拮抗剂对支气管哮喘小鼠气道炎症及气道重塑的影响[J]. 中华哮喘杂志:电子版,2013,7(3):25 -31

