血涂片常规染色的历史变迁与发展前景
宋晓颖,袁宝军,郝冀洪
(1.开滦总医院,河北唐山063000;2.河北医科大学第二医院,河北石家庄050000)
血涂片常规染色的历史变迁与发展前景
宋晓颖1,袁宝军1,郝冀洪2
(1.开滦总医院,河北唐山063000;2.河北医科大学第二医院,河北石家庄050000)
对血涂片常规染色的组成、功能、效果的发展历程及其应用前景进行阐述。强调血细胞染色是形态学检查的基础,其染色效果决定血细胞识别的质量,直接影响着血液系统疾病诊断与鉴别诊断的水平。
血涂片常规染色;历史变迁;发展前景
血细胞染色是形态学检查的基础,其染色效果又决定了血细胞识别的质量,直接影响着血液系统疾病诊断与鉴别诊断的水平。自从全国形态学专家座谈会召开以来,迅速引起国内各实验室对形态学检验的重视,同时也注意了不断提高血细胞染色的质量。DUNNING等[1]关注了瑞氏(W right)-姆萨姬(Giemsa)染色法(简称瑞-姬染色法)60年的进程,并提出了理想的瑞-姬染色方案。实际上瑞-姬染色是改良的罗曼诺夫斯基(Romanowsky)染色法。罗氏染液对不同的血细胞有不同染色能力,最初是从陈旧发霉的亚甲蓝、伊红混合液将红细胞内寄生虫的核物质染成鲜艳的紫色和染色质染成红色而发现的。这种染液的特性是在蓝色和粉红色之外产生了第3种颜色——紫色。罗氏染液染出第3种颜色的能力被称之为“罗氏效应”。这种效应可能是亚甲蓝的氧化产物天青B与伊红组成的一种复合物。1984年,国际血液学标准化委员会(the International Council for Standardization in Haematology,ICSH)推荐Romanowsky染色为参考染色法[2-3]。随后国内外学者又先后又推出了快速染色法、混合染色法、改良染色法、替代染色法等。大量的文献报道印证了Romanowsky染色的变迁,也展现了今后血细胞染色的发展前景。
一、经典染色法的建立
俄罗斯学者ROMANOWSKY[4-5]首创了含有亚甲蓝和伊红的罗氏染色法,并证明亚甲蓝-伊红液越陈旧其染色效果越好。罗氏染色剂是利用氧化剂氧化亚甲蓝,使之产生天青,再与伊红液混合后可立即染已固定的涂片。曾有学者根据罗氏染色剂用伊红和亚甲蓝混合而成的原理,把两者配成甲醇溶液用以染色。这种染色液虽可使涂片同时固定和染色,但因亚甲蓝未经处理,天青的含量极微,染色效果不佳,未被推广使用。1901年利什曼(Leishiman)、1902年瑞氏(Wright)、1902年姬姆萨(Giemsa)分别根据罗氏染色剂用伊红和亚甲蓝混合而成的原理,设计了3种不同特点的染色剂,并成批生产出染色粉剂,从而建立了经典染色法,并一直使用至今。
1.利什曼染色剂配方:亚甲蓝1 g,碳酸钠0.5 g,蒸馏水100 mL;水溶性伊红0.1 g,蒸馏水100 m L。将以上2种溶液等份混合,放置6~12 h,常搅动,即有沉淀生成,过滤取其沉淀,晾干。用甲醇配成0.15%的溶液即可用以染色。
2.瑞氏染色剂配方:亚甲蓝1 g,碳酸钠0.5 g,蒸馏水100 mL。煮沸1 h,使加速氧化,冷后缓缓加入0.1%伊红水溶液,充分搅动,有沉淀生成,过滤后取其沉淀。按常规方法配制瑞氏染色液并染色。
3种经典染色法在临床上应用以后,虽然利什曼染色液和瑞氏染色液均有粉剂出售,但由于这2种染色法非常近似,所以目前使用瑞氏染色法和姬姆萨染色法较为普遍。在罗氏染色法的基础上,有学者制出了May-Grunwald染色粉剂,并在临床上推广使用。随后在May-Grunwald染色的基础上又有学者建立了May-Grunwald-Giemsa染色法。
二、快速染色法的兴起
经典染色法应用于临床后,由于染色时间偏长,不利于急诊检验,因此各种快速染色法先后推出。快速染色法主要有两类:两色分染法和快速促染法。
(一)两色分染法
1941年Field提出在不用甲醇作为溶剂的前提下,先用一种染色液染色,后用另一种染色液染色。两色分染法的染色时间可缩短,且价格低廉。Field法原来是用于疟原虫染色的,守屋(1947年)对此法做了改进,可用于血液标本染色。其特点是:(1)已固定的涂片在甲液(水溶性伊红1.0 g、Na2HPO45.0 g、KH2PO46.25 g,蒸馏水500 mL)中浸10~20 s;(2)由甲液中取出,立刻在水中将涂片左右轻微摆动数秒钟,以冲去染液,直到血膜中无染液外渗,玻片边缘不沾染液为止;(3)在乙液(亚甲蓝0.8 g、天青Ⅰ0.5 g、Na2HPO45.0 g、KH2PO46.25 g,蒸馏水500 mL)中浸30~60 s,清水冲洗5~10 s,使涂片直立放置,待干。
Field两色分染法在临床上推广后国内外都有改良法。1944年,Singh等对甲液进行了修改,并使用缓冲液漂洗涂片。其特点是:(1)已固定的涂片置于甲液(亚甲蓝水溶液中加少量硫酸,再加入重铬酸钾使之生成紫色沉淀,加热直至液体变蓝色;冷却后滴加氢氧化钾溶液直至沉淀完全溶解,并变为深蓝带紫色液;过滤,滤液即可应用)内30 s,pH值6.2~6.6的缓冲液漂洗;(2)置于乙液(0.2%水溶性伊红)中1 s;(3)再置于甲液中30 s,用缓冲液漂洗10 s。国内改良法较多,多数都按甲液、乙液分染,但染液成分和染色时间略有不同。巴特尔等[6]在甲液中加入了苯酚,乙液与Field两色分染法近似,其步骤为:涂片置甲液2 s后取出用水冲洗玻片,乙液染色5~8 s,取出后用水冲洗,待干。快速染色会加快血液常规检验速度,同时也可避免漏掉可疑细胞,出现假阴性。于芳[7]在甲液中加入了苯酚,在乙液中加入天青Ⅰ和天青Ⅱ,其步骤为:血片浸入甲液2~3 s,取出水洗;浸入乙液6~8 s取出水洗,待干镜检。血涂片快速染色结果和瑞氏染色结果相似,可减少患者等候时间。
本研究选取的样本只有102份,且有些国家地区的留学生样本量太少,对研究结果造成了一定偶然性。研究得出的结构方程模型拟合度还不够好,说明在维度的划分和题项的设置上还需要进一步改进和完善。
(二)快速促染法
两色分染法虽然染色时间大大缩短,减少了患者的等候时间,但手续繁杂,且需经常更换染色液。因此,国内外学者均着手研究促染技术。
1.加大磷酸盐类促染MCDONALD[8]在染液中加入Na2HPO4和KH2PO4以控制其pH值,可缩短染色时间。田荣宗等[9]在血细胞染色液中加入pH值6.8的甘油缓冲液,染料易溶,染色快,可使染色时间缩短至15 s。赵捷等[10]用改良McDonald法(在75 mL分析甘油中加入磷酸盐缓冲液、Na2HPO41 g和KH2PO42 g,先以4 mL蒸馏水溶解,37℃水浴24 h溶解,保存于密封的瓶中。上述甘油缓冲液1.5 mL加瑞-姬染色液50 mL,混匀)染色。结果显示加入甘油和磷酸盐的染色剂天青B含量明显增加,而天青B含量是提高染色效果的决定因素。以ICSH标准判断血片染色效果,加入甘油磷酸盐的染色剂明显优于常用的瑞-姬染色液。而且这种染色法试剂配制简便,染色时间短,非常适合急症和门诊血常规检验,可在临床上推广使用。
2.加入表面活性剂促染目前已用的表面活性剂有二甲亚砜(dimethyl sulfoxide,DMSO)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、聚乙二醇辛基苯基醚[octyl phenoxy poly ethoxy,OP;即曲拉通X-100(Triton X-100)]、吐温80及吐温20等。王继贵等[11]用PVP先加于甲醇中,再配制瑞氏染液,血片染2 min,骨髓片染5 min。细胞染色快可能与PVP作用有关。邓福贵等[12]在瑞氏-姬姆萨染液中加PVP,使染色在30 s内一步完成,染色效果与原法一致,此染液尤其适用于临床常规工作。王援朝等[13]在瑞氏染液中加入Triton X-100,染色时间为1~3 min。万汝根[14]在瑞-姬染色液中加入Triton X-100,血片自然干燥后滴加染色液覆盖血膜,2~30 s水洗,待干镜检。梁维岗[15]在瑞-姬染色液中加入吐温20,血片自然干燥后滴加染色液覆盖涂片,固定10 s,加等量蒸馏水染色2~5 min。董事早等[16]用乙醇配制的快速瑞-姬染色液中加入吐温80,血膜固定20 s,加pH值6.5缓冲液染色1~2 min。由于吐温80属表面活性剂,具有增溶、去垢、分散、均染、促进化学结合等作用,因此染料颗粒少,并增强了染料对细胞的渗透性,使染色速度加快。鄢盛恺等[17]在McDonald法的基础上,在瑞-姬染色液中既加甘油缓冲液,又加入少许PVP,染色20 s,轻洗20 s。加入PVP,可增加染料的溶解度;加入甘油缓冲液,可缩短染色时间。
三、标准染色法的推广
经典染色法和快速染色法用于临床以后,由于每个实验工作者都只习惯于本实验室的染色方法,实验室之间用不同的染色方法进行会诊时,常引起争论甚至作出不同的形态学诊断。同样,参考图谱也会出现问题,因为图谱里的插图也可能使用了不同的染色方法。不同染色法的插图甚至会误导读者。所以将染色方法标准化不仅是日常诊断工作中的需要,也是进行研究工作所需要的。为了克服不同种类染色的效果差异以及实验室间不同的染色标准,ICSH成立了血和骨髓片染色和染色方法小组,并确立了一套标准的血涂片染色方法。ICSH的专家们发现了3个基本条件可使Romanowsky染色法的重复效果满意。(1)使用足够纯度的天青B以及伊红Y;(2)正确和适当的组合染料将其配制成染液;(3)1个标准的染色方法需要选定缓冲液浓度。
1.ICSH推荐的标准染色法ICSH确立的标准染色方法要求:(1)贮存液由天青B-DMSO溶液(天青B 3 g,DMSO 400 mL)和伊红Y-甲醇溶液(伊红Y 1 g,甲醇600 m L)组成,两液混合后以棕色瓶在室温避光保存,可稳定3个月;(2)染色液由1体积天青B-伊红Y贮存液和14体积的10 mmol/L N-(2-羟乙基)哌嗪-N'-2-乙烷磺酸[4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES]缓冲液(pH值6.6)1 000 mL及二甲亚砜50 mL组成,此溶液必须是新鲜配制,可稳定4 h; (3)染色步骤:甲醇固定涂片后,加天青B和伊红Y染色液,血涂片染色25 min,骨髓涂片染色35 min,蒸馏水冲洗。
2.SCHENK等[18]推荐的参考染色法由于ICSH推荐的标准染色法中要使用DMSO和HEPES,对实验条件要求较为严格。因此,SCHENK等[18]提出使用甲醇和磷酸盐替代,也能取得较为满意的染色效果,有利于在临床推广。(1)贮存液由天青B-甲醇溶液(天青B 260 mg,甲醇100 mL)和伊红Y-甲醇溶液(伊红Y 130 mg,甲醇100 mL)组成;(2)染色液由1体积天青B-甲醇溶液、1体积伊红Y-甲醇溶液和10体积0.067 mol/L Sorensen's磷酸钠缓冲液(pH值6.8)组成,此溶液必须是新鲜配制,可稳定1 h; (3)染色步骤:甲醇固定涂片后,加天青B-伊红Y染液,血涂片染色10 min,蒸馏水冲洗。
ICSH推荐了标准染色法,同时提出了标准染色特点,随后SCHENK等[18]推荐的参考染色法也提出了标准染色特点,见表1。
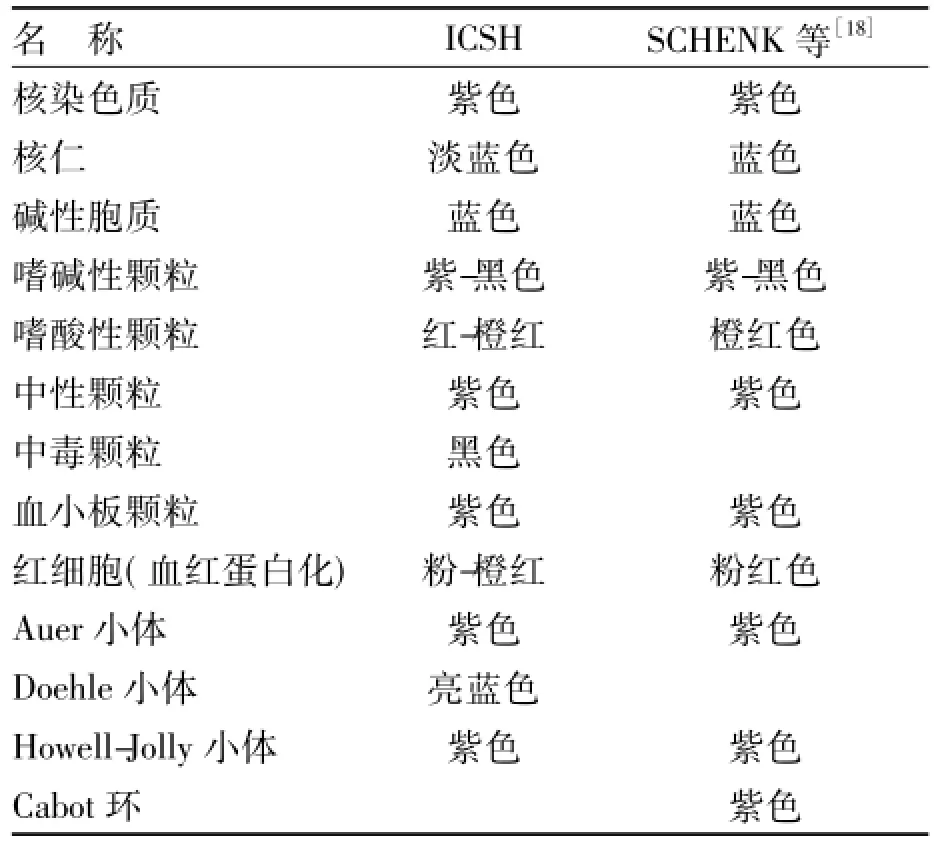
表1 ICSH和SCHENK等[18]提出的标准染色特点
ICSH推荐的标准染色法和SCHENK等[18]推荐的参考染色法公布以后,推广时遇到了实际困难,主要原因是天青B的纯度达不到要求。按ICSH的要求,天青B纯度应不低于95%,但市售的天青B纯度均未超过84%。1988年,ICSH正式提出的标准染色法中对天青B纯度的要求改为80%以上。由于天青B提纯的费用较高,因此标准染色法在国内推广缓慢。
四、混合染色法的优点
ICSH推荐的标准染色法和SCHENK等[18]推荐的参考染色法难以在临床上推广,而国内常用的瑞氏和姬姆萨染色剂中的天青B含量均不符合ICSH要求,但这2种染色法各有优缺点,瑞氏染色对细胞质成分及中性颗粒着色好,而对细胞核的染色不如姬姆萨染色,采用瑞氏-姬姆萨复合染色液染色,兼取两者之长,可使血细胞的胞质、颗粒及胞核等获得较为满意的染色效果。因此,混合染色法引起了国内外实验室的高度重视。根据其染色特点分为以下3种。
1.混合配制染液一步染色法《全国临床检验操作规程》笫1版(1991年)~笫3版(2006年)[19]推荐的混合染色液为瑞氏粉1 g、姬姆萨粉0.3 g、甲醇500 m L,染色6~10 min。王国洪[20]、王建萍[21]在此基础上加大了姬姆萨粉剂的用量,使染色速度加快,细胞结构清晰。郭秀梅等[22]则以瑞氏粉0.6 g、姬姆萨粉1 g、甲醇500 m L配制混合染色液,使血片、骨髓片没有染料沉淀颗粒,镜检清晰,易于鉴别。王金芝等[23]以瑞氏粉3.2 g、伊红B 0.6 g、天青Ⅱ0.6 g、甲醇1 000 mL及pH值6.8甘油缓冲液25 mL配制混合染色液,血片染色15 s。梁砚华等[24]以姬姆萨粉5 g、亚甲蓝伊红染料1.5 g、中性甘油30 mL、甲醇600 mL配制混合染色液,缩短了染色时间,且有利于观察细胞的结构。
2.两液混合一步染色法周海良等[25]按常规方法配制瑞氏染色液、姬姆萨染色液及pH值6.5~6.8磷酸盐缓冲液,将瑞氏染色液与姬姆萨染色液按3∶1比例混合,此液可长期保存。混合液与磷酸盐缓冲液以1∶15的比例混合即为应用染色液。固定血片直接插入应用染色液缸内,染色1~3 min。该法优点是应用染色液可多次重复应用。
3.两液双重染色法刘小蓉[26]将血涂片自然晾干,瑞氏染液染色5 min,蒸馏水冲洗数遍,0.05%乙酸分色2~3 s,蒸馏水冲洗2遍,用稀释了的姬姆萨染色液染色10 min,蒸馏水冲洗数遍。DUNNING等[1]推荐了理想的瑞-姬染色方案,固定后的涂片在瑞氏染液中染4 min,摇动几次,再进入瑞氏染液工作液中(200 mL磷酸盐缓冲液贮存液,25 mL瑞氏染液贮存液,25 mL吉姆萨染液贮存液,1 h内使用)染12~20 min,摇动几次。
五、改良染色法的特点
实践证明,混合染色法优于单一染色法。为了提高血片、骨髓片染色效果,国内外仍不断对染色技术加以改进,有的在染色液快速溶解方面进行了改良;有的在分化剂使用方面进行了改良;有的在血膜外形成一层液态膜方面进行了改良;也有的在微波快速染色方面进行了改良。
1.各种改良染色法侯金甫[27]在配制瑞-姬染色液时加入3%过氧化氢1.0 mL,省去了原法放在乳钵里充分研磨的时间,第2天即可使用。李碧华[28]吸取了Ezzat的经验,在配制瑞-姬染色液时加入浓盐酸0.5 mL,以加速染料溶解速度,待染料溶解,用300 g/L NaOH调节pH值至6.8~7.2,经过几年应用,效果很好。章克萍[29-30]在使用瑞-姬染色液进行染色的过程中,以含微量乙酸的蒸馏水或去离子水溶液(1 000 mL水滴加3~4滴乙酸)作为分化剂,其优点是易使血细胞着色,尤其是红细胞着色好。吴祥林[31]将血片在154 mmol/L Nacl溶液中浸2 s,然后移入瑞氏染色液中5~10 s,蒸馏水冲洗。该方法是基于生理盐水倾盖血膜,在血膜外形成一层液态膜,阻隔了瑞氏染液直接与红细胞接触,而白细胞所带电荷相对较多,这样延缓了红细胞与染料结合而白细胞则受影响较小。缺点是不能观察红细胞的形态变化。王贵娟等[32]在瑞-姬染色过程中,微波炉选用微波火力5档,输出功率为20%,血涂片辐射时间70 s,骨髓涂片辐射时间2.5 min,可极大的提高工作效率,参照ICSH标准判断染色效果,染色结果十分满意。
2.纸片染色法梅金安[33]以甲液(伊红水溶液)和乙液(氧化亚甲蓝水溶液)分别倒入2个小方盘内,将滤纸剪成2 cm×4 cm的纸片放入染液内浸泡10 min,65℃烤干,黑纸包好装入塑料袋中备用。取伊红纸片1张放于涂片上面,滴加95%乙醇5滴,染色1 min,用水冲掉纸片,再放亚甲蓝纸片1张,加数滴水湿透纸片,染色1 min,水洗干后镜检。
六、替代染色法的问世
1879年,Ehrlich首先发现普通纺织染料能用于血细胞染色,这些纺织染料可将各类血细胞染成不同颜色。KASS[4]曾以多种纺织染料进行血细胞染色研究,效果十分理想。国内学者也先后以国产纺织染料染血和骨髓涂片,也取得了非常满意的结果。
1.国外研究概况1986年,KASS[4]以一种未知成份的纺织染料Synacril黑AN染血细胞,使巨核细胞呈现异染性红紫色。随后KASS连续发表多篇文章,都是以纺织染料单染或双染各种血细胞,既创立了一些新染色法,也为临床形态学诊断和鉴别诊断做出了突出贡献。碱性蓝93是一种偶氮纺织染料。将血或骨髓涂片固定后,碱性蓝93可选择性地将粒细胞初级颗粒染成黑色。这种黑色颗粒在早幼粒细胞最多,在中、晚幼粒细胞较少,杆状核和分叶核粒细胞中仅见几个黑色颗粒,一般细胞越成熟颗粒越小,着色越淡。Auer小体被染成黑色。碱性蓝93染色有以下优点: (1)操作简单;(2)其水溶液在室内可稳定1年; (3)染色后标本至少可保存3年;(4)可用陈旧标本染色。碱性蓝54是一种含硫的纺织染料。将血或骨髓涂片固定后,以碱性蓝水溶液染色,并经pH值3.6的乙酸缓冲液短暂漂洗,正常和病理单核细胞的核和胞质均染成亮紫红色,且常含有8~20个深红色颗粒。中性粒细胞和淋巴细胞的胞质几乎无色,细胞核为棕色。碱性蓝148也是噁嗪类纺织染料,血和骨髓涂片固定后用碱性蓝148的水溶液染色,然后在pH值5.6磷酸盐缓冲液中漂洗。T辅助性淋巴细胞核和胞质可染为深红~紫红色,而其它血细胞未见这种颜色。可作为一种对T辅助性淋巴细胞快速筛选染色法。碱性蓝41是一种含硫的偶氮染料,这种染料的甲醇液可将嗜碱粒细胞颗粒染为亮红至深红色,嗜酸粒细胞颗粒染为亮蓝绿色,红细胞为绿橙色。其它血和骨髓细胞的着色与传统的染色结果近似。酸性红52(acid red 52)是一种偶氮纺织染料。将血或骨髓涂片固定后,用酸性红52的水溶液染色,可将成熟中性粒细胞颗粒染成亮红色,Auer小体可染成红色,嗜酸粒细胞和嗜碱粒细胞中的颗粒染成深红色。其它血细胞中未见红色颗粒。
2.国内研究概况李顺义等[34]发现国产纺织染料耐晒黑G的乙醇溶液对粒细胞有特异性着色。耐晒黑G是一种多偶氮纺织染料,其乙醇溶液可染粒细胞,早期原粒细胞为阴性,晚期原粒细胞质内有少数黑色颗粒,早幼粒细胞质内有多数细小黑色颗粒,中幼粒以下阶段粒细胞着色强,嗜酸粒细胞着色也强,嗜碱粒细胞阴性。淋巴细胞、单核细胞、浆细胞、幼红细胞和巨核细胞阴性,组织嗜酸细胞阳性。朱芸等[35]以国产纺织染料碱性品蓝替代血细胞常规染色,血涂片经甲醇固定后,直接用碱性品蓝水溶液染色,染色结果与瑞氏染色相近似。郝冀洪等[36]用碱性品蓝对巨核细胞和血小板进行染色,通过优选漂洗液使染色结果与其他血细胞有明显的区别。
除纺织染料可替代瑞氏/姬姆萨染色外,徐宏瑛[37]以煌焦油蓝-曙红染色液替代瑞氏/姬姆萨染色进行白细胞分类计数,结果与瑞氏染色一致,同时这种染色液也可进行网织红细胞活体染色。
七、血涂片常规染色的发展前景
血细胞染色在国内使用最多的是瑞氏染色法和瑞-姬染色法。这2种染色法的天青B含量均达不到Romanowsky染色的要求。虽然生物学染色委员会限定天青B最低含量为80%,但国内、外瑞氏染色剂中天青B的含量仍较低。生物学染色委员会曾调查国外9个厂家生产的瑞氏染色剂,其中8种染色剂天青B的含量仅为35%,亚甲蓝为30%,天青A为25%,天青C为10%;剩余一种天青B含量为74%,均达不到天青B含量80%的要求。近年用高效液相色谱仪对姬姆萨染色剂的天青Ⅱ做了物质组成分析,其中亚甲蓝为63.6%、天青B为28.6%、天青A为4.4%、天青C为1.4%、硫堇为1.9%;而天青Ⅰ并不是很纯,而是一种硫堇及其3,7-N-甲基的衍生物。说明姬姆萨染色剂也达不到天青B含量80%的要求。
1.ICSH推荐的Romanowsky染色法要求天青B纯度较高。一般认为94%的天青B可以生产,但其可溶性差,需加增溶剂,而且制作成本高,从经济实用方面考虑不太实际。因此目前多用于科学研究,尚难在常规工作中应用。同时商品化天青B价格较高,在市场上很难购到,致使这种参考方法在各国推广起来进展不快。若能在现有基础上提高国产瑞氏、姬氏染料中天青B的含量,也可逐步与ICSH接轨。
2.瑞-姬染色法60年的实践经验提示我们,作为经典染色技术,瑞-姬染色法通过进一步改进仍然是理想的染色法。May-Grunwald染色和May-Grunwald-Giemsa染色也可用于血和骨髓涂片染色,并能获得比较理想的染色效果。这些均是今后血细胞染色重要的染色技术。
3.血细胞染色是形态学检查的基础,其染色效果又决定了血细胞识别的质量,而且国内各实验室用量较大。因此,从实际工作需要出发,为了提高血细胞形态学检查的质量,应组织国内化工专业生产染料的工厂通过攻关,尽快生产出高质量的血细胞染色剂。
4.国产纺织染料碱性品蓝水溶液可染各种血细胞,染色结果与瑞氏染色相近似。证明应用国产纺织染料开展染色研究,已取得了可喜的成果。我国是一个纺织大国,国产纺织染料众多,经过筛选,可用于血细胞染色。由于国产纺织染料易得,方法简单,而且不需要特殊的仪器,有非常广阔的发展前景。
致谢:本文承蒙河北医科大学第二医院李顺义教授审阅,特此致谢。
[1]DUNNING K,SAFO AO.The ultimate W right-Giemsa stain:60 years in the making[J].Biotech Histochem,2011,86(2):69-75.
[2]International Committee for Standardization Haematology.ICSH reference method for staining of blood and bone marrow films by azure B and eosin Y (Romanowsky stain)[J].Br J Haematol,1984,57 (4):707-710.
[3]HOROBIN RW.How Romanowsky stains work and why they remain valuable-including a proposed universal Romanowsky staining mechanism and a rational troubleshooting scheme[J].Biotech Histochem,2011,86(1):36-51.
[4]KASS L.New stains for blood and bone marrow cells[J].Stain Technol,1990,65(5):211-230.
[5]KRAFTS KP.The Malachowski-Wright-Giemsa stain: a many-splendore thing[J].Biotech Histochem,2011,86(1):5-6.
[6]巴特尔,李晓莲.快速染色液在血液常规涂片检查中的应用[J].内蒙古医学杂志,2000,47(1):69.
[7]于芳.快速血片染色法的应用[J].湖北预防医学杂志,2001,12(S1):83.
[8]MCDONALD MJ.Modification of the W right-Giemsa stain for rapid staining[J].Med Lab Sci,1987,44 (1):88.
[9]田荣宗,冯问秀,李荣胜,等.一种多用途的快速染色法[J].上海医学检验杂志,1992,7(2):97-98.
[10]赵捷,李顺义.介绍一种快速血细胞染色法[J].疑难病杂志,2002,1(1):50.
[11]王继贵,相桂英,周赛琴,等.介绍一种改良血及骨髓涂片染色剂[J].上海医学检验杂志,1992,7 (1):35.
[12]邓福贵,宋万英.一种快速瑞氏-姬姆萨染色液[J].临床检验杂志,1995,13(2):111.
[13]王援朝.用二甲亚砜及非离子表面活性剂改进瑞氏染液的探讨[J].中华血液学杂志,1992,13(4): 209.
[14]万汝根.改良快速瑞氏-姬姆萨染色液[J].中华检验医学杂志,1998,21(3):37.
[15]梁维岗.加吐温20的瑞氏-姬姆萨染色液[J].临床检验杂志,1995,13(6):316.
[16]董世早,汤正平.用乙醇配制的快速瑞氏-姬姆染色液[J].安徽预防医学杂志,1998,4(2):169-170.
[17]鄢盛恺,俞善丁.介绍一种快速实用瑞-姬氏染色法[J].临床检验杂志,1992,12(3):167.
[18]SCHENK EA,STOTA EH.Note from the biological stain commission:revision of azure B assay protocol[J].Stain Technol,1988,63(1):65-69.
[19]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:124.
[20]王国洪.一种快速血片染色法介绍[J].黔南民族医专学报,1996,9(2):11-13.
[21]王建萍.快速瑞忒氏姬姆萨氏混合一次染色法的使用介绍[J].内蒙古医学杂志,1998,45(6):55.
[22]郭秀梅,冯秀丽,赵毅刚.改良瑞氏染色法[J].农垦医学,1998,24(3):179.
[23]王金芝,潘丽,毕瑞金.一种改良的瑞氏快速染色法[J].齐齐哈尔医学院学报,1995,12(1):39.
[24]梁砚华.介绍一种改进的血片染色法[J].中国厂矿医学,1995,10(6):393.
[25]周海良,戴启宇,于贺军.介绍一种末梢血片血细胞单一染色法[J].临床军医杂志,2000,28(2): 69-70.
[26]刘小蓉.血涂片的双重染色法的改良[J].第一军医大学学报,1998,18(4):328.
[27]侯金甫.介绍一种新瑞-姬氏染色法[J].陕西医学检验,1994,9(2):121-122.
[28]李碧华.介绍一种血片染色法[J].四川医学,1998,19(1):79.
[29]章克萍.介绍血液Wright染色改良法[J].江西医学院学报,1997,42(1):119.
[30]章克萍,吕娇凤.一种制作血涂片染色的新方法[J].江西医学院学报,2002,47(1):17.
[31]吴祥林.一种白细胞分类染色方法的改进[J].上海医学检验杂志,2001,16(2):123.
[32]王贵娟,武惠珍.血细胞微波快速W right-Giemsa染色[J].河北医科大学学报,2003,44(1):36.
[33]梅金安.一种纸片快速细胞学涂片染色方法[J].中华病理学杂志,1994,40(3):187.
[34]李顺义,张静.纺织染料耐晒黑G染色在血细胞研究中的应用[J].中华血液学杂志,1993,14(11): 595-596.
[35]朱芸,张静,石广和.碱性品蓝血细胞染色法[J].河北医科大学学报,2001,42(5):301.
[36]郝冀洪,朱芸,张静,等.巨核细胞新染色方法及其临床应用研究[J].中华检验医学杂志,2005,28 (9):40-43.
[37]徐宏瑛.介绍一种血细胞与网织红细胞两用染色液[J].江西医学检验,1994,12(4):33.
The historical evolution and development prospect of rou tine blood smear staining
SONG Xiaoying1,YUAN Baojun1,HAO Jihong2.(1.Kailuan General Hospital,Hebei Tangshan 063000,China;2.The Second Hospital of Hebei Medical University,Hebei Shijiazhuang 050000,China)
The objection is to state of composition,function,history development and application prospect of routine blood smear staining,in order to stress that blood staining is the basis of morphological diagnosis.The staining effect determines the identification of blood cells and impacts on the level of blood system disease diagnosis and differential diagnosis.
Routine blood smear staining;Historical evolution;Prospect
1673-8640(2015)09-0962-06
R446.1
A
10.3969/j.issn.1673-8640.2015.09.022
2014-09-28)
(本文编辑:范基农)
宋晓颖,女,1986年生,学士,技师,从事医学检验工作。
袁宝军,联系电话:0315-3025853。