缺血性脑卒中患者血浆脂蛋白相关磷脂酶A2检测的临床意义
胡晓琳,高静
(天津中医药大学第一附属医院检验科,天津300193)
缺血性脑卒中患者血浆脂蛋白相关磷脂酶A2检测的临床意义
胡晓琳,高静
(天津中医药大学第一附属医院检验科,天津300193)
脂蛋白磷脂酶A2;缺血性脑卒中;动脉粥样硬化
缺血性脑卒中疾病的重要病理基础是动脉粥样硬化(atherosclerosis,AS),而炎症现已被公认为是AS发展过程中的核心因子,贯穿于AS的整个发生、发展环节[1]。脂蛋白相关磷脂酶A2 (lipoprotein-associated phospholipase A2,Lp-PLA2)作为一种新型的炎症标志物,参与AS斑块形成的各个阶段,在坏死中心、巨噬细胞、凋亡的巨噬细胞内以及易损和破裂的斑块中有高度表达[2]。D-二聚体(D-dimer,D-D)是纤溶酶作用于交联纤维蛋白后产生的特异性降解产物,其升高特异地反映体内纤溶活性增强和凝血酶生成增多,对血栓形成性疾病有早期快速诊断的价值[3]。D-D与Lp-PLA2可能对缺血性脑卒中的发生、发展有重要意义。为此,我们检测了缺血性脑卒中患者血浆Lp-PLA2水平,并分析其与颈动脉内中膜厚度(carotid intima-media thickness,CIMT)、动脉粥样硬化斑块的稳定性以及D-D之间的关系,以期为缺血性脑卒中的临床诊断、分期及疗效观察提供理论依据。
一、材料和方法
1.研究对象(1)动脉粥样硬化性脑梗死(atherosclerotic cerebral infarction,ACI)组:89例ACI患者均来自天津中医药大学第一附属医院2014年3月至6月入院的患者,男54例,女35例,均符合第4届脑血管病学术会议制定的急性脑梗死诊断标准[4],并据颈动脉彩超显示的斑块性质将上述患者分为不稳定斑块组(38例,其中男21例,女17例,年龄39~75岁)、稳定性斑块组(33例,其中男21例女12例,年龄42~72岁)、无斑块组(18例,其中男12例,女6例,年龄43~70岁);(2)正常对照组:选取同期年龄、性别相匹配的健康体检者62名,男38名,女24名,年龄40~65岁。确认无既往脑血管病史,近期未服用任何药物。
2.排除标准(1)腔隙性脑梗死、无症状性脑梗死;(2)明确栓子来源的脑栓塞,先天发育异常导致的脑梗死;(3)出血性脑卒中,梗死后脑出血;(4)各种凝血机制异常、血液系统疾病以及高黏血症所致的脑梗死;(5)肿瘤、肝病、自身免疫性疾病等;(6)严重的全身感染。
3.标本采集所有对象均取晨起空腹静脉血,ACI患者所用药物对相关检测项目无影响。分离血清,取部分于-20℃保存,集中检测LP-PLA2,以减少批间误差及测定误差。另一部分血清常规进行总胆固醇(totol cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、D-D检测。
4.方法Lp-PLA2检测采用酶联免疫吸附试验,试剂盒由天津康尔克生物科技有限公司提供。TC、TG、HDL-C、LDL-C试剂由日本和光纯药工业株式会社提供,仪器为日立7600系列全自动生化分析仪。D-D采用MINI-VIDAS全自动免疫分析系统(法国梅里埃公司)及配套试剂(酶联免疫荧光法)检测。
5.颈动脉超声多普勒检查采用东芝2000型彩色多普勒超声诊断仪测量CIMT,确定斑块位置和回声、斑块形态、大小范围、管壁细微硬化斑、有无狭窄或阻塞部位,有斑块者测量内径。斑块诊断测量标准:CIMT<1.0 mm为正常;1.0~1.2 mm为内膜增厚;>1.2 mm为斑块形成,视为粥样硬化。根据斑块形态和回声将其分为扁平型、软斑、硬斑以及溃疡斑。扁平型和硬斑称为稳定性斑块;软斑和溃疡斑称为不稳定性斑块,此种斑块发展快,易于脱落出血。
6.统计学方法采用SPSS11.5软件进行统计分析。正态分布计量资料以±s表示,组间比较采用t检验;非正态分布数据以中位数(M)[四分位数(P25,P75)]来表示,比较采用两独立样本的秩和检验,多组比较采用单因素方差分析(F检验),2个组数据的相关性采用Spearman秩相关分析。以P<0.05为差异有统计学意义。
二、结果
1.ACI组与对照组Lp-PLA2及相关生化指标比较ACI组Lp-PLA2、TG、LDL-C、D-D水平均高于正常对照组(P<0.01);而HDL-C、TC水平与正常对照比较差异无统计学意义(P>0.05)。见表1。
2.不同性质斑块组Lp-PLA2、D-D及CIMT的比较有斑块组CIMT明显高于无斑块组(P<0.01),稳定型与不稳定型组CIMT差异无统计学意义(P>0.05);无斑块组、稳定型斑块组Lp-PLA2和D-D水平与不稳定斑块组水比较差异均有统计学意义(P<0.01)。见表2。

表1 ACI组与正常对照组Lp-PLA2、D-D及血脂水平的比较
表2 ACI患者不同性质斑块组Lp-PLA2、D-D水平及CIMT的比较(±s)
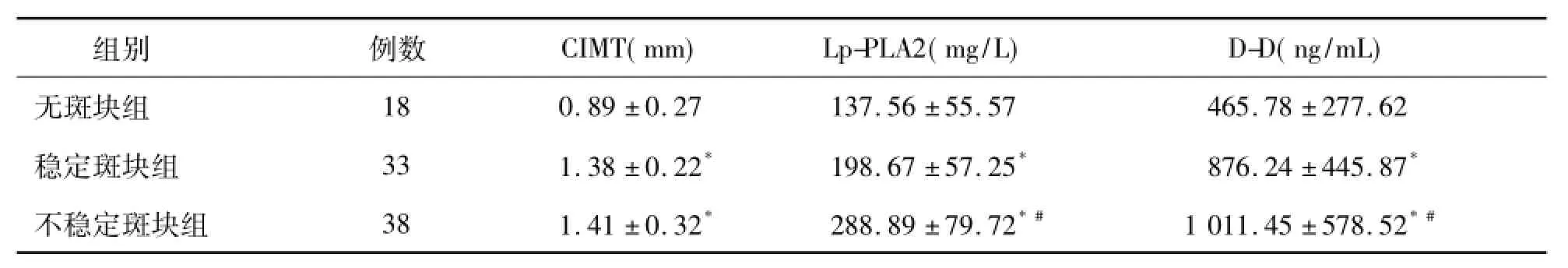
表2 ACI患者不同性质斑块组Lp-PLA2、D-D水平及CIMT的比较(±s)
注:与无斑块组比较,*P<0.01;与稳定型斑块组比较,#P<0.01
组别例数CIMT(mm)Lp-PLA2(mg/L)D-D(ng/mL) 18 0.89±0.27 137.56±55.57 465.78±277.62稳定斑块组33 1.38±0.22*198.67±57.25*876.24±445.87*不稳定斑块组38 1.41±0.32*288.89±79.72*#1 011.45±578.52*#无斑块组
3.CIMT与Lp-PLA2、D-D的相关性CIMT与Lp-PLA2、D-D均呈明显正相关[相关系数(r)分别为0.876、0.756,P均<0.01]。
三、讨论
Lp-PLA由441个氨基酸残基组成,在血液中主要由成熟的巨噬细胞和淋巴细胞合成分泌[5],可水解低密度脂蛋白分子中氧化修饰的磷脂,生成2种强促炎因子和趋化因子:溶血磷脂酰胆碱(lyso-phosphatidyl choline,L-PC)和氧化型游离脂肪酸(oxidized free fatty acid,ox-FFA),刺激黏附因子和细胞因子的产生,促进单核细胞衍生为巨噬细胞,进一步演变为泡沫细胞;凋亡泡沫细胞会聚集成动脉粥样硬化斑块,释放细胞因子和蛋白酶,降解纤维帽的平滑肌细胞核胶原基质,使脆弱斑块破裂,导致血管内皮损伤,引发动脉粥样硬化,血栓形成,造成缺血性脑卒中的发生[6]。
本研究结果显示ACI组血清Lp-PLA2水平明显高于正常对照组(P<0.01),这与叶芸等[7]的研究结果一致。经颈动脉彩超多普勒检查,CIMT与Lp-PLA呈明显正相关(r=0.876,P<0.01);无斑组、稳定型斑块组和不稳定型斑块组之间差异亦有统计学意义(P<0.01),表明Lp-PLA2贯穿着缺血性脑卒中的发生、发展过程,并且与颈动脉AS的斑块稳定性有关:Lp-PLA2的水平也越高,出现斑块的可能性越大,CIMT越高,且斑块的性质越易从稳定型向不稳定型发展。
在AS发生过程中,常伴有机体凝血及纤溶系统的激活。机体血浆纤维蛋白原在凝血酶和凝血因子Ⅻ作用下形成的交联纤维蛋白越多,患者颈动脉管腔越狭窄,AS情况越严重。随后,机体纤溶系统出现继发性亢进,将交联纤维蛋白溶解[8]。同时,脑卒中所引起的脑组织损伤和梗死组织释放组织因子,也会使凝血活性增高,机体高凝状态亦进一步导致激发纤溶活性增高,引起D-D水平的变化[9]。本研究结果显示ACI患者血清D-D水平明显高于正常对照组(P<0.01),CIMT与D-D呈明显正相关(r=0.756,P<0.01),且随着颈动脉斑块的由无到有和不稳定性的增加,其水平也逐渐升高,与文献报道[10-11]一致。另外,CIMT和斑块的性质反映了颈动脉AS的严重程度。本研究结果显示有斑块组CIMT高于无斑块组(P<0.01),稳定型与不稳定型组CIMT则无明显差异(P>0.05)。说明缺血性脑卒中的炎症反应可以引起颈动脉内膜增厚,使血管内皮受损,激活血小板,促进了血栓形成或继发纤溶活性增加,使D-D水平增高。
综上所述,Lp-PLA2已经成为一个新的急性缺血性脑卒中的危险标志物,在动脉粥样硬化形成、粥样斑块内中膜厚度和斑块的不稳定性中发挥着重要作用。检测血中Lp-PLA2的水平有助于识别斑块局部炎症反应的程度和早期识别易损斑块的产生,有利于临床病情进展的分析和预后的判断。
[1]何德化,李卫华.脂蛋白相关磷脂酶A2与冠心病的相关性研究进展[J].心血管病学进展,2008,29(1):57-60.
[2]KOLODGIE FD,BURKE AP,SKORIJA KS,et al. Lipoprotein-associated phosphoipase A2 protein expression in the natural progression of human coronary atherosclerosis[J].Arterioscler Thromb Vasc Biol,2006,26(11):2523-2529.
[3]陈峻,马涛,崔天盆.急性脑梗死患者血浆FDP、DD和CRP联合检测的临床价值[J].标记免疫分析与临床,2013,20(2):111-112.
[4]中华医学会全国第四届脑血管病学术会议.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,42(6):60-61.
[5]贵永堃,吕晓红.脂蛋白相关磷脂酶A2与缺血性脑血管疾病的研究进展[J].中风与神经疾病杂志,2011,28(1):86-88.
[6]龙璐,王钟明,陈贞,等.急性缺血性脑卒中患者血浆Lp-PLA2水平与颈动脉硬化斑块稳定性及神经功能缺损程度的关系[J].检验医学,2013,28 (10):885-889.
[7]叶芸,李苏亮.脑卒中患者血浆Lp-PLA2水平及临床意义探讨[J].检验医学,2014,29(3):249-253.
[8]陈新民,陈福民.急性缺血性脑卒中患者颈动脉粥样硬化与D-二聚体水平的关系[J].中国医药导刊,2013,15(5):872.
[9]王慧.急性脑梗死患者NSE、hs-CRP和D-二聚体检测的临床意义[J].中国现代医生,2014,8 (21):67-69.
[10]SMITH A,PATTERSON C,YARNELL J,et al.Which hemostatic markers add to the predictive value of conventional risk factors for coronary heart disease and ischemic stroke?The Caerphilly Study[J].Circulation,2005,112(20):3080-3087.
[11]VOROBEVA NM,PANCHENKO EP,DOBROVOLSKII AB,et al.Elevated D-dimer in patients with cardiovascular diseases free from thromboembolic complications:what is it associated with and what has to be done[J].Angiol Sosud Khir,2010,16(4):34-41.
1673-8640(2015)09-0968-03
R446.1
B
10.3969/j.issn.1673-8640.2015.09.023
2015-02-28)
(本文编辑:龚晓霖)
胡晓琳,女,1970年生,学士,副主任技师,主要从事临床生化、免疫学检验工作。