沉默ABCG2 增强膀胱癌T24 对X 线的敏感性研究*
武 倩 ,魏 蕾,司马学琴,张 涛,甘亚平,蒋汝刚,刘复兴,宁志丰**
(1.武汉大学基础医学院,湖北 武汉 430071;2.湖北科技学院护理学院;3.湖北科技学院基础医学院)
放疗是晚期转移性膀胱癌的主要治疗手段之一,然而放疗的不敏感和癌干细胞对放疗的内在抵抗性常常导致治疗失败。在本研究中,我们评价了沉默ABCG2 是否能够增强膀胱癌T24 对X线的敏感性。
1 材料与方法
1.1 材料 膀胱癌细胞株T24 购自武汉大学中国典型培养物典藏中心。RPMI 1640 培养基和胎牛血清(FBS)、双抗购买自Hyclone 公司。MTT 购买自Gibco 公司,Transwell 板购买自Coming 公司,Matri 胶为Sigma 公司产品,siRNA 由上海吉玛制药技术有限公司合成。Lipofectamine 2000 购买自Invitrogen 公司。抗人ABCG2 一抗购自Abcam 公司,二抗购自武汉博士德公司。其他试剂为分析纯。
1.2 细胞培养 使用RPMI 1640 培养基添加10% 胎牛血清、100 U 青霉素和100 μg/ml 链霉素的方法将膀胱癌T24 培养在37℃、恒温恒湿的CO2培养箱中,待细胞密度长至85%左右时予以传代。
1.3 转染 将20 μmol/L 的siRNA 8 μl 稀释于250 μl 无血清1640,轻轻混匀,室温孵育5 min。加入8 μl Lipofectamine 2000,室温孵育5min。将siRNA 稀释液与Lipofectamine 2000 稀释液混匀,总体积500 μl,室温孵育20min。转染前1d 将细胞接种于6 孔培养板。接种密度为1 ×105个/孔,使得次日转染时细胞融合达60%~70%。Western blot 检测沉默效果。
1.4 MTT 将转染成功的细胞和未转染细胞各5000 个种入96 孔板,于种板后的第2d 予以4 Gy X 线照射2 h,常规培养4d,MTT 法检测吸光值。
1.5 平板克隆形成实验 将转染成功的细胞和未转染细胞各500 个种入6 孔板,于种板后的第2d 予以4 Gy X 线照射2 h,常规培养10d,吸取培养基后予以甲醇固定,0.1% 结晶紫予以染色15 min,计数肉眼可见的克隆数,克隆形成率(%)=阳性克隆数/种板细胞数×100%。
1.6 迁移实验 将转染成功的细胞和未转染细胞密度调至1 ×106个/ml,各500000 个种入Transwell 小室上室,体积为200 μl,培养基为无血清1640,下室内加入500 μl 含15% FBS 的1640,培养12~17h 后,结束培养,取出小室,以棉签轻轻擦去小室内细胞,剪下基膜,甲醇固定后,0.1%结晶紫予以染色,镜下计数10 个高倍视野中穿过基膜的细胞。
1.7 侵袭实验 实验步骤同迁移实验,不同的是小室内铺有Matrigel 胶,培养时间延长到20~24h。
1.8 统计学分析 计量资料以均数±标准差来表示,以配对t 检验来分析经X 线照射沉默ABCG2 前后的变化,以Graphpad prism 5.0 来行统计学分析并作图,P <0.05 被认为差异有显著性。
2 结果
2.1 干扰效果检测 我们利用在线设计工具,设计了针对ABCG2 的3 对siRNA,siRNA 序列分别为:siRNA 1#:5'-ACAAUUAAGGAUGUAAAUGUU-3',siRNA 2#5'-UCUUUUCAGCUUAAUAGAGCU-3',siRNA 3#5 '-AUAAUAUUUCUUUCUCAACUG-3 ',Western blot 检测结果提示siRNA 3#干扰效果最明显。接下来的功能试验均选用siRNA 3#。
2.2 经X 线照射,沉默ABCG2 后T24 的存活能力显著减弱 MTT 结果提示,经X 线照射,沉默ABCG2 后T24 的存活能力减弱,表现为OD 值显著下降(P=0.0186,图1)。

图1 MTT
2.3 经X 线照射,沉默ABCG2 后T24 的克隆形成能力显著减弱 如图2 所示,经X 线照射,沉默ABCG2 后T24 的平板克隆形成能力下降(P=0.0030)。
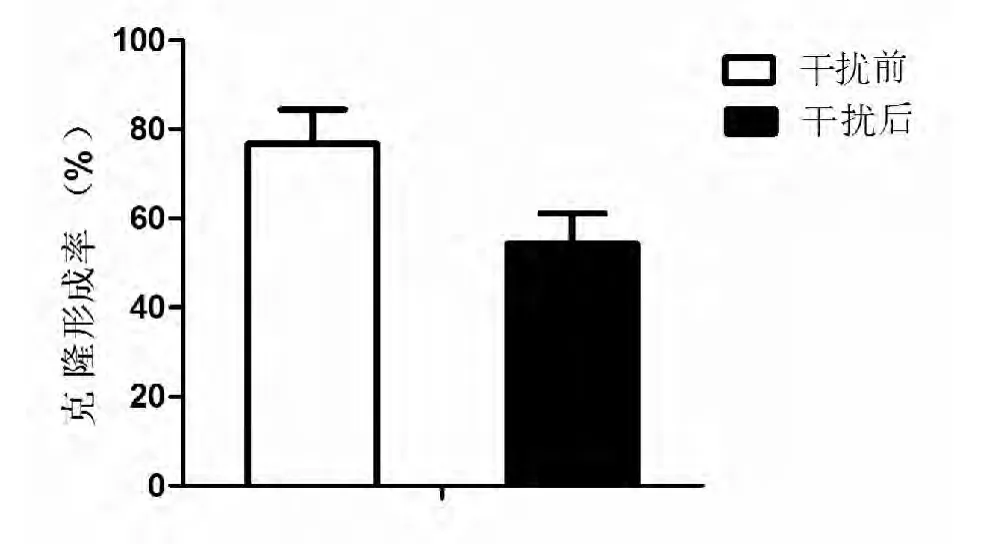
图2 平板克隆形成实验
2.4 经X 线照射,沉默ABCG2 后T24 的迁移能力显著减弱 如图3 所示,经X 线照射,沉默ABCG2 后T24 的迁移能力下降(P=0.0007)。

图3 迁移实验
2.5 经X 线照射,沉默ABCG2 后T24 的侵袭能力显著减弱 如图4 所示,经X 线照射,沉默ABCG2 后T24 的侵袭能力下降(P=0.0237)。

图4 侵袭实验
3 讨论
放疗是治疗晚期转移性肿瘤的主要手段之一,膀胱癌亦是如此。有研究表明[1],中晚期膀胱癌根治性放疗能够取得和根治性手术切除同样的远期疗效,前者甚至更有优势,因为前者能够部分保留膀胱的排尿功能,但是患者最终还是会死于放疗抵抗。
对于放疗抵抗的机制目前还不是很清楚。可以以“4R”模式来部分解释放疗抵抗的机制,即DNA 损伤的修复、细胞周期的重新分布、癌细胞的重新克隆、低氧肿瘤区域的重新氧化。癌干细胞被认为是肿瘤放疗抵抗的重要来源。越来越多的研究证实了这一点[2,3],但是不明确ABCG2 在放疗抵抗中的作用。我们推测ABCG2 是膀胱癌放疗抵抗的分子决定物。
在本研究中,我们使用siRNA 转录后沉默膀胱移行细胞癌细胞株T24 中的ABCG2,经免疫印迹检测,沉默效率可达85%左右,可有效干扰ABCG2 的表达,从而抑制ABCG2 对其下游信号通路的调控。Xie 等[4]研究表明在喉鳞状细胞癌Hep-2 和Hep-2T 中沉默ABCG2 的表达可显著抑制增殖和细胞周期进展,cyclin D3 的下调和p21 Cip1的上调是其可能的分子机制,说明ABCG2 可能位于增殖信号通路和细胞周期调控节点的上游。有关ABCG2 上游调控通路的研究较多,例如,Ishikawa 等[5]发现由基因NFE2L2 编码的转录因子NF-E2 可以上调许多靶基因,包括与代谢相关的酶和与细胞防御有关的转座子,近来更有研究发现NF-E2 可以与定位在ABCG2 启动子区域的抗氧化反应元件相互作用从而调控ABCG2 的表达。
尽管ABCG2 在癌症放疗抵抗中的作用未明,但是近来人们已经注意到它在肿瘤光动力疗法中的作用,说明ABCG2 的作用除了与耐药及干细胞表型有关外,还与光疗等其它形式的细胞毒性疗法有关。Hagiya 等[6]发现有部分胃癌细胞系对光敏感,部分细胞系不敏感,肽转运体PEPT1 的表达升高及ABCG2 的表达下调介导了光动力对胃癌的损伤。
总之,我们的研究初步表明,ABCG2 在膀胱癌细胞中的存在可能介导了放疗的抵抗,ABCG2的小分子抑制剂及ABCG2 的钙离子阻断剂维拉帕米可能成为放疗的增敏剂。
[1]Al-Dimassi S,Abou-Antoun T,El-Sibai M.Cancer cell resistance mechanisms:a mini review[J].Clin Transl Oncol,2014,16(6):511
[2]Kang MK,Hur BI,Ko MH,et al.Potential identity of multi-potential cancer stem-like subpopulation after radiation of cultured brain glioma[J].BMC Neurosci,2008,9(15):1471
[3]Bednar F,Simeone DM.Pancreatic cancer stem cells and relevance to cancer treatments[J].J Cell Biochem,2009,107(1):40
[4]Xie J,Jin B,Li DW,et al.ABCG2 regulated by MAPK pathways is associated with cancer progression in laryngeal squamous cell carcinoma[J].Am J Cancer Res,2014,4(6):698
[5]Ishikawa T,Kajimoto Y,Sun W,et al.Role of Nrf2 in cancer photodynamic therapy:regulation of human ABC transporter ABCG2[J].J Pharm Sci,2013,102(9):3058
[6]Hagiya Y,Endo Y,Yonemura Y,et al.Pivotal roles of peptide transporter PEPT1 and ATP-binding cassette(ABC) transporter ABCG2 in 5-aminolevulinic acid(ALA)-based photocytotoxicity of gastric cancer cells in vitro[J].Photodiagnosis Photodyn Ther,2012,9(3):204

