7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性及作用机理初探
齐强强,杨敏丽,郭宏霞
上海师范大学生命与环境科学学院,上海 200234
7-脱甲氧基娃儿藤碱(7-Demethoxytylophorine)是从萝藦科植物牛心朴子(Cynanchum komarovii)中分离出来的一种重要生物碱[1]。研究表明,这种生物碱对活体植株烟草花叶病毒TMV 和活体植株马铃薯Y 病毒有很高的抑制活性;对小麦赤霉病菌Gibberella zeae、番茄早疫病菌Altemaria solani、花生褐斑病菌Cercospora arachidicola 等植物病菌也有很好的杀菌活性[2];还能抑制蝴蝶乳草花Asclepias tuberose、叙利亚马利筋Asclepis syriaca 和大麻Cannabis sativa 等根系的生长[3]。此外,7-脱甲氧基娃儿藤碱还具有很好的抗癌活性,对白血病细胞P-338、人肝癌细胞Hep G2、人结肠癌细胞HCT116 和HT-29 和乳腺癌细胞MDA-MB-231 等均表现很好的细胞毒活性[4,5]。
本课题组在研究牛心朴子的杀虫活性时发现其生物碱对小菜蛾(Plutella xylostella L.)有很好的毒杀作用[6],采用活性跟踪的方法从其总生物碱中分离得到7-脱甲氧基娃儿藤碱,初步活性测试表明该碱对小菜蛾有较好的活性[7]。本文以小菜蛾为试虫,采用叶碟添加法测试了7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性,并结合电子显微镜技术和生化测试技术研究了它对小菜蛾中肠组织和消化酶活性的影响,研究结果表明7-脱甲氧基娃儿藤碱对小菜蛾幼虫有较好的胃毒活性,其活性与对中肠上皮组织的破坏和消化酶的抑制有关。研究结果为更好地开发和利用7-脱甲氧基娃儿藤碱在杀虫方面的作用及新农药研究开发提供依据。
1 材料与方法
1.1 实验材料
1.1.1 供试药液和试剂
7-脱甲氧基娃儿藤碱由本课题组从鹅绒藤属植物牛心朴子中分离得到[7],高效液相色谱法(Agilent 1100)测试其纯度为95.5%。准确称取一定量7-脱甲氧基娃儿藤碱,用50%丙酮溶解并定容,配制成一定浓度的溶液,测试时根据需要稀释成相应的浓度,作为供试药液。
Carnoy 固定液(自制):60 mL 无水乙醇+30 mL氯仿+10 mL 冰醋酸。试验所用试剂均为分析纯。
1.1.2 供试昆虫
小菜蛾:由本实验室人工继代饲养,饲养环境:温度23~26 ℃,湿度60%~70%,光照L∶D=14 h∶10 h。试验时挑选健康、虫体大小均一的3 龄幼虫。
1.2 实验仪器
HP400GS 人工气候箱(武汉瑞华仪器设备有限责任公司),L/L-S 电子天平(0.0001g,梅特勒-托利多仪器公司),Leica RM2255 型石蜡切片机(德国Leica 公司),Leica 双目显微镜(德国Leica 公司),LY-MN-HPDCCD 万能视频成像装置(成都励扬精密机电有限公司),Neofuge 23R 台式冷冻离心机(力康发展有限公司),UV2450 紫外-可见分光光度仪(日本岛津公司),HH-6 型数显恒温水浴锅(常州国华电器有限公司)。
1.3 胃毒活性测试方法
将供试药液用50% 丙酮依次稀释成8.00、4.00、2.00、1.00、0.500 mg/mL,采用叶蝶添加法[8]测试其胃毒活性:用圆形打孔器(φ=1.5 cm)将新鲜甘蓝叶打成叶碟,放入供试药液中浸渍5 s(对照叶碟以50%丙酮作相同处理),取出晾干放入培养皿中(内垫滤纸,用棉花球吸蒸馏水保湿)。每皿十字交叉放入4 片处理叶碟,接入10 头饥饿6 h 的3龄小菜蛾幼虫,每组重复3 次。48 h 后换成新鲜叶蝶,72 h 后开始记录试虫死亡情况和化蛹情况,连续观察7 d。
死亡标准:虫体变黑,成不规则的“1”或“V”字型,毛笔触之不动。
按照公式(1)、(2)、(3)计算死亡率、校正死亡率和化蛹率,药剂浓度转化为对数,校正死亡率转化为死亡几率,以死亡几率对药剂浓度对数做回归分析,得毒力回归方程,计算致死中浓度(LC50)。

1.4 组织病理学观察
用2.0 mg/mL 7-脱甲氧基娃儿藤碱药液处理试虫,72 h 后分别选中毒试虫、死亡试虫和50%丙酮处理的对照试虫各30 头投入60 ℃水中,虫体伸直后剪除头部,投入Carnoy 固定液。按常规石蜡切片法制成病理组织切片,HE 染色[9]。
1.5 小菜蛾体内消化酶活性的测试
1.5.1 酶液提取
分别挑选用2.0 mg/mL 药液处理24、48 h 的试虫及50%丙酮对照处理试虫各25 头,按照虫体质量与甘油体积1∶10(g∶mL)的比例加入预冷的20%甘油,匀浆后于4 ℃,10000 r/min 离心20 min,取上清液做酶源[10]。20%甘油定容成25 mL,0 ℃冰箱中保存,12 h 内测定。
1.5.2 消化酶活力的测定
淀粉酶活力测定采用3,5-二硝基水杨酸法[11],用麦芽糖制作标准曲线,缓冲溶液用pH 7.5 磷酸缓冲溶液,以30 ℃、20 min 内每分钟单位质量的淀粉酶水解淀粉生成麦芽糖的量作为淀粉酶活力单位:mg/mg pro/min。
蛋白酶活力测定采用福林-酚法[12],Folin-甲液为0.20 mol/L Na2CO3,pH 8.0 的磷酸缓冲溶液,用酪氨酸制作标准曲线。以30 ℃、15 min 内每分钟单位质量的蛋白酶水解酪蛋白生成酪氨酸的量作为蛋白酶活力单位:mg/mg pro/min。
脂肪酶活力测定采用橄榄油乳剂比浊法[13],用橄榄油乳剂制作标准曲线,缓冲溶液用pH 8.8 的Tris-HCl 溶液。以30 ℃、20 min 内每分钟单位质量脂肪酶水解橄榄油生成甘油三酯的物质的量为脂肪酶活力:m mol/mg pro/min。
按公式(4)、(5)分别计算酶活性和酶活性抑制率


1.6 数据处理与分析
用Excel 2003 和DPS(7.05)专业统计软件进行系统分组分析,用Duncan’s 新复极差法检验差异显著性。
2 结果与分析
2.1 7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性
使用叶碟添加法测试了7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性,结果见表1。分析结果可知,7-脱甲氧基娃儿藤碱对小菜蛾有较好的胃毒活性,随着药液浓度的增大和处理时间的延长,试虫死亡率不断增大,化蛹率不断减小,8.00 mg/mL 药液处理7 d 的死亡率为76.67%,化蛹率仅为10.00%,LC50为2.60 mg/mL。处理后存活的幼虫在测试时间内不能正常生长,或者一直处在幼虫期,处理24 h后的小菜蛾幼虫出现取食减缓,爬动减缓,部分试虫出现中毒症状:停止取食、身体发软;随时间延长,虫体应激性降低,并出现水肿、继而破裂,身体失水皱缩等死亡症状。
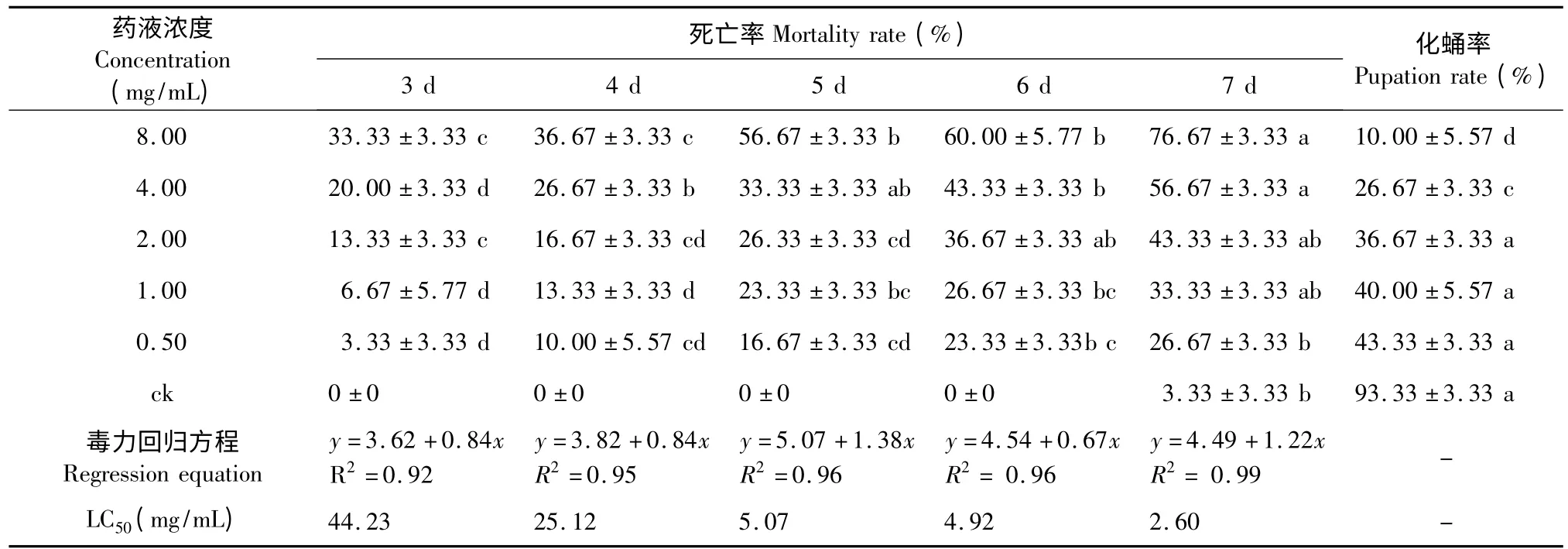
表1 7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性Table 1 Stomach toxicity of 7-demethoxytylophorine against 3th instar larvae of P.xylostella
2.2 7-脱甲氧基娃儿藤碱对小菜蛾中肠组织的影响
用双目显微镜观察小菜蛾组织病理切片。图1中A、B、C 部分分别为中毒试虫、对照试虫及死亡试虫的组织切片图。从图1(B)可以看出,对照处理的小菜蛾的肠壁上皮细胞排列整齐,杯状细胞和柱状细胞错落有致,微杆和杯腔基部微绒毛清晰,围食膜完整,肠腔内食物积累甚少。从图1(A)可知,中毒试虫食物积累较多,中肠壁弯曲、肠壁细胞排列疏松,微杆呈消融状态,杯腔内充塞,杯腔基部微绒毛消失,围食膜破坏,但上皮细胞未见明显破坏;从图1(C)可知,死亡试虫肠壁细胞排列凌乱,围食膜完全破坏。上皮细胞明显破坏。分析图1 可知,7-脱甲氧基娃儿藤碱对小菜蛾的中肠组织上皮细胞有明显作用。中毒初期先作用于围食膜,深度中毒试虫的围食膜被破坏失去保护上皮细胞的功能,造成中肠上皮细胞被破坏而致死。
2.3 7-脱甲氧基娃儿藤碱对小菜蛾消化酶活力的影响
按照以上方法分别测试了中毒试虫和对照试虫体内淀粉酶、蛋白酶和脂肪酶的活性,结果如表2。
2.00mg/mL 7-脱甲氧基娃儿藤碱处理组及对照组淀粉酶活力差异显著(F3,8=175.96,P<0.0001)。处理24 h 淀粉酶活力与对照无差异;处理48 h 淀粉酶活力明显下降,抑制率达到71.8%,与处理后24 h 相比,处理48 h 酶活力下降了26.0%。
2.00mg/mL 7-脱甲氧基娃儿藤碱处理组及对照组蛋白酶活力差异显著(F3,8=2379.92,P<0.0001)。处理后24 h 对蛋白酶活力抑制率为87.1%;处理48 h 抑制率为93.4%。与处理后24 h相比,处理48 h 蛋白酶活力下降了66.8%。

图1 7-脱甲氧基娃儿藤碱对小菜蛾中肠的影响Fig.1 Effects of 7-demethoxytylophorine on midgut tissues of 3th instar larvae of P.xylostella
2.00mg/mL 7-脱甲氧基娃儿藤碱处理组及对照组脂肪酶活力差异显著(F3,8=2042.23,P<0.0001)。处理24 h 后对脂肪酶活力的抑制率为67.0%;处理48 h 后抑制率为89.2%,与处理后24 h 相比,处理48 h 脂肪酶活力下降了53.2%。

表2 7-脱甲氧基娃儿藤碱对小菜蛾消化酶活力的影响Table 2 Effect of 7-demethoxytylophorine on the activity of digestive enzymes of 3th instar larvae of P.xylostella
3 结论
7-脱甲氧基娃儿藤碱对小菜蛾有较好的胃毒活性,但活性作用较慢,活性随药液浓度的增加和处理时间延长而增强。药液浓度为8.00 mg/mL 时,处理7 d 的死亡率为76.67%,相应的LC50为2.60 mg/mL。中毒后的小菜蛾应激性很低,生长速度明显减缓,化蛹率也明显降低,仅为10% (对照为93%)。死亡试虫虫体水肿、变黑,体型呈不规则的“V”字或者“1”字型。
7-脱甲氧基娃儿藤碱对小菜蛾的胃毒活性可能与其对小菜蛾消化系统的破坏和酶的抑制有关。7-脱甲氧基娃儿藤碱处理后的小菜蛾幼虫中肠杯状细胞受损,围食膜不同程度被破坏,试虫死亡可能与中肠上皮细胞破坏有关。同时,中毒试虫的淀粉酶、蛋白酶和脂肪酶的活性均受到不同程度的抑制,但低浓度的药液对处理初期小菜蛾的取食活动影响较小,这与实验切片中观察到的肠内食物滞留使得中肠与对照相比变粗的情况一致,处理24 h 后小菜蛾取食减缓应与消化酶活性降低有关。药剂对昆虫消化系统的破坏,必将导致昆虫营养不良,生长发育受阻乃至死亡。
1 Fang SD (方圣鼎),Zhang R(张瑞),Chen Y(陈燕),et al.The chemical constituents from Cynanchum komarovii AL.iljinski.Acta Botan Sin (植物学报),1989,31:934-938.
2 Wang QM(汪清民),Yao YC(姚宇澄),Huang RQ(黄润秋),et al.Antiviral activity of antofine from Cynanchum komarovii.Agrochemicals (农药),2007,6:425-427.
3 Gibson DM,Krasnoff SB,Biazzo J,et al.Phytotoxicity of antofine from Invasive Swallow-Worts.J Chem Ecol,2011,37:871-879.
4 Gao W,Chen AP,Leung CH,et al.Structural analogs of tylophora alkaloids may not be functional analogs.Bioorgan Med Chem Lett,2008,18:704-709.
5 Min HY,Chung HJ,Kim EH,et al.Inhibition of cell growth and potentiation of tumor necrosis factor-a (TNF-a)-induced apoptosis by a phenanthroindolizidine alkaloid antofine in human colon cancer cells.Biochem Pharmacol,2010,80:1356-1364.
6 Yan GJ(剡根姣),Yang ML(杨敏丽),Li JT(李建涛).Investigate on the common-toxicity of Cynanchum komarovii-Sophora alopecuroides mixtures against Diamondback Moth.Nat Prod Res Dev(天然产物研究与开发),2012,24:969-971.
7 Guo H,Yang M,Qi Q.Insecticidal and antifeedant effects of two alkaloids from Cynanchum komarovii against larvae of Plutella xylostella L.J Appl Entomol,2014,138:133-140.
8 Li JB(李进步),Fang LP(方丽平),Xue JP(薛建平),et al.The bioactivity of ethanol extracts of Pinellia ternate against Plutella xylostella.Chin Agric Sci Bull (中国农学通报),2009,25:223-227.
9 Xiong ZY(熊正燕),Zhou Q(周琼),Yu DC(余定椿).Technique of paraffin slices of insect intestine.Insect Research in Central China,Vol.Ⅵ(华中昆虫研究,第6 卷).Changsha:Central South University Press,2010.95-98.
10 Zhou L(周琳),Ma ZQ(马志卿),Feng JT(冯俊涛),et al.Effects of the total alkaloid from Tripterygium wilfordii Hook on ultrastructure of the midgut cells and the digestive enzyme activities of Mythimna separata (Walker)larvae.J Henan Agric Univ (河南农业大学学报),2009,43:418-421.
11 Podoler H,Applebaum SW.The (-amylase of the beetle Callosobruchus chinensis properties.Biochem J,1971,121:321-325.
12 Singleton VL,Rossi JA.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents.Am J Enol Viticul,1965,16:144-158.
13 Zhang X(张兴),Zhao SH(赵善欢).Effects of activity of several Pieris rapae L.enzymes by Toosendanin.Acta Entomol Sin(昆虫学报),1992,35:171-177.

