东极海洋牧场厚壳贻贝筏式养殖区可移出碳汇能力评估
梁 君,王伟定,虞宝存,毕远新
(浙江省海洋水产研究所,农业部重点渔场渔业资源科学观测实验站,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
东极海洋牧场厚壳贻贝筏式养殖区可移出碳汇能力评估
梁 君,王伟定,虞宝存,毕远新
(浙江省海洋水产研究所,农业部重点渔场渔业资源科学观测实验站,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
大规模贝类养殖对近海的碳循环过程产生了重要影响,形成了一个“可移出的碳汇”。根据2013年4月-2014年2月对东极海洋牧场厚壳贻贝筏式养殖区Ⅰ龄个体跟踪调查数据,评估了厚壳贻贝和附着生物的固碳量,并进行了固碳速率的标准化处理。研究显示,一个养殖周期内筏式养殖区厚壳贻贝和附着生物固碳量分别为102.24 t和4.88 t,其固碳速率分别为5.43 tC/(hm2·a)和0.26 tC/(hm2·a);筏式养殖区减排CO2的生态服务价值量为37.17万元;贝壳和软组织的湿重比、含水率和碳含量差异均不显著(P〉0.05),能使核算养殖贝类碳汇能力的程序简单化,本研究的方法和结论可用于评估其他海域养殖厚壳贻贝的固碳量;东极海洋牧场附着生物移出碳量为厚壳贻贝的4.77%,在筏式养殖区生态系统碳循环中的作用亦不可忽视。
东极;海洋牧场;厚壳贻贝;固碳量;可移出碳汇;生态服务价值
我国是海水养殖大国,养殖面积和产量均居世界首位,从海水养殖方向促进“低碳转型”是重要的可行路径之一[1]。唐启升院士发现贝类养殖是形成渔业碳汇的重要来源之一[2]。周毅等[3-4]指出大规模贝类养殖对近海的碳循环过程产生了重要影响,形成了一个“可移出的碳汇”。随着全球温度的升高,海洋呈酸化趋势,海洋吸收CO2的能力将会发生改变[5]。利用养殖贝类来固定和移出海洋中的C,是一种比较有潜力的方法[6]。养殖贝类通过两种促进生长的方式使用海洋C,一种方式是利用海水中的HCO3-形成CaCO3躯壳,也就是贝壳;另一种方式是通过滤食摄取水中的悬浮颗粒有机碳(包括浮游植物和颗粒有机碎屑等),促进贝类个体软组织的生长。因此,有必要考虑如何从海洋中移出C,以促进海洋对CO2的吸收。
随着贝类养殖碳汇的研究不断深入,目前相关研究主要集中在2个方面:一是我国近海养殖贝类的碳汇形成机理与碳汇量核算;二是借助贝类养殖的碳汇功能,为未来渔业发展提供方向[7-10]。但是,当前的研究多偏重于理论推算,关于养殖贝类固碳潜力的报道很少[6,11-12],而且现有固碳量的计算仅考虑到生物固碳时间轴上某个特殊时间点的C含量,例如采捕时移出C,而忽视了贝类自身(贝壳和软组织)生长过程中积累的C含量。
浙江舟山群岛新区作为首个以海洋经济为主题的国家级新区,东极海洋牧场是舟山群岛新区首个碳汇实验区,在当前温室气体排放引起全球性气候变化的大背景下,先行先试探索发展渔业碳汇具有非常独特的战略价值。本文根据2013年4月-2014年2月对东极海洋牧场厚壳贻贝Mytiluscoruscus筏式养殖区Ⅰ龄个体的跟踪调查数据,在小尺度内对筏式养殖区可移出碳汇能力进行评估,以期为我国“碳汇”核算标准的制定提供数据支撑。
1 材料与方法
1.1 材料
厚壳贻贝和附着生物均采自于东极海洋牧场筏式养殖区,见图1矩形区,边界点分别为A1(30°11.324'N,122°40.853' E)、A2(30°10.972'N,122°40.941'E)、A3(30°11.002'N,122°41.120'E)和A4(30°11.354'N,122°41.033'E),养殖区面积为22.67 hm2,实际吊养约9 700串苗绳,苗绳间距1m,平均每根苗绳长度2.5 m。2013年4月-2014年2月记录了Ⅰ龄个体从包苗到收获(C移出)的全部过程(本文简称“养殖周期”),跟踪调查6次(偶数月调查)。
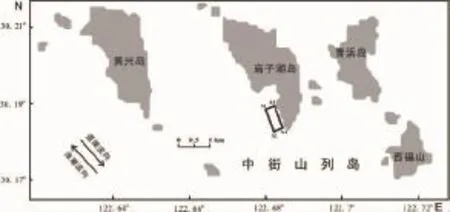
图1 调查区域示意图Fig.1 Sampling zone of Dongji
1.2 方法
1.2.1 养殖贝类碳汇能力评估
岳冬冬等[13]提出的海水养殖贝类碳汇核算流程中“转换系数”不容易直接获取,而软体组织和贝壳含水率可通过实验室测定获得,则变换后的贝类碳汇核算流程如图2。
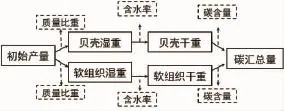
图2 海水养殖贝类碳汇核算流程(仿自文献[13])Fig.2 Carbon sink accounting process of mariculture shellfish(Cited from reference 13)
贝类固碳量评估采用TANG等[6]方法的变换式:C贝壳=产量×壳湿重比×(1-壳含水率)×壳碳含量;C软组织=产量×软组织湿重比×(1-软组织含水率)×软组织碳含量。厚壳贻贝产量=苗绳总数量×单个苗绳贻贝个数×单个贻贝重量。
由于苗绳长短不一,且受自然不可控因素影响(部分苗绳上附着贻贝不完整),为了便于计算,将长短不一和附着不完整的苗绳贻贝附着个数全部折算成2.5 m绳长附着个数,并随机取样3次取平均值。跟踪调查每次取样30个,共取样180个,样品取回实验室后,用剪刀剪去厚壳贻贝样品壳外的足丝,仔细洗净贝壳表面的污物及附着生物,用干毛巾擦干贝壳体表水至肉眼看不到水渍,然后用上海浦春计量仪器有限公司生产的JY1002型号电子天平称量(精度0.01 g)单个贻贝湿重;用于检测的样品于60℃烘干至恒重,称重,软体部和贝壳部粉碎至100目,用Elementar Vario ELⅢ型全自动CHN元素分析仪测定C含量(精度≤0.1%);使用电热恒温鼓风干燥箱参照GB 5009.3-2010[14]的方法测定含水率。
1.2.2 附着生物碳汇能力评估
东极海洋牧场贝类养殖方式为吊养,以苗绳为主,这种养殖设施为附着生物提供了附着基[15]。牧场区内附着生物主要有网纹藤壶Balanus reticulatus、薮枝螅Obeliasp.、覆瓦小蛇螺Serpulorbis imbricata等,其中贝类表面和苗绳上附着物常年以网纹藤壶或薮枝螅为主,这些种类具有石灰质的躯壳或能分泌石灰质外骨骼,也起到了固定和储存C的效果。COLIN[16]提出水螅体的死亡主要来自其他底栖生物,如藤壶、海鞘等栖息地的竞争,通过跟踪调查发现6-11月贝类表面和苗绳上附着生物以网纹藤壶为主,12月-翌年5月以薮枝螅为主。
附着生物固碳量首先需解决附着生物量的问题[6,17]。苗绳上附着生物量=取样总重量-贝类重量-苗绳重量。其中,取样总重量由现场随机取样3次测得平均值,苗绳净重取1.25 kg。
网纹藤壶固碳量采用贝类的算法,薮枝螅固碳量评估采用C薮枝螅=生物量×(1-组织含水率)×组织碳含量。湿重、含水率和C含量测定和分析方法与贝类相同。
1.2.3 固碳速率的标准化处理
以陆生植物广泛使用的固碳单位[tC/(hm2·a)]为基准,将厚壳贻贝和附着生物的固碳速率换算为标准固碳单位tC/(hm2·a)[18]。本研究中厚壳贻贝2013年4月包苗,2014年2月收获(C移出),养殖周期为10个月,计算固碳速率时折算成0.83a(10/12=0.83)。因此,固碳速率(CV)的计算公式为:CV=CX/(22.67 hm2*0.83 a)=0.053CX,其中,CX表示研究对象的固碳量(t)。
1.2.4 价值量评估
对筏式养殖区碳汇能力价值量的计算,采用瑞典的碳税率进行评估,其数值为150美元/t[19]。
2 结果与分析
2.1 养殖贝类碳汇能力
随着厚壳贻贝壳长和体重的不断增长,为了解不同规格(各次调查随机样本)厚壳贻贝的贝壳和软组织湿重比、含水率和碳含量的变化,对6种规格的厚壳贻贝各参数测定结果见表1。通过One-Way ANOVA检验发现不同规格间厚壳贻贝的贝壳和软组织湿重比、含水率和碳含量差异均不显著(P>0.05),以下分析采用各参数平均值进行样本分析。
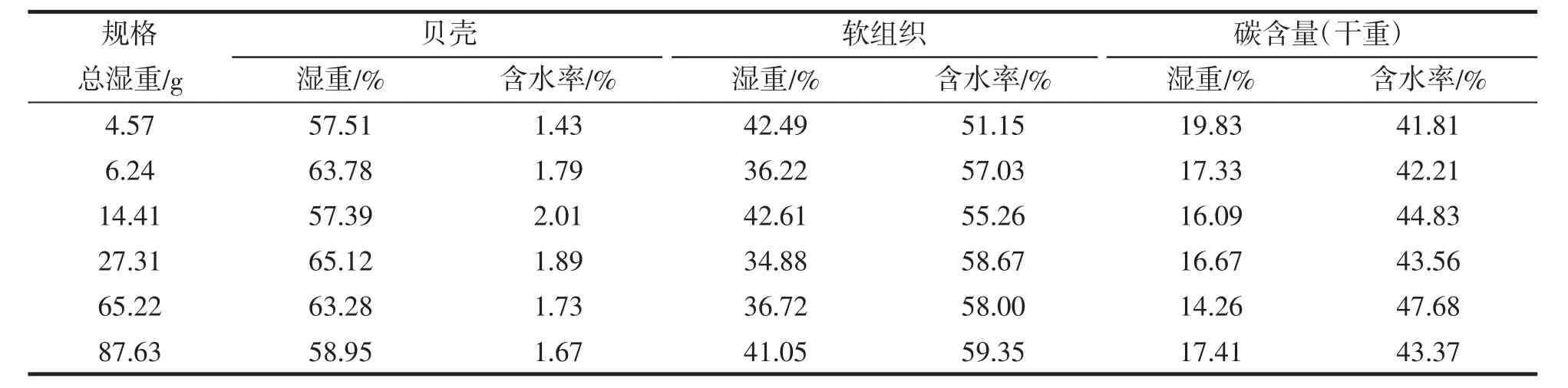
表1 不同规格厚壳贻贝平均湿重比、含水率和碳含量Tab.1 Average wet weight ratios,water contents and carbon contents ofM.coruscus betweendifferent sizes
对不同月份厚壳贻贝生物量和固碳量测算结果见表2。由表2可以看出,厚壳贻贝经过一个生长周期,可形成产出量302.91 t(2014年2月收获时生物量)。随着厚壳贻贝贝壳和体重增长,养殖期贝壳新增固碳量为28.27 t(不同时间节点间贝壳固碳量差值之和,下同),软组织新增固碳量为20.71 t。由于2014年2月收获,通过贝壳移出C含量为30.74 t,软组织移出C含量为22.52 t。因此,一个养殖周期筏式养殖区厚壳贻贝固碳量为102.24 t(新增固碳量和收获移出C含量之和),厚壳贻贝固碳速率可折算成标准固碳单位为5.43 tC/(hm2·a),其中,贝壳固碳速率为3.13 tC/(hm2·a)。

表2 不同月份厚壳贻贝体重、生物量和固碳量Tab.2 Body weight,yield and carbon sequestration ofM.coruscusin different months
2.2 附着生物碳汇能力
对网纹藤壶和薮枝螅的各参数测定结果见表3。以网纹藤壶附着时长为半年计算,可形成平均附着量33.02 t,考虑其2013年6月出现和11月季节更替死亡(未移出),若不计网纹藤壶软组织腐化(释放碳)和被摄食(固碳),网纹藤壶通过钙质外壳和体重增长过程,可形成新增固碳量为4.59 t(外壳固碳4.18 t,软组织固碳0.41 t)。薮枝螅平均附着量为11.80 t,随着厚壳贻贝收获,薮枝螅一并被移出,薮枝螅可移出C含量为0.29 t。因此,一个养殖周期筏式养殖区附着生物固碳量为4.88 t(网纹藤壶新增固碳量和薮枝螅移出C含量之和),折算成标准固碳单位为0.26 tC/(hm2·a)。

表3 网纹藤壶和薮枝螅的湿重比、含水率和碳含量Tab.3 Wet weight ratios,water content and carbon content of Balanus reticulatus and Polyps
2.3 养殖区可移出碳汇价值量评估
一个养殖周期调查贝类和附着生物共移出的C含量为107.12 t,折合CO2当量为393.13 t(即减排CO2量)。采用瑞典的碳税率进行评估,筏式养殖区减排CO2的生态服务价值量为5.90万美元(按1美元=6.3人民币兑换),折合人民币37.17万元。
3 讨论
3.1 可移出碳汇潜力
厚壳贻贝和网纹藤壶碳汇过程包括钙化和生物同化2个方面,即前文提及的贝壳生长和软组织生长过程中利用水体中C。根据唐启升[2]对渔业碳汇的定义,即通过渔业生产活动促进水生生物吸收水体中的CO2,并通过收获把这些已经转化为生物产品的C移出水体的过程、活动和机制,可见,东极海洋牧场筏式养殖是典型的渔业碳汇。
准确评估我国养殖贝类可移出C含量具有重要的现实意义。东极海洋牧场筏式养殖区厚壳贻贝经过一个生长周期,即可达到商品规格,通过收获可从海区移出102.24 tC,其固碳速率为5.43 tC/(hm2·a)。本研究通过对养殖厚壳贻贝固碳的标准化处理,增加了与其他生态系统固碳能力的可比性。由于舟山属亚热带季风气候,按照我国亚热带森林的固碳速率2.84 tC/(hm2·a)[20]计算,东极海洋牧场厚壳贻贝筏式养殖区相当于营造1.91hm2亚热带森林。与其他生态系统固碳速率相比,为水库的1.36倍,滨海湿地植被的1.55倍[21],红树林湿地的3.36倍[22-23],全国天然林的3.88倍[24]。
本研究发现,随着厚壳贻贝个体生长,其贝壳和软组织湿重比、含水率和碳含量差异均不显著(P>0.05),这一结果与栉孔扇贝Chlamys farreri、紫贻贝Mytilus edulis和太平洋牡蛎Crassostrea gigas等滤食性贝类的C含量差异不显著的结论一致[6],能使核算养殖贝类碳汇能力的程序趋于简单化。结合周毅等[25]提出的不同海区滤食性贝类软体组织和贝壳中碳含量差异不显著的研究结论,可参照本研究方法和结论对其他海域养殖厚壳贻贝的碳汇能力进行评估。
此外,本研究仅计算了吊养贝类苗绳上附着生物的固碳量,而筏架用绳和浮子上附着生物由于无法取样而未计算在内。此外,通过C移出,附着生物移出C含量为厚壳贻贝的4.77%。因此,附着生物在筏式养殖区生态系统碳循环中的作用不可忽视,东极贝类筏式养殖区实际利用和移出的C含量远超过估计值。
3.2 养殖贝类固碳效果的生态服务价值
本研究采用碳税率对生态服务价值量进行了评估。挪威政府的碳税为227美元/tC,美国的碳税为15美元/tC[26];2008年瑞典的税率为166美元/tC,芬兰为31美元/tC[27];我国的造林成本费用是以1990年不变价格260.91元/tC计算的,计算结果偏低。因此,笔者认为采用瑞典碳税率比较适中。通过收获可从海区移出CO2当量为393.13 t,筏式养殖区减排CO2的生态服务价值量为人民币37.17万元,贝类养殖不仅可以直接提供产品,还增加了碳汇,具有显著的经济效益。若该海域管理到位,这种生态价值将可持续利用,东极海洋牧场贝类筏式养殖区可以在未来开展碳交易过程中发挥先行先试的作用,若政府成立绿色碳基金,吸纳企业“购买碳汇”,5年之内即可收回政府在东极海洋牧场的公益性投资。
3.3 贝类固碳意义及未来研究方向
陆地上的草原和森林等植物对C的固定和封存的影响是短期的,在短时间内即腐烂分解,储存的C又被释放到大气中。相比之下,贝壳中的C主要以CaCO3的形式存在,封存的C经再循环回到大气中需要数百万年的时间。此外,与草原和森林相对成熟的碳汇计量方法与体系相比,渔业碳汇建立统一的碳汇计量体系和标准有其特殊性,而影响渔业固碳效果的因素较多,如养殖种类、养殖面积、养殖方式、养殖地点、养殖海域环境等,均给碳汇核算带来较大的困难。因此,需要建设相关实验室或成立相关碳汇计量、监测评估和核查机构以对渔业碳汇核算体系进行深入研究。
贝类是近海生态系统中物质流和能量流的驱动者。它通过强烈的滤食活动,大量摄食海水中的有机碳,有效控制浮游植物生物量,加速其再生,从而促进了海水无机碳向有机碳的转换[28-29],其摄食物未消化部分,则以生物沉积物的形式沉降,将大量的有机碳输送到海底[30-32]。本研究仅探讨了通过厚壳贻贝收获移出碳汇量,下一步将把厚壳贻贝对浮游植物的“下行控制效应”和颗粒有机碳生物沉积考虑在内,进行筏式养殖区综合碳汇能力的评估,这对于扩增海域碳汇潜力具有重要的意义。
[1]岳冬冬.海带养殖结构变动与海藻养殖碳汇量核算的情景分析[J].福建农业学报,2012(4):432-436
[2]唐启升.碳汇渔业与又好又快发展现代渔业[J].江西水产科技,2011(2):5-7.
[3]周 毅,杨红生,毛玉泽,等.桑沟湾栉孔扇贝生物沉积的现场测定[J].动物学杂志,2003,38(4):40-44.
[4]ZHOU Y,YANG H S,ZHANG T,et al.Influence of filtering and biodeposition by the cultured scallopChlamys farrerion benthic-pelagic coupling in a eutrophic bay in China[J].Marine Ecology Progress Series,2006,317:127-141.
[5]REHDANZ K,TOL R S J,WETZEL P.Ocean carbon sinks and international climate policy[J].Energy Policy,2006,34(18): 3 516-3 526.
[6]TANG Q S,ZHANG J H,FANG J G.Shellfish and seaweed mariculture increase atmospheric CO2absorption by coastal ecosystems[J].Marine Ecology Progress Series,2011,424:97-104.
[7]肖 乐,刘禹松.碳汇渔业对发展低碳经济具有重要和实际意义碳汇渔业将成为新一轮渔业发展的驱动力[J].中国水产, 2010(8):4-8.
[8]岳冬冬,王鲁民.基于直接碳汇核算的长三角地区海水贝类养殖发展分析[J].山东农业科学,2012,44(8):133-136.
[9]齐占会,王 珺,黄洪辉,等.广东省海水养殖贝藻类碳汇潜力评估[J].南方水产科学,2012,8(1):30-35.
[10]虞宝存,梁 君.贝藻类碳汇功能及其在海洋牧场建设中的应用模式初探[J].福建水产,2012,34(4):339-343.
[11]张继红,方建光,唐启升.中国浅海贝藻养殖对海洋碳循环的贡献[J].地球科学进展,2005,20(3):359-365.
[12]张明亮,邹 健,毛玉泽,等.养殖栉孔扇贝对桑沟湾碳循环的贡献[J].渔业现代化,2011,38(4):13-16.
[13]岳冬冬,王鲁民.中国海水贝类养殖碳汇核算体系初探[J].湖南农业科学,2012,(15):120-122.
[14]中华人民共和国卫生部食品卫生监督检验所.GB/T 5009.3—2010食品中水分的测定[S].北京:中国标准出版社,2010:1-6.
[15]LÜTZEN J.Styela clavaHerdman(Urochordata,Ascidiacea),a successful immigrant to North West Europe:ecology,propagation and chronology of spread[J].Helgol nder Meeresuntersuchungen,1999,52(3/4):383-391.
[16]COLIN S P,KREMER P.Population maintenance of thescyphozoan cyaneasp.settled planulae and the distribution of medusae in the Niantic River,Connecticut,USA[J].Estuaries and Coasts,2002,25(1):70-75.
[17]岳冬冬,王鲁民.我国海水养殖贝类产量与其碳汇的关系[J].江苏农业科学,2012,40(11):246-248.
[18]张继红,方建光,唐启升,等.桑沟湾不同区域养殖栉孔扇贝的固碳速率[J].渔业科学进展,2013,34(1):12-16.
[19]欧阳志云,赵同谦,赵景柱,等.海南岛生态系统生态调节功能及其生态经济价值研究[J].应用生态学报,2004,15(8):1 395-1 402.
[20]吴庆标,王效科,段晓男,等.中国森林生态系统植被固碳现状和潜力[J].生态学报,2008,28(2):517-524.
[21]张绪良,张朝晖,徐宗军,等.黄河三角洲滨海湿地植被的碳储量和固碳能力[J].安全与环境学报,2012,12(6):145-149.
[22]ALONGI D M,WATTAYAKORN G,PFITZNER J,et al.Organic carbon accumulation and metabolic pathways in sediments of mangrove forests in southern Thailand[J].Marine Geology,2001,179(11):85-103.
[23]TWILLEY R R,CHEN R H,HARGIS T.Carbon sinks in mangroves and their implications to carbon budget of tropical coastal ecosystems[J].Water,Air and Soil Pollution,1992,64:265-288.
[24]胡会峰,刘国华.中国天然林保护工程的固碳能力估算[J].生态学报,2006,26(1):291-296.
[25]周 毅,杨红生,刘石林,等.烟台四十里湾浅海养殖生物及附着生物的化学组成、有机净生产量及其生态效应[J].水产学报,2002,26(1):21-27.
[26]郑 伟.海洋生态系统服务及其价值评估应用研究[D].青岛:中国海洋大学,2008:78-87.
[27]汪曾涛.碳税征收的国际比较与经验借鉴[J].理论探索,2009(4):68-71.
[28]SOUCHU P,VAQUER A,COLLOS Y,et al.Influence of shellfish farming activities on the biogeochemical composition of water column in Thau Lagoon[J].Marine Ecology Progress Series,2001,218:141-152.
[29]NEWELL R I E.Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve mollusks:a review [J].Journal of Shellfish Research,2004,23(1):51-61.
[30]AHN I Y.Enhanced particle flux through the biodepostion by the Antarctic suspention-feeding bivalve Lathrnula elliptica in Marian Core,King George Island[J].Journal of Experimental Marine Biology and Ecology,1993,171(1):75-90.
[31]CHIANTORE M,CATTANEO-VIETTI R,ALBERTELLI G,et al.Role of filtering and biodeposition byAdamussium colbeckiin circulation of organic matter in Terra Nova Bay(Ross Sea,Antarctica)[J].Journal of Marine Systems,1998,17(1):411-424.
[32]MITCHELL I M.In situ biodeposition rates of Pacific oyster(Grassotrea gigas)on a marine farm in Southern Tasmania(Australia)[J].Aquaculture,2007,257(1/4):194-203.
Evaluation on Removable Carbon Sink Capability of Raft Culture Zones of Mytilus coruscus for the Marine Ranching in Dongji Islands
LIANG Jun,WANG Wei-ding,YU Bao-cun,et al
(Marine Fisheries Research Institute of Zhejiang Province,Scientific Observing and Experimental Station of Fishery Resources for Key Fishing Grounds,MOA,Key Laboratory of Sustainable Utilization of Technology Research for Fisheries Resources of Zhejiang Province,Zhoushan 316021,China)
Large-scale shellfish aquaculture had a significant influence on the carbon cycle process of coastal waters,and formed a"removable carbon sink".Based on the data of tracking survery of one-year-oldMytilus coruscusfrom April 2013 to February 2014 in the raft culture zones of Dongji marine ranching,the carbon sequestration ofM.coruscusand fouling organisms were estimated,and the carbon sequestration rates were standardized. The result showed that the carbon sequestration ofM.coruscusand fouling organisms in one year culture cyclewere 102.24 t and 4.88 t,respectively,and carbon sequestration rates were 5.43 tC/(hm2·a)and 0.26 tC/(hm2·a), respectively.The ecological service value of CO2emission reduction in the raft culture zones was estimated to be 371 700 RMB.There were no significant difference on wet weight ratios,water content and carbon content of shells and soft tissue,which could simplify the procedure of accounting the carbon sink capacity of cultured shellfish.In addition,the methods and conclusions of this study could be used to evaluate carbon sequestration of culturedM. coruscusin other waters.The carbon content removed by fouling organisms was estimated to be 4.77 percent ofM. coruscus,and the role of fouling organisms in ecosystem carbon cycle of the raft culture zones couldn’t be ignored.
Dongji islands;marine ranching;Mytilus coruscus;carbon sequestration;removable carbon sink; ecological service value
S932
A
1008-830X(2015)01-0009-06
2014-10-15
浙江省海洋经济和渔业新兴产业补助项目(浙海渔计[2012]146号);农业部渔业资源保护与转产转业项目(浙财农[2012]460号);中央分成海域使用金项目(2011-2-2-07-3);浙江省科技厅项目(2014F30023;2014F10039)
梁君(1982-),男,湖北仙桃人,工程师,研究方向:渔业生态.E-mail:junfengliang2008@hotmail.com
王伟定,教授级高工.E-mail:wdwang@sohu.com

