17α-甲睾酮对黄姑鱼幼鱼生长及性分化的影响
林家豪,陈睿毅,楼 宝,徐冬冬,詹 炜,毛国民,等
(1.浙江海洋学院水产学院,浙江舟山 316022;2.浙江省海洋水产研究所,浙江舟山 316021;3.浙江省海水增养殖重点实验室,浙江舟山 316021;4.浙江省乐清市海洋与渔业局,浙江乐清 325600)
17α-甲睾酮对黄姑鱼幼鱼生长及性分化的影响
林家豪1,陈睿毅2,3,楼 宝2,3,徐冬冬2,3,詹 炜2,3,毛国民2,3,等
(1.浙江海洋学院水产学院,浙江舟山 316022;2.浙江省海洋水产研究所,浙江舟山 316021;3.浙江省海水增养殖重点实验室,浙江舟山 316021;4.浙江省乐清市海洋与渔业局,浙江乐清 325600)
利用不同浓度的17α-甲睾酮(MT)(0.5、1、5、10 μg/L)对25日龄的雌核发育黄姑鱼进行浸浴处理,每日2 h,连续处理75 d,用以研究MT对其生长、死亡率和性分化的影响。实验结果表明,在雌核发育黄姑鱼孵化后25日龄至100日龄用17α-甲基酮进行浸浴处理均可使其转化成伪雄鱼。外源性MT对黄姑鱼的生长有抑制作用,与对照组差异显著(P≤0.05),但对其生存率并无显著影响(P≥0.05);各MT实验浓度对雌核发育黄姑鱼幼鱼都有性逆转作用,性逆转时间5 μg/L最早,比正常黄姑鱼提前了4 d。
17α-甲睾酮;黄姑鱼;性分化
黄姑鱼Nibea albifloraRichardson俗称黄婆鸡、黄姑子,隶属鲈形目Perciformes、石首鱼科Sciaenidae、黄姑鱼属Nibea。黄姑鱼为暖水性中下层鱼类,在我国沿海均有分布,其肉质鲜美,营养丰富,历来是渔民的主要捕捞对象。但近年来,由于海洋环境遭到破坏和渔民的滥捕滥捞,其渔业资源急剧衰减,野生黄姑鱼的产量已远远不能满足市场的需求,因此人们开始进行人工养殖。在人工养殖过程中发现,雌性黄姑鱼要比雄性黄姑鱼生长速度快20%[1],那么实现黄姑鱼的全雌化养殖对于黄姑鱼的养殖业就显得尤为重要。徐冬冬等[2]利用雌核发育的方法诱导了全雌的黄姑鱼苗种,但诱导率极低,不适用于大规模苗种繁育。而在此基础上,以雌核发育黄姑鱼为材料,利用17α-甲睾酮(MT)对其进行诱导,获得生理雄性、遗传雌性的伪雄鱼,性成熟后再与雌鱼交配即可规模化得到全雌苗种。
利用雄性激素对鱼类进行性别控制的研究早有报道[3-4]。GRANT等[5]分别利用17α-甲睾酮(MT)和11β-烯二酮(OHA)对虹鳟Oncorhynchus mykiss进行了伪雄鱼的诱导研究,结果表明MT浸泡比OHA(400 μg/L)浸泡可以获得更高的雄性率。KERSTIN等[6]对1龄乌鳍石斑鱼Epinephelus marginatus进行MT(11 mg/kg)植入,12周后观察到其发生性转变。MERCEDES等[7]用MT含量为10 mg/kg的饲料饲喂欧洲鲈鱼Dicentrarchus labrax,发现从126日龄开始饲喂。连续饲喂100可以获得93%~100%的雄性率,而晚于该阶段雄性率则不会出现显著变化。FEIST等[8]对虹鳟进行MT浸泡与MT浸泡与投喂相结合实验,结果通过浸泡与投喂相结合性转化成的伪雄鱼通常没有输精管,而单独浸泡MT产生的伪雄鱼通常具有输精管。雌性激素也常用来诱导鱼类雌性化的产生[9]。YAMAMOTO[10]利用17β-雌二醇采用浸泡法对雌核发育牙鲆Paralichthys olivaceus进行了雌性诱导的研究,获得了100%的雌性率。由此可见,无论是浸泡法,还是饲喂法,利用外源激素均能达到性别控制的目的,但是浸泡法更有利于输精管的形成。
目前,尚未有关于雄性激素对黄姑鱼性别分化与生长影响的相关报道。本研究拟通过MT浸泡雌核发育黄姑鱼稚鱼,观察实验鱼性分化与生长等性状,检验甲睾酮是否会对幼鱼产生影响,以期为今后黄姑鱼伪雄鱼制备提供技术参考。
1 材料与方法
1.1 实验材料
2014年6月份于浙江省海洋水产研究所西闪试验场,参考徐冬冬等[2]的方法制备雌核发育黄姑鱼。用500 L的玻璃钢水槽进行孵化、养殖,水温21±0.5℃,盐度20~21,水深30 cm。试验前期投喂轮虫、丰年虫和桡足类,25日龄(4.363 3±0.004 6 g,0.688 9±0.004 8 cm)时开始投喂配合饲料,早中晚3次,定时投喂,饱食。
1.2 实验方法本实验采用雄性激素浸泡法,设置4个实验组,每组3个平行,每个平行150尾鱼苗,激素浓度分别为0.5、1、5和10 μg/L,1个阴性对照组,用同浓度的乙醇处理;1个空白对照组,不做任何处理。MT(1 g,纯度:≥95%,Matrix)购自上海研生实业有限公司,先用分析纯无水乙醇溶解,配置成1×105μg/L的母液。每天下午2点开始浸泡,持续2 h,按不同激素浓度添加不同体积的激素母液,浸泡结束后,充分换水,保证激素无残留。从25日龄开始取样,每5天取样1次,至100日龄结束。测量其体重和全长后,置于玻恩氏液中固定,经梯度乙醇脱水,二甲苯透明和石蜡包埋后,作连续切片,切片厚度为5~8 μm,HE染色,光学显微镜(LEICA DM4000B显微镜,Shineso MIC型显微图像分析系统)观察拍照鉴定其性别。
1.3 分析方法
利用SPSS19.0统计软件的One-Way ANOVA的分析方法对数据进行统计分析。
2 结果与分析
2.1 17α-甲睾酮对黄姑鱼生长的影响
从图1可以看出,在外源MT的影响下,4个实验组黄姑鱼的体重均受到不同程度的抑制,其中尤以10 μg/L激素浓度下抑制最为明显,70日龄后体重增长趋势明显减缓;其平均特定增长率仅为3.51 g,远小于对照组4.14 g(表1)。黄姑鱼在30日龄时,体重与全长均未存在显著差异;70日龄时,空白组和对照组无显著差异,4个实验组的体重均与空白组和对照组存在显著差异(P≤0.05),且0.5、1和5 μg/L 3组与10 μg/L组也存在显著差异;100日龄时,10 μg/L处理组的体重远小于其它组,且差异性显著(P≤0.05)(表1)。
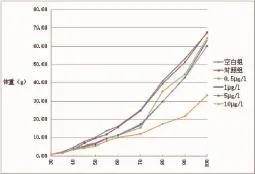
图1 17α-甲睾酮对黄姑鱼生长的影响Fig.1 The effect of 17α-Methyltestosterone onN.albifloragrowth

表1 17α-甲睾酮对黄姑鱼生长影响的显著性检验Tab.1 Results of chi-squared analyses for growth after 17α-Methyltestosterone treatment
2.2 17α-甲睾酮对黄姑鱼死亡率的影响
在实验过程中发现黄姑鱼出现死亡,累计死亡率见表2,对照组和实验组的累计死亡率均低于9%。方差分析结果显示,各组之间的死亡数并无显著差异,表明MT的处理并未对黄姑鱼的死亡产生显著影响(P≥0.05)。

表2 17α-甲睾酮处理后黄姑鱼的累计死亡率Tab.2 The cumulative mortalities ofN.albifloraup to 100 days after 17α-Methyltestosterone treatment

表3 17α-甲睾酮处理后黄姑鱼累计死亡数的方差分析Tab.3 Results of one-way ANOVA forN.albifloracumulative mortalities after 17α-Methyltestosterone tretment
2.3 17α-甲睾酮对黄姑鱼性分化的影响
黄姑鱼25日龄与30日龄的性腺横切片中,各实验组无区别,都观察到黄姑鱼原始性腺出现,位于鱼鳔下方与肠管之间,左右各有一个原始性腺(图2:a)。40日龄时,对照组和空白组的性腺横切片观察到黄姑鱼生殖细胞和体细胞通过有丝分裂大量增殖,向性腺腹腔聚拢,形成卵巢腔的雏形(图2:c),从细胞学上证明这种性腺已决定并向卵巢方向分化。
在45日龄的黄姑鱼性腺横切片中,5 μg/L激素处理组观察到壶腹状的输精管原基、精原细胞,精母细胞和血管(图2:f)。
在55日龄的黄姑鱼性腺横切片中,0.5 μg/L激素处理组和1 μg/L激素处理组黄姑鱼首次观察到呈壶腹状的输精管原基,前者具有较多精原细胞,还观察到血管和很少一部分周边核仁期的卵母细胞(图2:d);后者体积明显较大,具有一定数量的精原细胞和精母细胞,若干个周边核仁期的卵母细胞(图2:e)。
在80日龄的黄姑鱼性腺横切片中,10 μg/L激素处理组黄姑鱼中同时具有输精管、精小叶、精原细胞、精母细胞和较多数量的周边核仁期的卵母细胞(图2:h)。
100日龄时,空白组与对照组的性腺横切片示卵巢(图2:i-j);各激素浓度组(0.5、1、5和10 μg/L)的性腺横切片皆示精巢(图2:k-n)。

图2 黄姑鱼性分化过程Fig.2 Sex differentiation process ofN.albiflora
3 讨论
3.1 对生长的影响
性类固醇激素具有调节脑垂体刺激生长激素分泌的作用[6],而鱼类生长激素是在鱼类机体生长发育起关键作用的调节因子,可以刺激组织发育,影响鱼类生长[11]。研究表明[12],对60 pdf的黑鲈Dicentrarchus labrax进行投喂MT(10 mg/kg),200 d后其平均体重比对照组低55%,差异显著(P≤0.05)。无独有偶,JORDI等[13]发现每天投喂OHA含量为10 mg/kg的饲料,塞内加尔鳎Solea senegalensis的生长受到明显的抑制。本实验中,空白组和对照组的黄姑鱼生长并无显著差异,因此可以排除其受到乙醇影响的可能。在30日龄时,黄姑鱼体重与全长无显著差异,而在养至70和100日龄时,4个实验组的体重与全长均小于对照组,且差异显著(P≤0.05),表明养殖水体中添加MT会抑制黄姑鱼早期的生长。3个实验组(0.5、1和5 μg/L)的生长虽低于空白组和对照组,但3组之间并无显著差异(P≥0.05),表明在一定浓度范围内,随着MT浓度的升高,黄姑鱼的生长不会受到影响。而高浓度(10 μg/L)处理组的特定生长率最小,尤其在70日龄后,体重增长极为缓慢,推测原因可能是高浓度的外源激素影响黄鱼类的摄食和代谢能力,从而抑制鱼体生长[14]。
3.2 对死亡率的影响
有研究表明,当激素浓度在某一范围内时对鱼类成活率无显著影响,但在超过某个阈值后,鱼类的成活率将会显著降低[12]。KNORR等[15]对日本青鳉Oryzias latipes进行辛基酚处理发现,当处理浓度≥2 μg/L时死亡率升高20%~30%。同样,在诱导香鱼性转换的研究中发现,随着苯甲酸强力春情素浓度的增加,其死亡率也逐步升高[16-17]。本研究中,各组死亡率虽高于5%,但并未出现显著差异(P≥0.05),可见MT激素浓度在黄姑鱼耐受范围内,对其成活率不会造成影响。
3.2 对性分化的影响
研究表明,鱼类性腺受内源性激素的影响[18]。而外源激素MT则会影响卵巢的进一步发育,这一结论已在斑马鱼中得到证实[18-19]。利用MT与11β-羟雄烯二酮(OHA)均能诱导雌性虹鳟鱼性逆转为雄性虹鳟鱼[6,20]。本实验对4个不同激素浓度组处理雌核发育黄姑鱼的性腺分化情况进行组织学观察,结果表明100日龄时,4个激素处理组的性腺至均发育为精巢,雄性率为100%;而对照组和空白组则发育为卵巢,雄性率为0。但各组性腺分化时间并不同步,且在一定时间段内出现了雌雄间体的现象(图2:(d)(e)(g)(h))。本实验中,0.5 μg/L激素浓度下,黄姑鱼55日龄的性腺可同时观察到卵母细胞和输精管原基,表明外源MT对卵母细胞有抑制作用,且促进雄性生殖细胞的发育,这与卓孝磊等[20]的研究结果相似。张晓彦等[21]报道,17β-雌二醇处理后半滑舌鳎卵巢分化提前了7 d。而在本实验中,5 μg/L激素浓度下,黄姑鱼45日龄性腺开始向精巢转化,较对照组的黄姑鱼雄性性腺分化时间提前了4 d。
上述研究结果表明,在雌核发育黄姑鱼孵化后25日龄至100日龄用17α-甲基酮进行浸浴处理均可使其转化成伪雄鱼。同时外源MT对黄姑鱼的生长有抑制作用,但对其生存率无影响,而对其性腺分化有影响。
[1]徐冬冬,詹 炜,楼 宝,等.网箱养殖黄姑鱼生长特性初步研究[J].渔业现代化,2010,37(5):34-37.
[2]徐冬冬,楼 宝,薛宝贵,等.黄姑鱼(Nibea albiflora)雌核发育的人工诱导及鉴定[J].海洋与湖沼,2013,44(2):310-317.
[3]BYE V J,LINCOLN R F.Commercial methods for the control of sexual maturation in rainbow trout(Salmo gairdneriR.)[J]. Aquaculture,1986,57:299-309.
[4]HUNTER G A,DONALDSON E M,STOSS J,et al.Production of monosex female groups of Chinook salmon(Oncorhynchus tshawytscha)by the fertilization of normal ova with sperm from sex-reversed females[J].Aquaculture,1983,33:355-364.
[5]GRANT F,CHOO-GUAN Y,MARTIN S.F,et al.The production of functional sex-reversed male rainbow trout with 17αmethyltestosterone and11β-Hydroxyandrostenedione[J].Aquaculture,1995,131(4):145-152.
[6]KERSTIN S,MARIA P,SILVIA Z,et al.Permanent sex inversion in 1-year-old juveniles of the protogynous dusky grouper (Epinephelus marginatus)using controlled-release 17α-methyltestosterone implants[J].Aquaculture,2006,256:443-456.
[7]MERCEDES B,FRANCESC P,SILVIA Z,et al.Donaldson.Development of sex control techniques for European sea bass(Dicentrarchus labraxL.)aquaculture:effects of dietary 17 α-methyltestosterone prior to sex differentiation[J].Aquaculture,1995, 135(4):329-342.
[8]FEIST G,YEOH C-G,FITZPATRICK M S,et al.The production of functional sex-reversed male rainbow trout with 17αmethyltestosterone and 11 β-hydroxyandrostenedione[J].Aquaculture,1995:145-152.
[9]李文笙,林浩然.17β-雌二醇对不同性腺发育时期鲤鱼生长激素分泌的影响[J].中国实验动物学报,2003,11(2):96-102.
[10]YAMAMOTO E.Application of gynogenesis and triploidy in hirame(Paralichthys olivaceus)breeding[J].Fish Genetic Breeding Science,1992,18:3-23.
[11]KOPCHICK J J,ANDRY J M.Growth hormone(GH),GH receptor,and signao transduction[J].Molecular Genetics and Metabolism,2000(71):293-314.
[12]BLAZQUEZ M,ZANUY S,CARRILLO M,et al.Structural and functional effects of early exposure to estradiol-17βand 17αethynylestradiol on the gonads of the gonochoristic teleostDicentrarchus labrax[J].Fish Physiology and Biochemistry,1998,18: 37-47.
[13]JORDI V,ESTHER A,JOS P C,et al.Gonadal sex differentiation in the Senegalese sole(Solea senegalensis)and first data on the experimental manipulation of its sex ratios[J].Aquaculture,2013(74-81):384-387.
[14]庄 平,田美平,张 涛,等.投喂雌二醇对西伯利亚鲟幼鱼生长及血液生化指标的影响[J].海洋渔业,2010,32(2):148-153.
[15]KNORR S,BRAUNBEEK T.Deceline in reproductive success,sex reversal and development alterations in Japanese medaka (Oryzias latipes)after continuous exposure to octylphenol[J].Ecotoxicology and Environment Safety,2002,51:187-196.
[16]阮洪超,黄瑞冬.己烯雌酚诱导黑鲷幼鱼性转换[J].海洋科学,1997(6):6-7.
[17]CARLOS A,STR SSMANN M N.Morphology,endocrinology,and environmental modulation of gonadal sex differentiation in teleost fishes[J].Fish Physiology and Biochemistry,2002,26:13-19.
[18]赵春刚,范 鹏,刘 奕,等.甲基睾酮对雌性斑马鱼性腺发育的抑制作用[J].东北农业大学学报,2010,41(12):70-74. http://www.sciencedirect.com/science/article/pii/004484869400336M-COR1
[19]PIFERRER F.Endocrine sex control strategies for the feminization of teleost fish[J].Aquaculture,2001,197:229-281.
[20]卓孝磊,邹记兴,崔 科,等.外源性甲基睾丸酮对雌性和间性黄鳝性腺发育的影响[J].水生生物学报,2008,32(6):861-867.
[21]张晓彦,刘海金.17β-雌二醇对半滑舌鳎性分化和生长的影响[J].东北农业大学学报,2009,40(6):67-72.
Effects of 17α-Methyltestosterone on Growth and Sex Differentiation in Nibea albiflora
LIN Jia-hao1,CHEN Rui-yi2,3,LOU Bao2,3,et al
(1.Fishery School of Zhejiang Ocean University,Zhoushan 316022;2.Zhejiang Marine Fisheries Research Institute,Zhoushan 316021;3.Zhejiang Key Lab of Mariculture&Enhancement,Zhoushan 316021,China)
In order to study on the effects of 17α-methyltestosterone on growth,mortality and sex differentiation inNibea albiflora,the Gynogenetic larval(N.albiflora)on 25 days post hatching were treated in 17α-Methyltestosterone(0.5,1,5,10 μg/L)for 2 hours each day and lasted for 75 days.The results showed that GynogeneticN.albifloracould convert into pseudo-male after 75 days treatment with MT.Meanwhile,exogenous MT had an inhibiting effect on the growth ofN.albiflora,weight gain of which was significantly lower than that in the control group(P≤0.05),however,survival was not affected by exogenous MT(P≥0.05).The MT concentration for each experiment can reversal Gynogenetic croaker juveniles is sex,the treatment group 5 μg/L reversal sex earliest and 4 days earlier than the normalNibea.
17α-Methyltestosterone;Nibea albiflora;sex differentiation
S917.4
A
1008-830X(2015)01-0020-06
2014-10-10
浙江省科技计划项目(2012C12907-8;2013F20001);“十二五”农村领域国家科技计划课题(2012AA10A413)
林家豪(1993-),女,浙江温岭人,硕士研究生,研究方向:安全养殖工艺与技术.
楼宝,研究员.E-mail:loubao6577@163.com

