吴茱萸碱不同加药时序对胃癌SGC7901 细胞放射敏感性的影响
汉媛媛 ,张凯亮,高雪翔,李 洁,3,郭 琪,Juraev Firdavs,王 静*
1兰州大学口腔医学院,兰州 730000;2 甘肃省妇幼保健院,兰州 730050;3 天津高等医学专科学校,天津 300222
胃癌是我国常见肿瘤之一,恶性程度较高,生长快,浸润性强,转移率高,预后较差[1]。目前治疗提倡以手术、放射、化疗为主,但是放射治疗往往因其对正常组织的损伤,以及肿瘤组织对放射的抵抗限制了其临床应用[2]。作为增加肿瘤放射敏感性、提高放射治疗疗效的重要手段,应用放射增敏剂成为提高放射治疗增益比的重要手段。
吴茱萸碱(evodiamine,EVO)是芸香科植物吴茱萸近成熟果实中提取的纯天然化学成分,主要药理作用有抗炎,抗血小板凝集,镇痛,体温调节等[3]。近年来众多体内外研究表明EVO 对宫颈癌[4]、肺癌、结肠癌[5]、肝癌[6]等多种肿瘤具有抑制其生长的作用,前期实验证实EVO 对舌鳞状细胞癌Tca8113 细胞有放射增敏的作用[7],为了进一步研究EVO 对其他肿瘤细胞是否也具有放射增敏作用,并且探讨联合作用中不同的加药顺序对放射敏感性的影响是否存在差异,研究选用胃癌SGC7901 细胞,探讨EVO 联合射线对SGC7901 细胞放射敏感性的影响,并初步探讨其可能的机制,以期为胃癌临床放射增敏剂的选择提供基础研究资料。
1 材料与方法
1.1 材料
EVO 购自天津化标生物技术有限公司;RPMI-1640 培养基购自美国Gbico 公司;新生牛血清购自四季青公司;四甲基偶氮唑蓝(MTT),吉姆萨染液为武汉凌飞生物科技公司产品,碘化嘧啶(PI)购自上海生工公司;Caspase3 兔抗人多克隆抗体购自英国Abcam 公司;β-actin 兔抗人多克隆抗体购自武汉博士德公司,辣根过氧化物酶标记山羊抗兔IgG 购自北京碧云天公司。
1.2 细胞培养
胃癌SGC7901 细胞(兰州大学第一医院中心实验室提供)培养于含10%新生牛血清的RPMI-1640培养液中,另加2.2 mg/L 碳酸氢钠,1000000 U 链霉素,800000 U 青霉素。置于37 ℃、5%CO2饱和湿度的培养箱中培养。
1.3 吴茱萸碱的配制
用DMSO 溶解EVO 并用RPMI-1640 将其配制成1000 μmol/L 的储存液,使用时用RPMI-1640 稀释成所需浓度,最终浓度分别为1、4、16 μmol/L。DMSO 浓度小于0.5%。
1.4 MTT 法检测细胞增殖抑制率
实验分组:(1)对照组(C):未作处理的SGC7901 细胞;(2)单独加药组(E):EVO 组;(3)单独放射组(R):2 Gy、4 Gy、6 Gy、8 Gy;(4)联合作用组(R+E):EVO 与放射线联合作用组,其中联合作用组又分为(A 组):放射前24 h 加药;(B 组):放射后立即加药。将对数生长期的SGC7901 细胞用0.25%的胰酶消化后重悬于培养液中,以1.5 ×104个/mL 的密度均匀接种于96 孔板内过夜。次日分别加入EVO,使药物终浓度分别为1 μmol/L、4 μmol/L、16 μmol/L、每孔总体积为200 μL,每个浓度设置5 个复孔。EVO 作用24、48、72 h 后加入MTT 20 μL/孔,置于37 ℃、5%CO2培养箱4 h,弃去培养液,加入DMSO 150 μ/孔,振荡混匀后于酶标仪测定570 nm 波长处的吸光度。确定EVO 浓度及作用时间后,联合不同剂量射线(ELEKTA recise 医用直线加速器的6 MV X 射线,放射野为40 cm×40 cm。放射源与培养瓶细胞面距离为100 cm,加入1.5cm 等效组织充填物)处理SGC7901 细胞。实验重复3 次以上,取平均值。细胞增殖抑制率=(1-实验药物组OD 值/空白对照组OD 值)× 100%。
1.5 平板克隆形成实验
取对数生长期的SGC7901 细胞进行相应处理后按照对照组200 个/孔,单独放射组及联合作用组400 个/孔,接种于6 孔板中,置于孵箱中继续常规培养,待有肉眼可见克隆时,终止培养,PBS 冲洗,甲醇固定,Gmisa 染色,显微镜下计数大于50 个细胞的集落数。接种率PE(plating efficiency)=(对照组细胞克隆数/细胞接种数) ×100%;存活分数SF(surviving fraction)=实验组克隆数/(细胞接种数×PE);采用单击多靶模型拟合细胞存活曲线得出放射生物学敏感参数Do 值(mean lethal dose)=1/K 及Dq 值(quasithreshold dose)=Do × lnN (extrapolation number),根据公式:放射增敏比SER(sensitizing enhancement ratio)=单独放射组Do 值/增敏剂+放射组的Do 值,求出放射增敏比。
1.6 流式细胞仪检测EVO 联合放射线对胃癌细胞周期分布的影响
收集各组细胞,PBS 洗涤2 次,弃上清,加入体积分数为70%的乙醇振荡混匀后固定30 min,离心弃上清,加入100 μL 的PI 染料,振荡混匀后室温避光染色30 min,用BD 流式细胞仪(FACSCalibur,美国)进行分析。
1.7 Western blot 检测caspase 3 蛋白
收集各组细胞,冰上裂解细胞(RIPA 强裂解液,碧云天,PMSF 10 μL/ mL)30 min,提取总蛋白,BCA 法测定总蛋白浓度。细胞总蛋白于95 ℃条件下变性5 min 后,取20 μg 上样。SDS-PAGE 恒压80 V 分离蛋白,随后在恒流300 mA 条件下进行常规湿转1 h,PVDF 膜在摇床上室温封闭60 min、4 ℃条件下caspase 3 一抗孵育过夜,TBST 洗膜10 min、3 次,室温下摇床孵育二抗2 h,TBST 洗膜10 min、3 次,ECL 化学发光,显影、定影,胶片曝光。β-actin 为内参照。
1.8 统计学方法
所有实验重复3 次以上,采用SPSS16.0 软件,细胞增殖率,周期分布采用T 检验分析,克隆形成实验采用origin Pro8 软件拟合细胞存活曲线,检验水准=0.05,P<0.05 为差异有统计学意义。
2 实验结果
2.1 EVO 单独及联合放射线抑制SGC7901 细胞的增殖
不同浓度的EVO 作用不同时间对细胞增殖的影响如图1 所示,随着作用浓度的增加及作用时间的延长,其对SGC7901 细胞增殖抑制率升高,EVO对SGC7901 细胞的生长抑制作用有明显的时间依赖性和浓度依赖性。1 μmol/L EVO 处理48 h 对SGC7901 细胞抑制率为15.2% (IC15),为了避免EVO 单独使用对细胞产生的较强的抑制作用,选择1 μmol/L 药物浓度作为EVO 联合放射线的工作浓度,作用时间为48 h。随着放射剂量的增加,对细胞增殖的抑制率增加,且较单独放射组及单独加药组有明显的抑制作用,其中联合作用A 组对细胞的抑制效果要优于联合作用B 组(P<0.05),见图2。
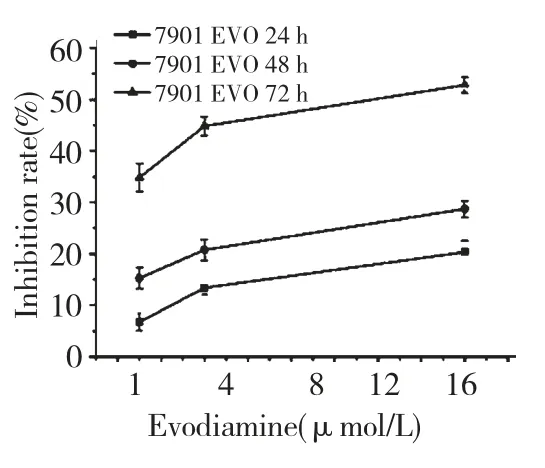
图1 EVO 对SGC7901 细胞生长的抑制率Fig.1 SGC7901 cell survival rates after treated with EVO with different concentrations and time

图2 EVO 联合放射线对SGC7901 细胞生长的抑制率Fig.2 SGC7901 cell survival rates after treated with combination group
2.2 EVO 对SGC7901 细胞具有放射增敏作用
根据公式计算细胞存活分数(SF),按单击多靶拟合并绘制细胞的存活曲线。SGC7901 细胞经单独放射和联合作用后的存活曲线见图3,放射生物学敏感参数见表1,放射增敏比见表2。联合作用组各剂量点的存活分数、放射生物学敏感参数均低于单独放射组,其中联合作用A 组的放射增敏效果要优于联合作用B 组(P<0.05)。

图3 单击多靶模型拟合细胞的剂量存活曲线Fig.3 The dose survival curves of SGC7901 cells by muititarget single hit model

表1 单独放射线及EVO 联合放射线组的放射生物学敏感参数Table 1 Radiobiology sensitive parameter

表2 SGC7901 细胞放射增敏比Table 2 SER of SGC7901
2.3 EVO 联合射线影响SGC7901 细胞周期分布
EVO 联合放射组与对照组及单独放射组相比,细胞处于G2/M 期的比例显著增加,其中联合作用A 组对SGC7901 细胞G2/M 期的阻滞大于联合作用B 组,见图4(P<0.05)。相关研究已证实,细胞对放射线的敏感性增强与细胞G2/M 期阻滞有关G2/M 期的细胞对放射线敏感性最高[8]。
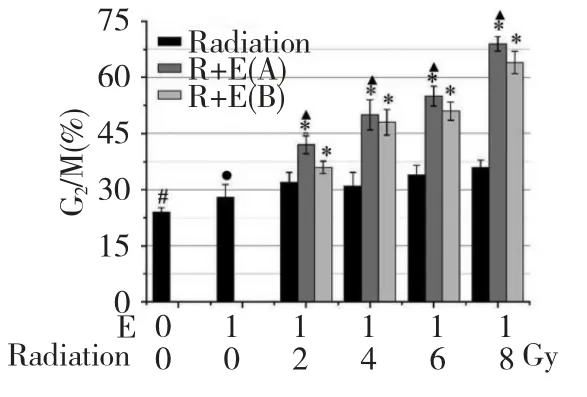
图4 EVO 联合放射线对SGC7901 细胞周期G2/M 期的阻滞率Fig.4 The rates of G2/M in different groups
2.4 EVO 联合放射上调了SGC7901 细胞中凋亡蛋白caspase3 的表达
Western blot 结果显示联合作用组相对于单独放射组及单独加药组,细胞凋亡蛋白caspases3 表达上调,其中联合作用A 组较联合作用B 组Caspase3表达量上调更明显,且随放射剂量的增加其表达量逐渐增加见图5。
3 讨论
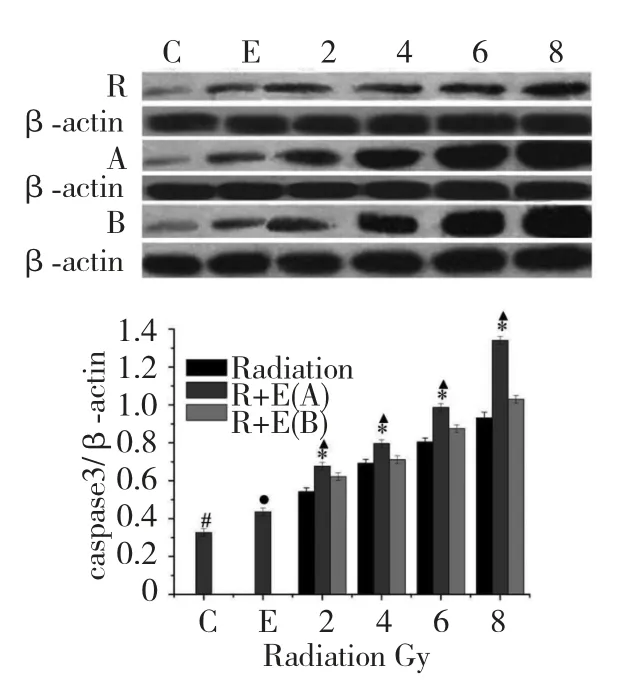
图5 Western blot 法检测SGC7901 细胞中caspase3 蛋白表达Fig.5 Effects of different groups on the protein level of SGC7901 cell
细胞增殖抑制试验结果表明,EVO 对胃癌SGC7901 细胞具有明显的增殖抑制作用,且抑制作用呈剂量和时间依赖性。为了研究低浓度EVO 的放射增敏作用,研究选用了EVO IC15的剂量1 μmol/L,作为后续联合作用的药物剂量。MTT 实验结果提示,EVO 联合不同剂量射线在48 h 对SGC7901 细胞增殖的抑制率显著高于单独放射组和单独用药组,其中联合作用先加药A 组较联合作用后加药B 组对胃癌细胞的增殖抑制作用更强(P<0.05),提示EVO 联合放射线降低了胃癌细胞的存活率,且先加药的作用方式更利于杀伤细胞。Do 为平均致死剂量,反映不同细胞对放射线的敏感性;Dq 为准域剂量,反映细胞亚致死放射损伤的修复能力;SF2 可衡量细胞内在放射敏感性。克隆形成实验结果显示EVO 联合放射线组的SF2、Do、Dq 均低于单独放射组,提示EVO 增强了SGC7901 细胞对放射线的敏感性,并且不同加药顺序对放射敏感性的影响不同,先加药使胃癌细胞对射线的敏感性更强。
放射增敏剂是一种与射线共同使用时可提高射线杀伤作用的药物,常用的放射增敏剂可以从多种途径实现其增敏效果,主要包括:增加射线对肿瘤细胞的原发性损伤,减弱放射后细胞亚致死性损伤的修复,改变细胞周期,促进凋亡,以及影响信号转导通路等[9]。EVO 是一种从芸香科植物吴茱萸近成熟果实中提取的天然药物,具有副作用小,药效广泛等优势,前期实验证实EVO 可增强舌鳞状细胞癌Tca8113 细胞的放射敏感性[7]。本研究进一步证明了EVO 同样能够对胃癌SGC7901 细胞产生放射增敏作用,并且加药顺序的不同影响着联合作用的效果。
流式细胞仪检测细胞周期结果显示EVO 对SGC7901 细胞有明显细胞周期阻滞作用,且联合作用组对细胞G2/M 期的阻滞率高于单独放射组和单独用药组。细胞对放射线的敏感性增强与细胞G2/M 期的阻滞有关[10],细胞处于该时期更易受到放射线的伤害,最终导致死亡。EVO 对胃癌SGC7901 细胞周期阻滞可能是EVO 产生放射增敏作用的机制之一,与前期研究EVO 对口腔癌细胞的放射增敏作用研究结果相似[7]。
细胞凋亡与细胞的生长,增殖和分裂紧密联系,并且在许多疾病的发生过程中起着重要的作用[11]。caspase3 是细胞凋亡途径中的经典下游基因。细胞在接收到外界凋亡信号刺激后引发一系列凋亡信号的激活,分为细胞外途径(或称细胞表面死亡受体途径)和细胞内途径(或称线粒体引发途径),而在内外两条凋亡途径的级联反应中都会伴随着caspase 家族基因的激活,caspase3 是这些途径中较为重要的基因,该基因的活化可最终导致细胞的凋亡[12]。Western blot 结果显示,联合作用组与单独放射组和单独用药组相比,caspase3 的表达量明显增多,其中联合作用组中不同加药时序对caspase3表达量的影响不尽相同,联合作用组中先加药A 组中凋亡蛋白capase3 的表达量高于后加药B 组。凋亡蛋白表达量的增多说明EVO 与射线联合使用可能激活了凋亡途径中的相关基因最终导致caspase3基因的激活,亦或是直接使caspase3 活化,发挥其促凋亡的作用,从而使癌细胞死亡率升高。
综上所述,EVO 联合放射治疗能增强胃癌SGC7901 细胞的放射敏感性,导致细胞增殖受到抑制,改变细胞周期分布,增加凋亡蛋白caspase3 的表达量,同时发现加药顺序的不同也影响着胃癌细胞对联合作用不同的响应,这对胃癌围手术期放射治疗中增敏剂给药顺序选择提供了一定的理论基础数据,但EVO 的作用剂量、作用时间及具体的作用机制等还有待于进一步体内、体外实验及临床试验的证实。
1 Hoffe S,Ashraf N,Kim R.Adjuvant treatment for gastric cancer:chemotherapy versus radiation.Oncologis,2013,18:1013-1021.
2 Moding EJ,Kastan MB,Kirsch DG.Strategies for optimizing the response of cancer and normal tissues to radiation.Nat Rev Drug Discov,2013,12:526-542.
3 Yu H,Jin HW,Gong WZ,et al.Pharmacological actions of multi-target-directed evodiamine.Molecules,2013,18:1826-1843.
4 Yang J,Wu LJ,Tashino SI,et al.Protein tyrosine kinase pathway-derived ROS/NO productions contribute to G2/M cell cycle arrest in evodiamine-treated human cervix carcinoma HeLa cells.Free Radic Re,2010,44:792-802.
5 Dong GQ,Sheng CQ,Wang SZ,et al.Selection of evodiamine as a novel topoisomerase I inhibitor by structure-based virtual screening and hit optimization of evodiamine derivatives as antitumor agents.J Med Chem,2010,53:7521-7531.
6 Liu YM(刘裕民),Zhang JQ(张景勍),You ZM(游智梅),et al.Inhibitory effect of norcantharidin combined with evodiamine on the growth of human hepatic carcinoma cell line HepG2in vitro.Chin J Cell Mole Immunol(细胞与分子免疫学杂志),2014,30:824-828.
7 Feng R(冯蕊),He JX(何津祥),Guo JS(国晋崧),et al.Evodiamine combined with radiation inhibits proliferation,adhesion and migration of human tongue squamous cell carcinoma cell line Tca-8113.Tumor(肿瘤),2011,31:417-423.
8 Liu X,Sun C,Jin X,et al.Genistein enhances the radiosensitivity of breast cancer cells via G2/M cell cycle arrest and apoptosis.Molecules,2013,18:13200-13217.
9 Zhou HQ(周厚清),Xing C(邢成),Li BN(李伯南).Progress in the studies of tumor radiosensitizers and its machanism.Foreign Med Sci(国际肿瘤学杂志),2001,28:432-432.
10 Yu CC,Hung SK,Liao HF,et al.RAD001 Enhances the radiosensitivity of SCC4 oral cancer cells by inducing cell cycle arrest at the G2/M checkpoint.Anticancer Res,2014,34:2927-2935.
11 Sankari SL,Masthan KM,Babu NA,et al.Apoptosis in cancer--an update.Asian Pac J Cancer Prev,2012,13:4873-4878.
12 Fiandalo MV,Kyprianou N.Caspase control:protagonists of cancer cell apoptosis.Exp Oncol,2012,34:165-175.

