新辅助化疗治疗大肠癌的近期疗效观察
李春峰 (合阳县医院外科,陕西 渭南 715300)
新辅助化疗也称术前化疗,指恶性肿瘤在局部治疗或切除前给予的全身化疗,是治疗各种恶性肿瘤的新方法。随着研究的深入,新辅助化疗显示出良好的优越性,越来越受到重视,已成为治疗各种恶性肿瘤的重要环节[1]。大肠癌是消化道恶性肿瘤,其发病率在恶性肿瘤中居前3 位,较为常见的是直肠癌和结肠癌。在传统认知中,大肠癌为一种全身性的恶性肿瘤,在恶性肿瘤体积较小时,就具备向其他器官转移的可能性。新辅助化疗可以消灭这些微小转移灶,降低术后复发的概率。现在统一的观点是新辅助化疗的疗效与预后之间存在显著相关性,其中化疗所达到的病理完全缓解率(pathologic complete remission rate,pCR,指未在病理切片中检查到包括原位癌的肿瘤组织)与预后之间尤其相关,化疗后达到pCR 的患者预后较好。本研究探讨了新辅助化疗治疗大肠癌的近期疗效及其与患者年龄、肿瘤体积、病理大小的关系,现报告如下。
1 资料与方法
1.1 资料来源
选取2003 年3 月—2012 年3 月合阳县医院外科收治的大肠癌患者264 例,均经病理学确诊,石蜡包埋病理标本全部经过保存,病例资料记载完整。其中,男性患者183 例,女性患者81 例;年龄27~70 岁,中位年龄59 岁;结肠癌174 例,直肠癌90 例。纳入标准:年龄18~70 岁;病理组织学诊断明确为直肠癌或结肠癌;通过B 超、CT、磁共振检查,均证实存在可测量病灶;初治或术后12 个月内未行化疗且存在复发现象;未发现合并其他部位的肿瘤;卡式评分>60 分,预计生存期>3 个月;化疗前血常规及肝、肾功能检查符合下述标准:中性粒细胞计数≥1.5×109/L,血小板计数≥80×109/L,天门冬氨酸转氨酶/丙氨酸转氨酶≤2.5 倍正常值上限,血清胆红素2≤2.0 倍正常值上限,血肌酐值正常;接受奥沙利铂+氟尿嘧啶化疗3 个周期以上,且患者家属知情同意。排除标准:存在智力障碍及精神性疾病、无法自主表达意愿;未能将随访要求疗效评估完成;有其他重要脏器疾病;对患者的无进展生存期进行观察,入选的患者只要达到“肿瘤进展”或“死亡”则立即停止观察。经医院医学伦理委员会批准,患者或家属签署知情同意书。以随机数字表法将患者分为观察组、对照组各132 例,2 组患者一般资料的差异无统计学意义(P>0.05),具有可比性。
1.3 方法
观察组患者于术前进行新辅助化疗,采用FOLFOX 化疗方案:亚叶酸钙(广东岭南制药有限公司,批准文号:国药准字H20040612)0.1 g、第1~5 日,氟尿嘧啶(广州白云山何济公制药有限公司,批准文号:国药准字H44023085)500 mg/m2、第1~5 日,奥沙利铂(费森尤斯卡比(武汉)医药有限公司,批准文号:国药准字H20093892)130 mg/m2、第1 日;化疗期间常规使用甲氧氯普胺、格拉司琼预防消化道反应,21 d 重复1 次。对照组患者只给予术后常规化疗。
1.4 观察指标与疗效评定标准
化疗前及3 个周期化疗后对患者进行疗效评估,即同一患者在新辅助化疗开始及最后1 个周期化疗的最后1 周用同一方法测量对比,在每个化疗周期前1 d 均进行血常规、生化全套、心电图、胸部X 线及B 超等检查,定期骨扫描复查,评价全身情况及肿瘤临床分期。根据按照Recist 实体瘤的疗效评价标准,分为:(1)完全缓解(CR):即可见病灶完全消失超过4 周以上,本标准包含临床完全缓解及pCR;(2)部分缓解(PR):所有可见病灶最大径之和比化疗前缩小30%以上,且持续4 周以上;(3)稳定(SD):所有可见病灶最大径之和比化疗前缩小不超30% 或增大不超过20%,且持续4 周以上;(4)进展(PD):所有可见病灶最大径之和比化疗前增大超过20%,并持续4 周以上。以化疗疗效为标准分为有效及无效,达到Recist 标准中CR 及PR 为有效,SD 及PD 为无效。总有效率=(CR 病例数+PR 病例数)/总病例数×100%。
1.5 统计学方法
采用SPSS 16.0 统计学软件对数据进行处理,计量资料采用均数±标准差(¯x±s)表示、采用t检验,计数资料采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 2 组患者临床疗效比较
观察组132 例患者中,CR 40 例,PR 56 例,SD 16 例,PD 20 例,总有效率为72.73%;对照组132 例患者中,CR 30 例,PR 57 例,SD 24 例,PD 21 例,总有效率为65.91%。观察组患者总有效率略高于对照组,但差异无统计学意义(P>0.05)。
2.2 2 组患者临床疗效与年龄的关系
2 组有效及无效患者的平均年龄比较,差异均无统计学意义(P>0.05);2 组患者中,20~40、>40~60、>60 岁3 个年龄段人群的总有效率相近,差异均无统计学意义(P>0.05);观察组各年龄段患者的总有效率均略高于对照组,但差异均无统计学意义(P>0.05),见表1。

表1 2 组患者临床疗效与年龄的关系Tab 1 Association of clinical efficacy with patients' age
2.3 2 组患者临床疗效与肿瘤大小的关系
2 组有效及无效患者的肿瘤平均直径比较,差异均无统计学意义(P>0.05);2 组中肿瘤直径为2~5 厘米患者所占比例均最高,临床疗效方面,肿瘤越大,有效率越低,但差异均无统计学意义(P>0.05);观察组各肿瘤大小患者的总有效率均略高于对照组,但差异均无统计学意义(P>0.05),见表2。
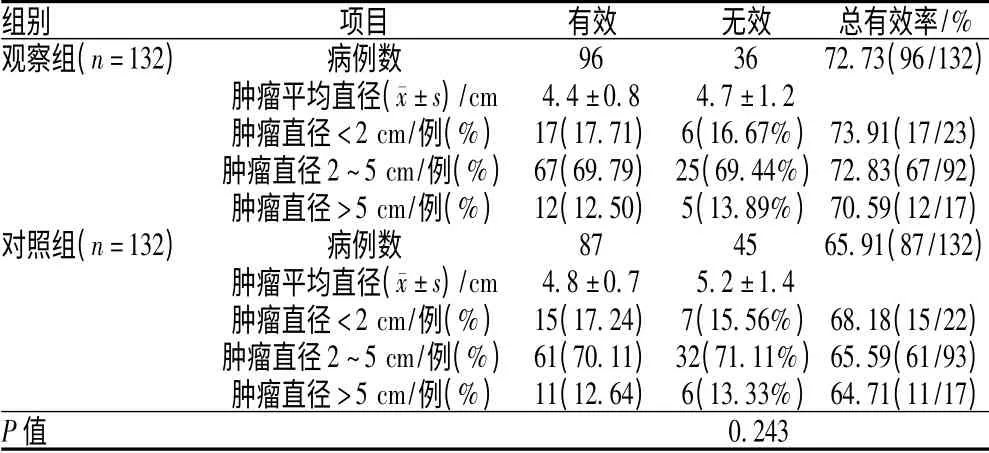
表2 2 组患者临床疗效与肿瘤大小的关系Tab 2 Association of clinical efficacy with tumor size
2.4 2 组患者临床疗效与肿瘤病理类型的关系
2 组患者中,溃疡型大肠癌均较常见,其总有效率均低于肿块型、高于浸润型,但差异均无统计学意义(P>0.05);观察组病理类型患者的总有效率均略高于对照组,但差异均无统计学意义(P>0.05),见表3。
3 讨论
3.1 新辅助化疗概况
新辅助化疗的优势:(1)可减小或者消灭原发病灶中的肿瘤细胞,使局部较大的肿瘤体积缩小,使一些不能手术的患者可接受手术治疗;(2)可降低一些特殊部位肿瘤的手术风险;(3)在治疗的初期,耐药肿瘤细胞较少,通过新辅助化疗,可大

表3 2 组患者临床疗效与肿瘤病理类型的关系Tab 3 Association of clinical efficacy with pathological type
大降低耐药肿瘤细胞活性,从而降低肿瘤转移的概率;(4)能减轻恶性肿瘤的并发症,减少患者身体和心理的不良反应;(5)新辅助化疗的效果优于术后化疗,但费用并未增加,不会再在经济上增加患者的负担。大肠癌肝脏的远端转移最常见,约20%~40%的首次确诊的大肠癌患者出现了肝脏转移,60%~75%的大肠癌晚期患者出现了肝脏转移。仅约10%的大肠癌肝脏转移患者可进行切除手术,多数患者不具备手术条件,且能接受切除手术患者的生存率为30%~50%,不能接受切除手术患者的生存率基本为零[2-3]。因此,通过手术切除病灶是大肠癌的有效治疗手段,但大部分患者不能接受手术治疗,在这种情况下,新辅助化疗无疑为大肠癌患者提供了全新的治疗方法,将大大提高大肠癌患者的生存率。许多临床研究已证实新辅助化疗对大肠癌的疗效[4-6]。本研究结果也显示,新辅助化疗对大肠癌确实有一定的疗效。研究发现,处于进展期的结肠癌、直肠癌患者进行新辅助化疗后,大部分患者肿瘤体积缩小,其中12%~30%的患者能够达到CR。有研究对300 余例肝脏转移的晚期结肠癌、直肠癌患者实施新辅助化疗,结果显示,接近20%的患者化疗后达到了手术指标,无一例在手术中死亡,3 年生存率和5 年生存率分别为54%和40%。新辅助化疗作用于肿瘤细胞的机制主要是促进肿瘤细胞的凋亡,McDowell 等[7]研究发现,新辅助化疗能使肿瘤细胞的凋亡增加,但其促进肿瘤细胞凋亡的具体机制仍未研究清楚。
3.2 新辅助化疗的疗效与预后相关因素
大肠癌患者预后的相关因素很多,包括患者年龄、肿瘤大小、病理类型等。近年来,分子生物学的预测指标受到了越来越多的关注,包括肿瘤细胞增殖相关因子、肿瘤细胞凋亡相关因子、肿瘤激素受体、多药耐药相关因子等。但这些分子生物学指标的特异性不高,缺乏统一的标准,需要多方面参考。
3.3 新辅助化疗的疗效与患者年龄的关系
新辅助化疗治疗大肠癌的疗效与否与患者年龄相关,目前尚无定论。本研究结果显示,新辅助化疗组中,>60 岁患者总有效率最高,但其与20~40、>40~60 患者总有效率的差异并无统计学意义,说明新辅助化疗治疗大肠癌与患者年龄无关。
3.4 新辅助化疗的疗效与肿瘤大小的关系
本研究结果显示,新辅助化疗组中,肿瘤直径为2~5 厘米患者所占比例均最高,临床疗效方面,肿瘤越大,有效率越低,但差异均无统计学意义,说明新辅助化疗的疗效与肿瘤大小无关。
3.5 新辅助化疗的疗效与病理类型的关系
大肠癌的主要病理类型有肿块型、浸润型以及溃疡型,其他病理类型相对少见[8-10]。针对大肠癌的新辅助化疗治疗与病理类型之间的关系研究,目前尚无定论[11-15]。本研究结果显示,新辅助化疗组中,溃疡型大肠癌较为常见,其总有效率低于肿块型、高于浸润型,但差异均无统计学意义,说明新辅助化疗的疗效与病理类型无关。
综上所述,随着医疗水平的发展及新辅助化疗治疗手段的提高,为大肠癌患者的治疗带来了新的希望,新辅助化疗能有效提高患者术后的治愈率。临床治疗大肠癌时,应合理、高效地使用新辅助化疗,而且应根据患者的自身情况来制定个性化治疗方法,注意患者手术期的综合护理,以提高大肠癌患者手术的成功率。
[1] 汪晓东,曹霖,曾天芳,等.多学科协作诊治模式下新辅助/辅助化疗联合结直肠癌手术的临床效果[J]. 中国普外基础与临床杂志,2008,15(8):615-619.
[2] 郑莹,王杰军,邹建军,等.上海市社区癌症患者生活质量及其影响因素[J].癌症,2007,26(6):613-619.
[3] Kuebler JP,Wieand HS,O'Connell MJ,et al. Oxalip latin combinedwith weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage Ⅱand Ⅲcolon cancer:results from NSABP C-07[J].J Clin Oncol,2007,25(16):2198-2204.
[4] Köhne CH,van Cutsem E,Wils J,et al. Phase Ⅲstudy of weekly high-dose infusional fluorouracil plus folinic acid with or without irinotecan in patients with metastatic colorectal cancer:European Organisation for Research and Treatment of Cancer Gastrointestinal Group Study 40986[J].J Clin Oncol,2005,23(22):4856-4865.
[5] Colucci G,Gebbia V,Paoletti G,et al.Phase Ⅲrandomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer:a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale[J].J Clin Oncol,2005,23(22):4866-4875.
[6] Kulig J,Popiela T,Richter P,et al. Evaluation of adjuvant chemotherapy irinotecan + 5-fluorouracil +leucovorine in advanced colorectal cancer[J].Acta Chir Belg,2007,107(3):297-301.
[7] Tomlinson JS,Jamagin WR,DeMatteo RP,et al. Actual 10-year survival after resection of colorectal liver metastases defines cure[J].J Clin Oncol,2007,25(29):4575-4580.
[8] Moosmann N,Heinemann V. Cetuximab plus oxaliplatin-based chemotherapy in the treatment of colorectal cancer[J]. Expert Rev Anticancer Ther,2008,8(3):319-329.
[9] Amado RG,Wolf M,Peeters M,et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer[J].J Clin Oncol,2008,26(10):1626-1634.
[10] 朱正纲.术前区域性辅助化疗对改善胃癌手术疗效的临床意义[J].中国实用外科杂志,2005,25(7):389-391.
[11] Arru M,Aldrighetti L,Castoldi R,et al.Analysis of prognostic factors influeneing long-term survival after hepatic resection for metastatic coloreetal caneer[J].World J Surg,2008,32(l):93-103.
[12] 张丹阳,肖石梅.结直肠癌术后辅助化疗的不良反应及护理对策[J].中国实用护理杂志,2010,26(9):49-50.
[13] 禹立霞,任伟,钱晓萍,等.大肠癌患者血清VEGF、CEA 表达水平与浸润转移关系的研究[J]. 现代肿瘤医学,2008,16(10):1732-1735.
[14] 周建凤,陈书长,白春梅,等.影响晚期大肠癌预后的多因素分析[J].中国癌症杂志,2007,17(8):633-636.
[15] 王鑫,金晶. 局部晚期胃癌的放射治疗进展[J]. 癌症进展,2010,8(3):234-241.

