2012—2014年武警江苏省总队医院抗肿瘤药应用分析
姚响文 ,牛筛龙,吴之琳,徐 丽,姚晶晶(武警江苏省总队医院药剂科,江苏 扬州 225000)
恶性肿瘤是目前人类主要的致死原因之一,治疗主要为外科切除、放射治疗和化学药物治疗。其中,化学药物治疗为恶性肿瘤的重要治疗手段之一[1],合理、有效应用化疗药物可延长患者生命,缓解症状,减轻痛苦。为贯彻落实江苏省卫生计生委《关于进一步加强肿瘤治疗药及肿瘤治疗辅助药临床使用管理工作的通知》,了解抗肿瘤药的临床应用情况及发展趋势,现对2012—2014 年武警江苏省总队医院(以下简称“我院”)抗肿瘤药的应用情况进行分析,以期为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
提取我院药库信息管理系统2012—2014 年抗肿瘤药的出库品种数、规格、用药数量和销售金额等数据,进行统计分析。
1.2 方法
应用Excel 软件,对抗肿瘤药的用量、销售金额、用药频率(defined daily dose system,DDDs)、限定日费用(defined daily cost,DDC)等进行统计分析和排序。限定日剂量(defined daily dose,DDD)是指为达到主要治疗目的用于成人的药物平均日剂量。药物的DDD 值以《新编药物学》(17 版)规定的日剂量为准,其中未收载的药物以药物说明书结合临床实际应用剂量来确定[2]。DDDs=某药总消耗量/该药DDD 值。DDDs 具有相加性,DDDs 值越大,说明该药使用频率越高,反映临床科室对该药选择性越大[3]。DDC = 某药销售总金额/该药DDDs,该数值大小反映患者应用该种药物的平均日费用,可以作为药物费用方面的参考指标[4]。
2 结果
2012 年—2014 年我院销售金额、DDDs、DDC 以及其排序分别见表1 ~3。
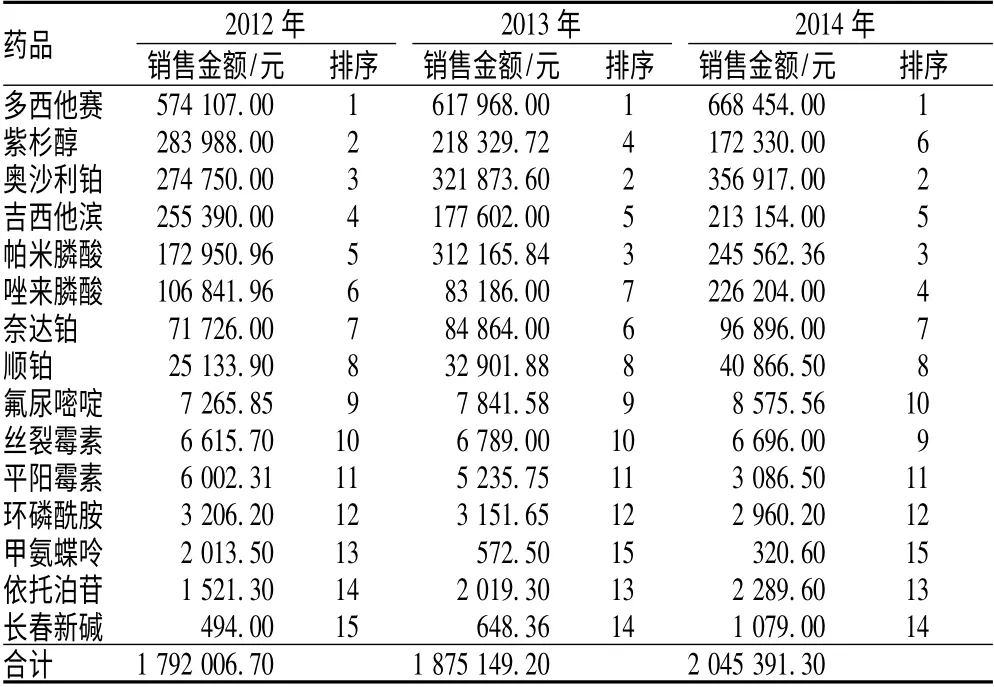
表1 2012—2014 年我院抗肿瘤药销售金额及其排序Tab 1 Consumption sum and ranking of anti-tumor drugs in our hospital during 2012-2014
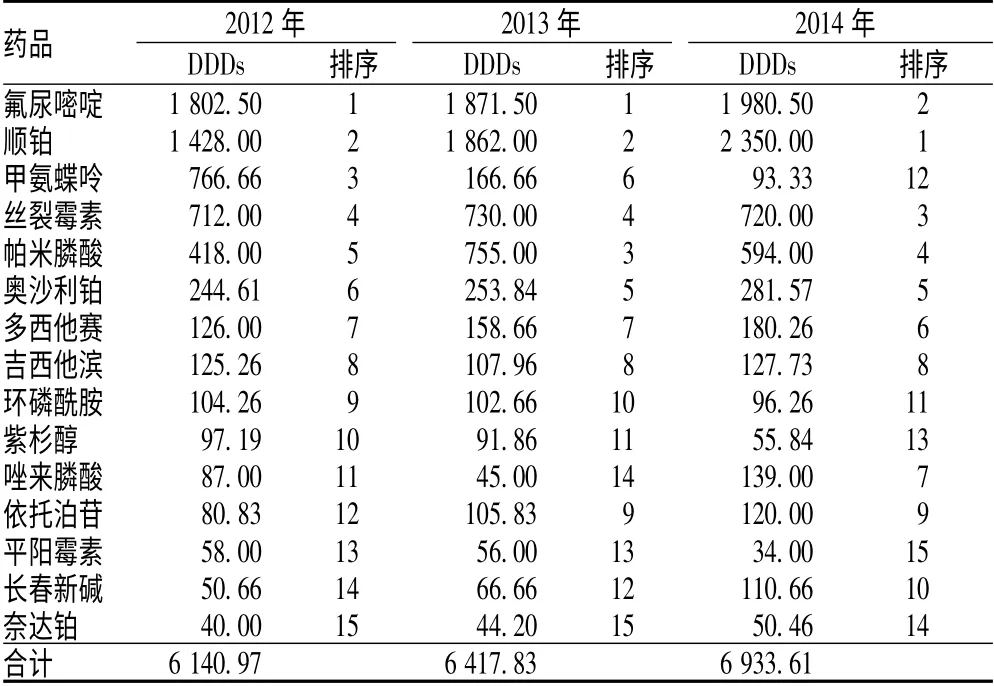
表2 2012—2014 年我院抗肿瘤药DDDs 及其排序Tab 2 DDDs and ranking of anti-tumor drugs in our hospital during 2012-2014
3 讨论
3.1 抗肿瘤药总体应用情况
恶性肿瘤严重危害人类健康,并且给患者家庭造成沉重经济负担。每年我国用于恶性肿瘤的医疗费用支出远高于一般疾病,占据了较大部分的社会和医疗资源[5]。通过对我院2012—2014 年抗肿瘤药的销售和应用情况调查可见,抗肿瘤药销售总金额和使用总频率呈逐年增长趋势,表明临床科室对抗肿瘤药的需求量逐年增长,也在一定程度上反映恶性肿瘤的发病率正逐年提高。DDC 可以反映药品价格高低,由表3可见,大部分药品3 年中DDC 基本保持不变,说明价格基本平稳,少数药品价格有波动,可能与进口药品受到国内仿制药品的价格冲击以及脂质体等新剂型改变所引起的药品价格上升有关。

表3 2012—2014 年我院抗肿瘤药DDC 及其排序Tab 3 DDC and ranking of anti-tumor drugs in our hospital during 2012-2014
3.2 各种抗肿瘤药应用情况
(1)多西他赛3 年中销售金额一直居于首位,且销售金额逐年增加,但其DDC 排序却位列第15 位,表明其日均用药费用昂贵(高达4 000 元),也在一定程度上影响其使用。多西他赛为紫杉醇类抗肿瘤药,主要用于治疗晚期乳腺癌、卵巢癌、非小细胞肺癌,同时多西他赛联合顺铂或氟尿嘧啶是晚期胃癌的一线有效治疗方案。多西他赛细胞内浓度约为紫杉醇的3 倍,在细胞内停留时间长,抗肿瘤活性强于紫杉醇[6];能够有效改善患者生活质量,延缓肿瘤进展时间,安全性高,耐受性良好,因而得到广泛推广。但由于多西他赛价格昂贵,影响使用频率,故DDDs 排序相对靠后。(2)紫杉醇为植物来源抗肿瘤药,通过诱导和促进微管蛋白聚合,防止解聚,从而抑制细胞分裂和增殖,发挥抗肿瘤作用。但因紫杉醇的溶解度很差、不良反应大、耐药性的产生,以及来源有限、造价高等原因,其临床推广使用受到很大限制[7]。同时由于新1 代高效、低毒紫杉醇类化疗药多西他赛的出现,其在临床上的治疗地位逐年下降,使用频率逐年降低,销售金额及排序也逐年下降,从2012 年的第2 位,下降至2013 年的第4 位,在2014 年持续降低为第6 位。(3)奥沙利铂、顺铂、奈达铂为铂类抗肿瘤药,在临床上的应用越来越广泛。由表1 可见,我院2012—2014 年铂类抗肿瘤药销售金额逐年增加。铂类抗肿瘤药主要通过破坏脱氧核糖核酸(DNA)结构和功能,阻止细胞分裂,以达到杀伤肿瘤细胞的作用。其中,顺铂为第1 代铂类制剂,用于卵巢癌、肺癌、食道癌等多种实体肿瘤[8],疗效比较确切,价格相对低廉,于1969 年开始应用临床至今,仍是临床使用频率较高的抗肿瘤药。由表2 可见,我院顺铂DDDs 排序由2012 年和2013 年第2 位上升至2014 年第1 位,可见其在临床肿瘤治疗中具有非常重要的地位。奈达铂为第2 代铂类抗肿瘤药,1995 年在日本上市,对头颈部肿瘤有40%的有效率,对食道癌有效率大于50%,皆优于顺铂,对肺癌疗效与顺铂相当。我院2012—2014 年奈达铂销售金额逐年增加,但其价格相对偏高,导致其DDDs 排序靠后。奥沙利铂为第3 代铂类抗肿瘤药,是首个对结肠癌有效的铂类制剂,其与5-氟尿嘧啶和亚叶酸钙联合应用的FLOFOX 方案已作为一线化疗方案应用于转移性结直肠癌的治疗[9-10];其对胃肠道、肝肾、骨髓毒性均较第1、2 代铂类抗肿瘤药明显减轻,耐受性良好。虽然奥沙利铂DDC 相对较高,在千元左右,但其疗效确切、安全性高,故临床应用非常广泛。我院2012—2014 年奥沙利铂销售额逐年攀升,从2012 年的274 750 元,到2013 年的321 873.6 元,再到2014 年356 917 元,年平均增长率为14%,这表明奥沙利铂在临床治疗中的地位越来越重要。(4)氟尿嘧啶为胸苷酸合成酶抑制剂,通过抑制胸腺嘧啶核苷酸合成酶而抑制DNA 的合成,发挥抗肿瘤作用。单独或与其他药物联合应用于乳腺癌和胃肠道肿瘤的治疗,在肿瘤内科治疗中占有重要地位。由于氟尿嘧啶价格低廉,疗效明显,其DDDs 值远高于其他药物,与顺铂共同成为我院2012—2014 年抗肿瘤药使用频率较高的药物。(5)吉西他滨为核苷酸还原酶抑制剂,是细胞周期特异性药,可抑制DNA 合成,引起细胞凋亡。其抗瘤谱广,适用于晚期胰腺癌、晚期非小细胞肺癌的一线治疗[11]。我院吉西他滨2013 年销售金额比2012 年下降,但在2014 年又显著回升,但由于日均用药费用较高(DDC 约为2000 元),故使用频率较低。(6)帕米膦酸和唑来膦酸为双膦酸盐类抗肿瘤药,2 者均适用于治疗肿瘤骨转移所致的高钙血症及骨痛。由于在治疗肿瘤骨转移方面的确切疗效,使得其2012—2014 年销售金额排序一直位于前列。但是DDDs 值帕米膦酸远大于唑来膦酸,说明帕米膦酸用药频率大于唑来膦酸,与其价格较低、良好的安全性及耐受性相关。帕米膦酸为第2 代含氮双膦酸盐,上市较早临床应用已经有20 多年了,研究结果表明,帕米膦酸安全、有效,其安全性在双膦酸盐类药物里居于前列[12]。唑来膦酸是第3 代具有杂环结构的双膦酸盐,作用强大,是目前双膦酸盐类药物里作用最强的一个[13],但不良反应严重,会发生颌骨坏死,这在一定程度上限制了其使用。(7)由表1 ~2 可见,3 年中我院甲氨蝶呤的销售金额和用药频度均显著下降,其DDDs 排名由2012 年第3 位下降至2013 年第6 位,在2014年持续降低为第12 位,表明其用药频度逐渐降低。甲氨蝶呤为抗叶酸类抗肿瘤药,主要通过对二氢叶酸还原酶的抑制而达到阻碍肿瘤细胞合成叶酸,从而抑制肿瘤细胞的生长与繁殖,临床用于急性白血病,尤其是急性淋巴细胞性白血病,绒毛膜上皮癌及恶性葡萄胎等治疗[14]。2012—2014 年我院甲氨蝶呤用药频度和销售额下降与来我院就诊的急性白血病患者数量较少有关,另一方面也与其药理作用选择性差、不良反应多、安全性低相关[15]。从2012—2014 年我院抗肿瘤药应用情况来看,单个抗肿瘤药的销售金额排序、DDDs 排序与DDC排序并不一致。导致这一现象有多方面的原因包括药物的适应证,用法、用量;药物的疗效及安全性;药品价格;患者经济承受能力;新型药物的推广。
3.3 加强抗肿瘤药的应用管理
为进一步促进我院抗肿瘤药物合理应用,提高肿瘤治疗规范化水平,保证医疗质量和医疗安全,保障患者生命和健康权益,现就进一步加强抗肿瘤药临床管理提出以下措施:(1)加强抗肿瘤药购用管理工作,包括建立抗肿瘤药管理目录和完善临时采购管理;应当定期评价目录中药品使用情况,进行动态管理;对临时采购药品,需实行反馈机制,临床使用科室需将使用的疗效和药品不良反应信息在疗程结束后7 d 内向药学部门反馈。(2)规范抗肿瘤药的临床应用,用药前需根据患者机体状况、既往用药史、身体耐受性、经济承受能力以及肿瘤的病理类型、分期等因素综合制定个体化的肿瘤治疗方案。加强临床医师与临床药师的交流合用,提高抗肿瘤药的合理应用。(3)加强对抗肿瘤药临床安全管理,使用过程中,注意抗肿瘤药的给药方式,溶媒选择,输注顺序,输注速度,时间,渗漏处理及不良反应监测等各个环节,重视用药教育,确保用药安全。(4)定期开展抗肿瘤药临床应用监测与评估,定期分析我院抗肿瘤药使用情况,评估应用适宜性,分析应用趋势。
综上所述,2012—2014 年我院抗肿瘤药的应用呈逐年上升趋势,这与恶性肿瘤的发病率正逐年升高有密切关系。在临床用药方面,抗肿瘤药的应用既要结合药物适应证,又要从药物经济学方面进行综合考虑,根据肿瘤分期,选定合理药物,制定最佳化疗方案,以提高患者生活质量,减少不良反应,保证临床合理用药。
[1] Kessler DA,Austin RH,Levine H. Resistance to chemotherapy:patient variability and cellular heterogeneity[J].Cancer Res,2014,74(17):4663-4670.
[2] 原涵,封宇飞.2008—2011 年卫生部北京医院口服抗抑郁药应用分析[J].中国医院用药评价与分析,2013,13(4):308-310.
[3] 李梦,刘东.武汉地区32 家医院2010—2012 年抗肿瘤中药注射剂应用分析[J].中国药师,2014,17(2):287-290.
[4] 周磊,张碧华,高素强,等.2008—2011 年卫生部北京医院门诊消化系统用中成药应用分析[J]. 中国医院用药评价与分析,2013,13(4):320-323.
[5] 茅雯辉,黄韻宇,陈文,等.城镇基本医疗保险对恶性肿瘤患者住院治疗及费用的影响分析[J].中国卫生资源,2012,15(1):60-63.
[6] 赵颖,王芮. 抗肿瘤药物多西他赛研究进展[J]. 中国药业,2014,23(10):87-89.
[7] 陈卓,蒋常春,唐小川.紫杉醇不良反应及合理用药探析[J].肿瘤药学,2012,2(1):73-74,80.
[8] Rose MC,Kostyanovskaya E,Huang RS. Pharmacogenomics of cisplatin sensitivity in non-small cell lung cancer[J]. Genomics Proteomics Bioinformatics,2014,12(5):198-209.
[9] 展晓日,刘玉艳,李海峰,等. 抗癌药物奥沙利铂的临床应用研究进展[J].健康研究,2012,32(5):375-377.
[10] 邓玉琴,陆超,何光照,等. 我院FOLFOX4 方案治疗胃肠道肿瘤致54 例次不良反应分析[J]. 中国药房,2014,25(12):1113-1115.
[11] 郑爱青,郑培,于金明,等. 吉西他滨单药或联合卡铂治疗老年晚期非小细胞肺癌疗效观察[J]. 武警医学,2011,22(6):501-504.
[12] Mhaskar R,Redzepovic J,Wheatley K,et al. Bisphosphonates in multiple myeloma:a network meta-analysis[J]. Cochrane Database Syst Rev,2012,16(5):CD003188.
[13] 邹春华,谢勇久,王绎,等. 骨骼病变为首发表现的急性淋巴细胞白血病1 例[J].武警医学,2014,25(9):950-952.
[14] 柳惠斌,韩静,买尔旦·马合木提. 优化的HPLC 法测定人血清中甲氨蝶呤的浓度及临床应用[J]. 中国药房,2014,25(14):1283-1285.
[15] 张传仓,姚英民.甲氨蝶呤的不良反应[J].药物流行病学杂志,2001,10(2):70-71

