棘霉素对K562细胞生长及相关激酶的影响
杜钢军,许严伟,林海红
(1.河南大学药学院,河南开封475004;2.洛阳市第三人民医院药剂科,河南洛阳471002)
棘霉素对K562细胞生长及相关激酶的影响
杜钢军1,许严伟2,林海红1
(1.河南大学药学院,河南开封475004;2.洛阳市第三人民医院药剂科,河南洛阳471002)
目的研究棘霉素对人白血病细胞K562生长及相关激酶的影响。方法取对数生长期的K562细胞,采用0.05、0.1、0.2、0.5、1.0、3.0μg/L棘霉素分别处理24 h,MTT法检测细胞存活率,流式细胞术观察细胞周期分布, Western blot检测Bcr-Abl、AKT的表达。结果棘霉素对K562细胞的IC50为0.82μg/L。随着浓度的增加,棘霉素对酪氨酸激酶的抑制作用增强;棘霉素在2.0μg/L时,其抑制细胞蛋白激酶B的磷酸化程度最高。结论棘霉素可以抑制K562细胞的增殖,其机制与抑制酪氨酸激酶和下调蛋白激酶B的作用有关。
棘霉素;K562;细胞周期;Bcr-abl;AKT
棘霉素是从放线菌代谢物中分离得到的一种具有细胞毒作用的抗生素,它通过与DNA结合后可以抑制RNA的合成[1]。研究表明,棘霉素对于多种肿瘤细胞均有抑制作用,例如肺癌,黑色素瘤,前列腺癌,中枢神经系统肿瘤,结肠癌,乳腺癌,卵巢癌等[2]。棘霉素对白血病细胞的生长也有报道[3],但棘霉素对白血病K562细胞的研究还未见报道。我们实验室通过对我国边远地区土壤微生物的筛选,发现一株土壤放线菌提取物,经过活性追踪分离纯化并鉴定其中的活性成分是蒽醌类抗生素-棘霉素(echinomycin)。
慢性髓细胞性白血病(Chronic myeloid leukemia,CML)是血液系统最常见的恶性疾病之一,在国内年发病率约为0.36/10万,占白血病的第三位[4]。K562细胞系来源于急变期CML患者,是研究CML经典的细胞模型,我们选择K562细胞作为研究对象,对本实验室分离纯化的棘霉素[5]的体外抗肿瘤作用及其机制进行了研究,为其用于治疗CML的可行性提供依据。
1 材料与方法
1.1 材料
细胞株:K562细胞由军事医学科学院生物工程研究所惠赠。K562细胞培养于含体积分数10%胎牛血清和青霉素、链霉素各100 U/m L的RPMI 1640培养基中,37℃、体积分数5%CO2恒温培养箱中,实验时选用对数生长期的细胞。
试剂与药品:棘霉素来自于本实验室的分离纯化,测得纯度为94.6%,Bcr-Abl(山羊多克隆一抗和FITC标记的兔抗山羊二抗)、AKT(小鼠一抗和山羊抗小鼠二抗)均为Sant Cruz公司产品;MTT、DMSO购自Sigma公司;其他试剂皆为国产分析纯试剂。
仪器:Mini-PROTEAN Tetra Cell垂直电泳槽(美国Bio-Rad公司);FACScalibur流式细胞仪(美国BD公司)。
1.2 MTT检测
采用MTT法[6]。分别取对数生长期的细胞,用含体积分数10%胎牛血清的细胞培养液调整细胞浓度为2×104/m L,接种于96孔板,180μL/孔,置于体积分数5%CO2,37℃继续培养24 h;实验组加入不同浓度的棘霉素各20μL,使其终浓度分别为0.05、0.1、0.2、0.5、1.0、3.0μg/L,另外,设加入不同浓度的伊马替尼,其终浓度分别为0.03、0.01、0.1、0.3、1.0、3.0 mg/L。各对照组加入20μL培养基,每组4个复孔。再培养48 h后,平板离心后除去上面培养基每孔加含MTT质量分数0.5 g/L的PBS(p H 6.8)溶液100μL,继续培养4 h,离心并弃去上清,每孔加DMSO 100μL,避光振荡5 min,充分溶解后,于酶标仪570 nm处检测吸光度值(OD值)。实验重复3次。
细胞生长抑制率=(正常对照组OD值―用药组OD值)/正常对照组OD值×100%。
1.3 细胞周期检测
培养细胞、分组。实验组棘霉素最终浓度为2.0μg/L,处理24 h,并设空白对照,收集各组细胞于离心管中,离心(1000 r/min,5 min)后用冰冷的PBS洗细胞2次弃去上清液;将细胞(大于1×106)沉淀重悬于含体积分数70%乙醇的PBS 500μL中,固定细胞30 min以上。离心后,弃上清。2 m L的PBS悬浮,离心后,弃上清。留下约50μL细胞悬液加10μL的RNase(10 g/L)。37℃水浴30 min后加PBS约300μL后加入碘化丙啶(PI)(终浓度20 mg/L)染色,室温下避光15 min,流式细胞仪进行检测。
1.4 Western Blot法检测Bcl-Abl、磷酸化和非磷酸化的AKT
取对数生长期的K562细胞,设高、中、低3组,检测Bcr-Abl设棘霉素浓度为1.0、2.0、4.0μg/L,检测AKT设棘霉素终浓度分别为0.5、1.0、2.0μg/L,并设空白对照组。药物作用细胞12 h后,收集细胞于离心管中。细胞裂解细胞经预冷的PBS洗2遍,转入1.5 m L EP管中,离心后加入100μL细胞裂解液放置4℃裂解40 min。4℃,10 000 g,30 min离心浓缩,将上清液转移至另一微量离心管中备用。将棘霉素作用过的K562细胞中提取的10μg蛋白样品用质量分数为10%聚丙烯酰胺凝胶进行分离,并转移到PVDF膜上,进行免疫印迹分析。过程如下:用脱脂牛奶对膜进行封闭,加入1∶1 000稀释的抗Bcr-Abl、AKT及磷酸化抗体,常温孵育2 h,用体积分数0.1%Tween20的TBS洗膜3次,加入1∶3 000稀释的辣根过氧化物酶标记的兔抗山羊二抗,常温孵育45 min,用体积分数为0.1%Tween 20的TBS洗膜3次,加入发光剂,曝光显影。
2 结果
2.1 棘霉素对K562细胞增值的影响
伊马替尼IC50为0.19 mg/L,棘霉素IC50为0.82μg/L,见图1。

图1 棘霉素对K562细胞增殖的影响
2.2 棘霉素对K562细胞周期的影响
结果显示,实验组K562细胞G1期和G2期比例显著下降,S期比例明显升高,见表1。实验组与对照组的细胞数比较,见图2。

表1 棘霉素对K562细胞周期的影响 (%)

图2 棘霉素对K562细胞周期的影响(A:对照组;B:实验组)
2.3 不同浓度棘霉素对Bcr-Abl蛋白的影响
在K562细胞中,与对照组相比,不同浓度的棘霉素对Bcr-Abl的表达均有不同程度的抑制作用,见图3。
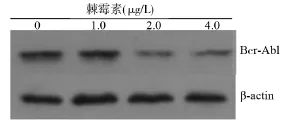
图3 不同浓度棘霉素处理K562细胞后Bcr-Abl的表达
2.4 不同浓度棘霉素对磷酸化和非磷酸化AKT蛋白的影响
以0μg/L的棘霉素作为对照组,对于K562细胞,2.0μg/L的棘霉素其抑制细胞AKT的磷酸化程度最高。
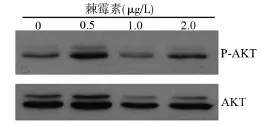
图4 棘霉素对K562细胞中AKT表达的影响
3 讨论
棘霉素对K562细胞作用的系统性研究未见报道,我们选用人白血病K562细胞作为研究对象,以伊马替尼作为对照,棘霉素对K562细胞的增殖有明显的抑制作用,IC50为0.82μg/L,且其作用呈剂量依赖性(见图1)。该研究通过观察棘霉素对K562细胞周期的影响,发现与空白对照组相比,实验组G1期及G2期细胞比例明显下降;S期比例明显升高,从51.24%升高到65.90%。说明棘霉素主要是通过抑制细胞合成期导致K562细胞的凋亡。Western-blot结果显示,不同棘霉素作用24 h后Bcr-Abl的表达明显受到抑制,说明棘霉素对Bcr-Abl有一定程度的抑制作用。同样方法检测细胞中AKT信号通路的表达,结果显示不同剂量的棘霉素对AKT信号通路均有不同程度的调节作用。与AKT相比,P-AKT的表达明显降低(见图4)。
CML是一种起源于造血干细胞的获得性克隆性疾病,其分子生物学特征是存在Bcr-Abl融合基因,该基因通过转录翻译产生分子量为210 KDa的融合蛋白P210 Bcr/Abl,该融合蛋白具有异常增高的酪氨酸激酶活性,使造血干细胞发生异常转化而导致CML的发生。治疗CML的靶向药物是酪氨酸激酶抑制剂甲磺酸伊马替尼。但是,近年来大部分患者对伊马替尼的应答期较短,最终可导致细胞对其耐药[7]。这种耐药性的获得是由于Bcr-Abl的复活产生的,而Bcr-Abl的复活主要是由于酪氨酸激酶的变异和基因的扩增引起的。我们实验室致力于寻找一种既能抑制Bcr-Abl,又能克服伊马替尼耐药的其他药物。在前期的实验中,我们发现棘霉素能强烈抑制K562细胞的增殖。如果能发现棘霉素是通过抑制Bcr-Abl的作用而致使K562细胞死亡,那么就对伊马替尼的耐药问题提供新的解决途径。
PI-3K/Akt(磷脂酰肌醇3激酶/蛋白激酶B通路)作为细胞内重要信号转导途径之一,通过影响下游凋亡相关蛋白、细胞周期调节蛋白等效应分子的活性,在抑制细胞凋亡和促进增殖中发挥着极为重要的作用。它具有以下作用:促进细胞的生长和增殖,抑制细胞凋亡;促进细胞侵袭和转移;促进血管生成,抵抗化疗和放疗中的细胞凋亡。PI-3K/Akt作为生长因子受体超家族信号转导过程中重要成员,可受多种细胞因子和理化因素激活,是联系细胞内外信号的关键分子[8]。研究棘霉素对K562细胞中AKT的影响对于进一步证实棘霉素的作用机制有重要意义。
综上所述,棘霉素能显著抑制K562细胞的生长,其机制可能与其抑制Bcr-Abl的表达和影响AKT信号通路有关。试验为治疗CML患者提供新的治疗方向。该实验仅为研究棘霉素作用的一部分,进一步的体外、体内试验还在进一步研究中。
[1]Leng F,Chaires J B,Waring M J.Energetics of echinomycin binding to DNA[J].Nucleic Acids Res,2003,31 (21):6191―6197.
[2]Lathan B,Von Hoff D D.Cytotoxic activity of echinomycin in a human tumor cloning system[J].Cancer Drug Deliv, 1984,1(3):191―198.
[3]Yonekura S,Itoh M,Okuhashi Y,et al.Effects of the HIF1 inhibitor,echinomycin,on growth and NOTCH signalling in leukaemia cells[J].Anticancer Res.2013 Aug,33(8):3099―3103.
[4]Garcia-Manero,G Talpaz M,Kantarjian H M.Current therapy of chronic myelogenous leukemia[J].Intern Med, 2002,41(4):256―264.
[5]Huang L,Xu Y W,Kuang Y W,et al.Purification and identification of antitumor secondary metabolites from soil Streptomycessp[J].2215 Nat Prod Res Dev,2009,21: 235―238.
[6]Zhang L,Zhou J,Jiang D X.Effects of imatinib on differentiation and function of dendritic cells generated from CD34+peripheral blood progenitor cells in vitro[J].Journal of Zhengzhou University(medical Sciences),2006,41 (4):742―743.
[7]Xu Y W,Zhao X L,Wang Y,et al.Comparison of expressions of P-glycoprotein,HIF-1α,and SPK between K562 and K562/Ima cells[J].Journal of Zhengzhou University (medical Sciences),2012,47(2):153―155.
[8]Liu H,Zhang M L,Wang J,et al.Expression of Akt2, p-Akt protein in lung cancer tissues[J].Journal of Zhengzhou University(medical Sciences),2007,42(4):675―677.
[责任编辑 时 红]
Effect of Echinomycin on Growth of K562 Cell Line and Related Kinases
DU Gangjun1,XU Yanwei2,LIN Haihong1
(1.Phɑrmɑceutiɑl College,Henɑn University,Kɑifeng,Henɑn 475004,Chinɑ;2.Depɑrtment of Phɑrmɑcy,Luoyɑng Third People's Hospitɑl,Luoyɑng,Henɑn 471002,Chinɑ)
ObjectiveTo explore the effect of echinomycin on the growth of K562 cell.MethodsIn experiments,K562 cells were treated with different concentrations(0.05,0.1,0.2,0.5,1.0,3.0μg/L),and the cell proliferation was determined by MTT assay.The cell cycle,Bcl-Abl and AKT were examined by FACS,Western blot methods,respectively.ResultsThe survival rate of K562 cells decreased gradually as the increase of echinomycin concentration,and the IC50was 0.82μg/L.With the increase of concentration,echinomycin dose-dependently inhibited the expression of tyrosine kinase,;the highest inhibition of AKT phosphorylation by echinomycin was seen at the concentration of 2.0μg/L.Conclusionechinomycin can inhibit the proliferation of K562 cells,and the underlying mechanism may be related to inhibition of Bcr-Abl and reduction of protein kinase B.phosphorylated AKT.
echinomycin;K562;cell cycle;Bcr-Abl;AKT
R966
A
1672―7606(2015)04―0229―03
2015-10-30
国家自然科学基金资助项目(30472082)
杜钢军(1971―),男,河南开封人,博士,教授,从事肿瘤药理学的研究工作。

