干预Hedgehog信号对肾小管上皮细胞增殖细胞核抗原表达的影响
陆红,吴莲凤,林成成,王斯璐,梁勇,白永恒
(温州医科大学附属第一医院,浙江 温州 325015,1.医学检验中心;2.外科实验室)
Hedgehog(HH)信号最早是在研究果蝇基因突变中被发现,主要由配体sonic hedgehog(Shh)、膜受体Patched 1(Ptch1)、信号开关蛋白Smoothened(Smo)及下游的转录因子Gli1组成[1]。在整个信号通路中,Shh、Smo及Gli1为正调节作用,而Ptch1则起着负调节作用。最近有研究报道,持续异常激活的HH信号可导致胰腺癌、器官纤维化等多种增殖性疾病的发生[2-3]。我们前期研究发现,HH信号参与了肾间质纤维化过程,诱导肾小管上皮细胞发生表型转化和基质累积[4-5],然而,其机制目前尚不清楚。因此,本研究拟通过外源性重组蛋白Shh来活化HH信号,以及环杷明特异性阻断HH信号的活化,检测肾小管上皮细胞增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达改变,旨在从体外实验角度观察调控HH信号对细胞增殖的影响。
1 材料和方法
1.1 材料 DMEM细胞培养液(美国Hyclone公司);胎牛血清(杭州四季青公司);胰蛋白酶和TRIzol提取液(美国Gibco公司);兔抗鼠Ptch1、Smo、Gli1和PCNA单克隆抗体(美国Santa Cruz公司);RT-PCR试剂(美国Promega公司);重组蛋白Shh和环杷明(美国PeproTech公司);MyCycler梯度PCR仪(美国Bio-Rod公司);7500定量PCR仪(美国Applied Biosystens公司);Varioskan Flash全波长多功能扫描仪(美国Thermo Scientific公司);DM4000 B LED荧光正置显微镜(德国Leica公司)。
1.2 方法
1.2.1 细胞培养:大鼠肾小管上皮细胞系(NRK-52E)购于中科院上海生命科学研究院细胞资源中心。细胞培养条件为5%胎牛血清的DMEM培养液,置于37 ℃,5% CO2培养箱。实验前,调整细胞至适当密度并铺板于六孔板中,当细胞融合度为50%~70%时,开始正式实验。设立组别:对照组:不加入Shh和环杷明;活化组:细胞培养基中加入10μg/L Shh;干预组:在10μg/L Shh基础上,加入5μmol/L环杷明。各组细胞培养24 h后,用倒置相差显微镜观察细胞形态学变化。
1.2.2 real-time RT-PCR检测mRNA表达:采用Trizol试剂盒提取各组细胞总RNA,根据RT-PCR试剂说明书将RNA反转录成cDNA。针对Ptch1和Smo mRNA设计特异性引物,以β-actin作为内参,采用real-time RT-PCR相对定量法进行检测。引物序列如表1所示,由上海捷瑞公司合成。取反转录产物1μL进行定量PCR,PCR扩增体系:5μL 2×SYBR Green荧光定量试剂、上下游引物各1μL,终浓度为200 nmol/L、1μL cDNA、2μL反应缓冲液。扩增程序为:95 ℃5 min、95 ℃ 10 s、60 ℃ 35 s,40个循环。通过熔解曲线评价PCR结果可靠性,采用2-△△Ct计算相对mRNA表达量。△△Ct=[Ct目的基因(待测样品)-Ct内参(待测样品)]-[Ct目的基因(校正样品)-Ct内参(校正样品)]。

表1 扩增Ptch1和Smo mRNA特异性引物
1.2.3 细胞免疫荧光检测HH信号和PCNA蛋白表达:取对数生长期NRK-52E细胞,分别加入溶剂,10μg/L Shh和10μg/L Shh基础上加入5μmol/L环杷明进行爬片培养24 h,吸去培养液,4%甲醛固定,用含0.03% Triton X-100的PBS对细胞进行破膜。5%二抗血清封闭孵育,行一抗孵育与二抗孵育,用DAPI进行核染,封片剂封片,置于荧光显微镜下观察并图像获取Ptch1、Smo、Gli1和PCNA的表达情况。
1.3 统计学处理方法 采用SPSS13.0软件包进行统计学分析。结果以 ±s表示,两样本比较采用t检验和精确概率法,多组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 重组蛋白Shh及环杷明对HH信号的影响 细胞免疫荧光染色结果显示,对照组细胞中Ptch1表达较高,Smo和Gli1表达较低,提示HH信号活性较低。应用10μg/L Shh作用NRK-52E细胞24 h后,Ptch1蛋白表达显著下降,而Smo和Gli1蛋白表达显著升高,见图1。Real-time RT-PCR结果也显示,Ptch1 mRNA表达下降,Smo mRNA表达升高(见表2)。这些结果提示HH信号通路被Shh活化。用环杷明进行干预后,Ptch1表达升高,Smo和Gli1表达下调(见图2)。此外,Ptch1 mRNA表达量也显著上调,而Smo mRNA表达下调(见表2)。因此,Shh诱导NRK-52E细胞中HH信号的活化,可被环杷明所阻滞。
2.2 重组蛋白Shh及环杷明对PCNA表达的影响PCNA作为细胞增殖最重要的标志物之一,主要定位表达于细胞核中。对照组NRK-52E细胞中PCNA的表达水平较低(见图2a和2a’),而活化组细胞表达PCNA蛋白的水平明显上调(见图2b和2b’)。此结果提示,Shh活化HH信号后,可引起细胞增殖性反应。加入环杷明后,抑制了由Shh所致的PCNA高表达(见图2c和2c’)。此外,我们也发现,原本核染位置的PCNA也游离到胞浆之外,这提示环杷明可诱导NRK-52E细胞出现凋亡、坏死等形态学改变。
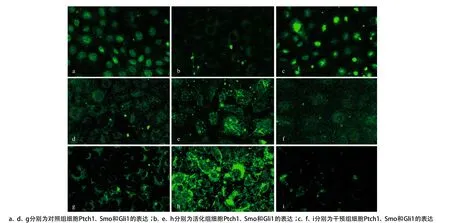
图1 重组蛋白Shh及环杷明对HH信号的影响(×400)
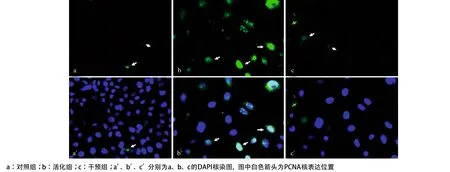
图2 活化和阻断HH信号对NRK-52E细胞PCNA的影响(×400)
2.3 活化和抑制HH信号对NRK-52E细胞增殖的影响倒置相差显微镜下,正常的肾小管上皮细胞相互重叠生长,呈铺路石状;当重组蛋白Shh作用后,肾小管上皮细胞数量增加的同时细胞形态变得不规则,且细胞边界明显;而当环杷明对活化组进行干预后,细胞变大,细胞数量减少且间隙变宽,细胞间甚至形成空洞,见图3。这些结果提示活化HH信号对细胞增殖的影响不仅仅是细胞数目的增加,而且细胞形态也发生改变,如表型转化。

表2 各组间Ptch1和Smo mRNA表达量的比较(n=6, ±s)
3 讨论
HH信号是一条高度保守的信号通路,在哺乳动物中,HH信号通路对于器官发育、维持成熟组织的内环境稳定、慢性炎症中的组织修复和癌症发生等多种进程发挥着十分重要的作用[6]。

图3 活化和阻断HH信号对NRK-52E细胞增殖的影响(×400)
国外研究发现,在梗阻性胆管疾病中,HH信号可被活化,进而促进胆管上皮细胞表型转化,最终导致胆管组织纤维化的发生[3]。我们前期研究也显示,HH信号参与了肾间质纤维化过程[4-5]。在体外,马兜铃酸可诱导肾小管上皮细胞表达和释放TGF-β1,促进上皮细胞向间质细胞转化,从而导致基质成分I和III型胶原的过度累积[4]。在体内,输尿管梗阻引起了肾小管上皮细胞的表型转化,进而导致间质纤维化的发生[5]。在这些过程中,HH信号均被激活[7]。然而,HH信号如何调控小管上皮细胞的表型转化,其分子机制尚不十分清楚。Mill等[8]研究显示,活化的HH信号能够上调其转录靶蛋白Cyclin E和Cyclin D的表达,后两者加快细胞G/S期的转变,诱导细胞过度增殖和表型转化。本研究中,我们通过人为诱导HH信号的活化,发现PCNA表达显著增加。PCNA为细胞增殖信号相对较下游的标志物,其表达水平提高,意味着细胞过度增殖。这种增殖不仅表现为肾小管上皮细胞数目的增加,而且细胞形态上也发生了改变。我们推测,在损伤微环境中,多种因素可诱导HH信号的活化。活化的HH信号诱导自身或周围的上皮细胞不仅通过正常增殖维持一定的细胞数量,而且也通过异常增殖方式,转化为耐受力更强的肌成纤维细胞以维持生存[9]。这种增殖方式也就是由所谓的表型转化而形成的肌成纤维细胞能分泌胶原成分在局部累积导致纤维化。
环杷明是一种从藜芦属植物内分离得到的异甾体类生物碱。环杷明可通过特异性改变Smo空间构象,抑制其活性,从而抑制HH信号通路[10]。此外,环杷明与Smo结合能够使细胞的分裂停止于G0/G1期,诱导细胞凋亡,从而抑制细胞增殖。本研究也证实了活化的HH信号可被环杷明所抑制,并且PCNA的表达也明显下调。下调的PCNA与小管上皮细胞增殖的抑制密切相关,这结果也从形态学角度得到验证。镜下我们观察到,环杷明抑制了细胞的增殖,并且诱导了细胞的凋亡坏死。
综上所述,通过干预HH信号,可以调控PCNA的表达,进而影响细胞增殖效应。然而,这种不仅增加细胞数目,而且也诱导细胞发生表型转化的增殖性调控机制还需今后的研究加以论证。
[1] Yauch RL, Gould SE, Scales SJ, et al. A paracrine requirement for hedgehog signalling in cancer[J]. Nature,2008, 455(7211): 406-410.
[2] Onishi H, Katano M. Hedgehog signaling pathway as a new therapeutic target in pancreatic cancer[J]. World J Gastroenterol, 2014, 20(9): 2335-2342.
[3] Omenetti A, Porrello A, Jung Y, et al. Hedgehog signaling regulates epithelial-mesenchymal transition during biliary fi brosis in rodents and humans[J]. J Clin Invest, 2008, 118(10): 3331-3342.
[4] 白永恒, 洪炜龙, 刘彪, 等. Sonic Hedgehog信号参与马兜铃酸损伤肾小管上皮细胞的体外实验研究[J]. 中华肾脏病杂志, 2013, 29(4): 288-292.
[5] 白永恒, 陆红, 周琴, 等. Sonic Hedgehog信号通路在单侧输尿管梗大鼠肾组织中的表达变化及意义[J]. 中国病理生理杂志, 2012, 28(12): 2227-2232.
[6] Katoh Y, Katoh M. Hedgehog signaling pathway and gastrointestinal stem cell signaling network[J]. Int J Mol Med,2006, 18(6): 1019-1023.
[7] Ding H, Zhou D, Hao S, et al. Sonic hedgehog signaling mediates epithelial-mesenchymal communication and promotes renal fi brosis[J]. J Am Soc Nephrol, 2012, 23(5): 801-813.
[8] Mill P, Mo R, Fu H, et al. Sonic hedgehog-dependent activation of Gli2 is essential for embryonic hair follicle Development[J]. Genes Dev, 2003, 17(2): 282-294.
[9] 胡丽萍, 陆红, 白永恒, 等. 小G蛋白Rac1在马兜铃酸诱导肾小管上皮细胞损伤中的作用及意义[J]. 温州医学院学报, 2013, 43(12): 775-778.
[10] Tremblay MR, Nevalainen M, Nair SJ, et al. Semisynthetic cyclopamine analogues as potent and orally bioavailable hedgehog pathway antagonists[J]. J Med Chem, 2008, 51(21): 6646-6649.

