血清基质金属蛋白酶及其抑制剂与肥胖儿童左心室功能的关系
蓝俊伟,兰菊红,兰文胜,刘晟,潜丽俊
(丽水市中心医院 儿科,浙江 丽水 323000)
近年肥胖儿童逐渐增多。肥胖会影响人群心脏结构,降低心脏舒张及收缩功能,增加心肌重量,同时肥胖可合并血糖、血脂、胰岛素等代谢紊乱,是心血管疾病的重要危险因素。而血清基质金属蛋白酶(matrix metalloproteinases,MMPs)是一组能特异地降解细胞外基质(extracellar matrix,ECM)成分的Zn2+依赖的酶家族,是组织重塑过程中心脏基质降解的主要因素,血清基质金属蛋白酶抑制剂(matrix metalloproteinases inhibitor,TIMPs)是近年发现抑制MMPs活性的一组多功能因子家族,它们之间的动态平衡对于保持心血管系统的完整性起着重要的作用[1]。虽然有研究发现心力衰竭、先天性心脏病等患儿存在MMPs及TIMPs的改变[2-3],但到目前为止仍只有很少的证据显示它们在肥胖儿童中的作用。本研究在于了解学龄期肥胖儿童MMPs及TIMPs改变情况,观察肥胖儿童左心结构和功能改变情况以及与MMPs的相关性,以新的角度进一步研究了解肥胖儿童心脏重塑的发病机制,以认识儿童肥胖的危害性。
1 资料和方法
1.1 一般资料 选取2012年6月至2013年6月来我院诊疗的学龄期肥胖儿童30例,其中男15例,女15例,年龄5~14岁,中位年龄8岁。纳入标准:选择体质量指数(BMI)在同年龄、同性别第95百分位数或以上的儿童为肥胖组;选择同期30例正常儿童为对照组,其中男15例,女15例,年龄5~13岁,中位年龄7.5岁。2组的性别、年龄等差异无统计学意义,具有可比性。所有对象均无先天性遗传性疾病、代谢性疾病及神经内分泌疾病,家属均签署知情同意书。
1.2 方法 所有观察者均隔夜禁食12 h,于次日清晨8时排空小便,脱鞋帽,穿单衣,测量身高、体质量,连续3次取其平均值,计算BMI=体质量(kg)/身高2(m2),测收缩压、舒张压。晨起仰卧、静息状态下抽肘静脉血3 mL,加入含抑肽酶和EDTA抗凝管中,30 min内以3 000 r/min离心10 min,分装血清,-70 ℃冰冻保存,成批待测。采用全自动生化仪检测血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)。采用葡萄糖氧化酶法测空腹血糖(FPG)。使用美国伯乐公司生产的550型酶标仪采用酶标多克隆抗体夹心法测定血清MMP-8、MMP-9及TIMP-1的浓度,由专业检测员严格按试剂规定方式操作。按照美国心脏彩色多谱勒超声描记学会标准测定左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室后壁厚度(LVPWT)、室间隔厚度(IVST)。用Simpson法测量左室射血分数(LVEF)、左室短轴缩短分数(LVFS),测值取3次心动周期的平均值。
1.3 统计学处理方法 采用SPSS16.0统计软件进行统计学处理。计量数据采用 ±s表示,使用数据库系统进行数据的筛选和分析。正态分布的组间比较采用t检验,非正态分布的组间比较采用秩和检验,血清MMPs浓度与超声心动图指标的相关性检验采用Pearson检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本实验数据的比较 肥胖组BMI、TC、HDLC、收缩压、舒张压、FPG明显高于对照组(P<0.05),具体见表1。
2.2 2组血清MMPs与TIMP的比较 肥胖组血清MMP-8、MMP-9浓度显著高于对照组,相反肥胖组儿童血清TIMP-1显著低于对照组,肥胖组MMPs/TIMP比值显著高于对照组,各组间差异均有统计学意义(P<0.05),同组男女之间MMPs及TIMP浓度差异无统计学意义(P>0.05)。见表2。
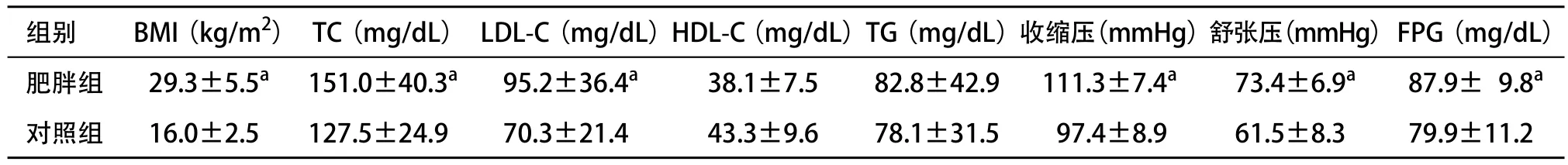
表1 2组基本实验数据的对比(n=30, ±s)
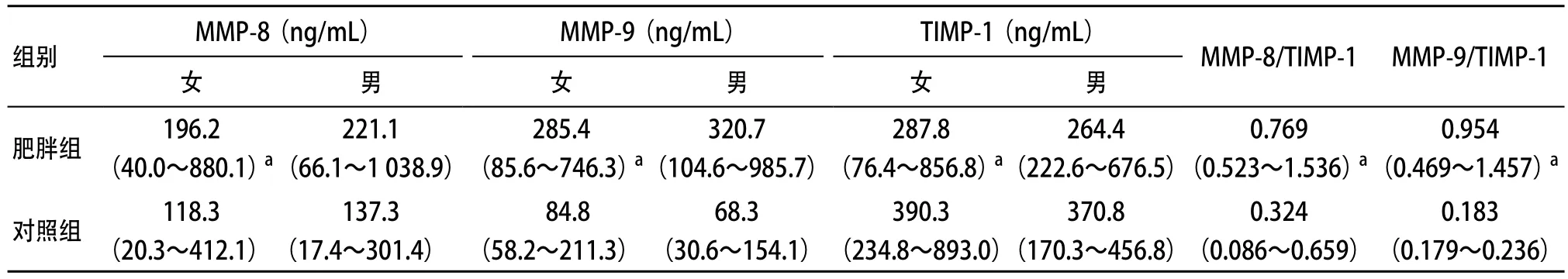
表2 2组血清MMPs与TIMP对比的结果(n=30)
2.3 左心室超声心动图指标的比较 肥胖组LVEDD、LVESD、LVPWT、IVST均明显高于对照组,差异均有统计学意义(P<0.05)。2组间LVEF、LVFS差异无统计学意义(P>0.05)。见表3。
2.4 血清MMP-8、MMP-9与心脏超声心动图功能指标的相关性分析 肥胖组MMP-8、MMP-9与左心功能指标呈现正相关(均P<0.05)。见表4。

表3 2组儿童左心室超声心动图指标的比较(n=30,±s)

表4 肥胖组血清MMPs与心脏超声心动图功能指标的相关性分析
3 讨论
MMP-8又称中性粒细胞胶原酶,由中性粒细胞和内皮细胞产生,它涉及胶原的降解,可引起动脉粥样硬化斑块的不稳定性[4]。最近两项大型研究发现MMP-8的浓度与冠状动脉病变的严重性[5]及颈动脉斑块的进展呈正相关[6];越来越多的证据表明MMP-8与慢性炎症性疾病及心血管疾病密切相关[7],代谢综合征合并心血管疾病的患者MMP-8是显著升高的[8]。我们的研究发现肥胖组与对照组相比,MMP-8/TIMP-1的比值在肥胖组是升高的,指出MMP-8在肥胖儿童中的内在活性。虽然有研究[9]发现在亚临床的动脉粥样硬化患者中,MMP-8浓度(而不是TIMP-1的浓度)升高可以预测其中并发最严重的心血管疾病。本研究中血清MMP-8浓度亦升高,并显示肥胖增加了心血管疾病的发病危险,与上述研究支持同一个观点。至于在肥胖人群中MMP-8是否可以作为心血管疾病早期诊断的预测因子以及MMP-8/TIMP-1的比值相对于MMP-8的单独活性是否可能是更好的预测因子将是我们进一步研究的方向。
MMPs作为ECM的重要酶解系统,在脂肪组织的扩张与重塑中起到了重要的作用[10]。MMP-9主要来源于脂肪组织中的基质血管组分[11-12],而基质血管主要由未成熟的脂肪细胞、巨噬细胞、内皮细胞等组成;未成熟的脂肪细胞比诱导分化成熟的脂肪细胞释放更高水平的MMP-9,表明MMP-9在脂肪组织的扩张与重塑中起到了重要的作用。Unal等[13]在成人肥胖的研究中发现MMP-9是心血管疾病的标志,它的水平与BMI呈正相关,而与胰岛素的敏感性呈负相关。虽然Goldberg等[14]指出TIMP-1是MMP-9的主要预测因子,Martinez等[15]、Glowinska-Olszewska等[16]发现MMP-9及TIMP-1在合并高血压的肥胖儿童中是升高的,但在单纯性肥胖儿童中,目前暂无依据表明他们之间的相关性。我们的研究发现肥胖儿童血清MMP-9显著升高,且MMP-9/TIMP-1显著升高,差异均有统计学意义(P<0.05),表明肥胖增加了儿童心血管疾病的危险因素。目前关于MMP-9涉及脂肪细胞分化的研究,Bouloumie等[17]提供了第一个研究成果:人类的脂肪组织,更确切地说,是脂肪细胞和未分化成熟的脂肪细胞可以产生和分泌MMP-9,这些研究指出通过调节MMPs的产生可能对脂肪细胞的分化及对肥胖发展进程中的细胞外重塑起着调节作用;最后,通过对未分化成熟的脂肪细胞应用MMPs的抑制剂(诸如巴马斯他、巯甲丙辅酸、抗中性粒细胞抗体等),减少了脂肪细胞的分化,从而证明抑制脂肪细胞分化的结果是脂肪生成(甘油三脂)和脂肪降解(甘油的释放和激素敏感的脂肪酶的表达)标志物生成的减少。这些研究指出MMP-9是脂肪细胞分化及ECM重塑的重要调节因子。因此,从脂肪衍生出的MMPs可能代表一个新的靶向治疗的目标,而它是通过抑制脂肪细胞的分化、ECM重塑及血管的生成;从而抑制脂肪组织的生长。
有研究指出肥胖与低脂联素血症相关[18-21],最近Kumada等[22]的研究发现脂联素可以增加巨噬细胞TIMP-1的表达。我们的研究发现,与对照组相比TIMP-1的浓度在肥胖儿童中是显著降低的(P<0.05);因此,我们推测肥胖相关性的低脂联素血症可能会降低循环中TIMP-1的水平,然而,这个假设仍需更多的研究去验证。
已有研究证明,由于肥胖者循环血量及心输出量增加,左心室壁在持续高血压作用下,出现离心性肥厚,室壁增厚不能代偿心室扩张时,心室收缩功能就会下降,心肌逐渐发生重构,心肌细胞肥大、纤维化并伴有间质胶原沉积,长期左心衰竭可使肺静脉压升高,最终出现肺动脉高压和右心衰竭。由于这些机制发生的心力衰竭被称为肥胖性心肌病[23-24]。而在肥胖性心肌病发生之前,亚临床心肌病的发现以及对它早期的干预异常重要。众所周知,相比于其他一些新发现的技术,心脏超声检查被认为是目前诊断无症状的肥胖性心脏功能紊乱最常见以及最可靠的技术手段。心脏射血分数(EF)及左室短轴缩短分数(FS)是评估左室收缩功能最常用的参数。研究发现肥胖早期EF及FS没有降低,反而升高[25-29];我们的研究发现肥胖组与对照组之间LVEF及LVFS没有明显差异。LVEDD、LVESD、LVPWT、IVST是作为评估左室舒张功能的常用指标。一项由23位正常成人,28位中度肥胖、16位重度肥胖成人组成的实验中,两肥胖组LVEDD的水平显著高于正常对照组[30];在一项由341位儿童组成的实验研究[26]中,发现肥胖指数与LVEDD之间呈明显的正相关;而最近一项由30位肥胖儿童与30位正常儿童组成的对照实验[29]发现,肥胖组LVEDD、LVESD、LVPWT、IVST的水平高于正常对照组(P<0.05)。我们的研究与上述研究相符,表明肥胖引起了儿童左室结构与功能的改变。ECM降解与合成的失衡是心肌重塑过程中的一大决定性因素,其中MMPs作为机体内参与ECM降解的最主要的酶系统,是心肌重塑的主要推动力量[31]。而MMPs与TIMPs之间相互作用所构成的动态平衡,维持着正常心肌ECM的分解与合成。我们的研究发现,肥胖儿童血清中存在MMPs的改变,MMP-8及MMP-9是升高的,而TIMP-1是下降的;虽然肥胖儿童左心收缩功能未发生改变,但是代表左室舒张功能的指标在心超中已经提示改变,且血清MMPs的浓度与心脏的舒张功能指标呈正相关。由此我们推测肥胖增加了心血管疾病的危险因素,而MMPs可能通过改变ECM的重塑,从而引起左心结构与功能改变,具体的机制有待更深一步的研究。
[1] Beaudeux JL, Giral P, Bruckert E, et al. Matrix metalloproteinases inf ammation and atherosclerosis: therapeutic perspectives[J]. Clin Chem Lab Med, 2004, 42(2): 121-131.
[2] 黄志伟, 刘玉胜, 耿秀娟, 等. 心力衰竭患儿血清基质金属蛋白酶-2水平变化[J]. 实用儿科临床杂志, 2007, 22(13):988-989.
[3] 庞玉生, 曾红军, 于丽娟, 等. 先天性心脏病并肺动脉高压患儿血清基质金属蛋白酶-1、2与金属蛋白酶组织抑制物-1水平变化的意义[J]. 实用儿科临床杂志, 2008, 23(1):28-30.
[4] Herman MP, Sukhova GK, Libby P, et al. Expression of neutrophil collagenase (matrix metalloproteinase-8) in human atheroma: a novel collagenolytic pathway suggested by transcriptional profiling[J]. Circulation, 2001, 104(16): 1899-1904.
[5] Souza-Costa DC, Sandrim VC, Lopes LF, et al. Anti-inf ammatory effects of atorvastatin: modulation by the T-786C polymorphism in the endothelial nitric oxide synthase gene[J]. Atherosclerosis, 2007, 193(2): 438-444.
[6] Turu MM, Krupinski J, Catena E, et al. Intraplaque MMP-8 levels are increased in asymptomatic patients with carotid plaque progression on ultrasound[J]. Atherosclerosis, 2006,187(1): 161-169.
[7] Koh KK, Han SH, Quon MJ. In f ammatory markers and the metabolic syndrome: insights from therapeutic interventions[J]. Am Coll Cardiol, 2005, 46(11): 1978-1985.
[8] Aquilante CL, Beitelshees AL, Zineh I. Correlates of serum matrix metalloproteinase-8 (MMP-8) concentrations in nondiabetic subjects without cardiovascular disease[J]. Clin Chim Acta, 2007, 379(1-2): 48-52.
[9] Tuomainen AM, Nyyssonen K, Laukkanen JA, et al. Serum matrix metalloproteinase-8 concentrations are associated with cardiovascular outcome in men[J]. Arterioscler Thromb Vasc Biol, 2007, 27(12): 2722-2728.
[10] Chavey C, Mari B, Monthouel MN, et al. Matrix metalloproteinases are differentially expressed in adipose tissue during obesity and modulate adipocyte dif ferentiation[J]. Biol Chem, 2003, 278(14): 11888-11896.
[11] Nair S, Lee YH, Rousseau E, et al. Increased expression of inflammation-related genes in cultured preadipocytes/stromal vascular cells from obese compared with non-obese Pima Indians[J]. Diabetologia, 2005, 48(9): 1784-1788.
[12] Croissandeau G, Chretien M, Mbikay M. Involvement of matrix metalloproteinases in the adipose conversion of 3T3-L1 preadipocytes[J]. Biochem, 2002, 364(3): 739-746.
[13] Unal R, Yao-Borengasser A, Varma V, et al. Matrix metalloproteinase-9 is increased in obese subjects and decreases in response to pioglitazone[J]. Clin Endocrinol Metab, 2010,95(6): 2993-3001.
[14] Goldberg GI, Strongin A, Collier IE, et al. Interaction of 92-kDa type IV collagenase with the tissue inhibitor of metalloproteinases prevents dimerization, complex formation with interstitial collagenase, and activation of the proenzyme with stromelysin[J]. Biol Chem, 1992, 267(7): 4583-4591.
[15] Martinez ML, Lopes LF, Coelho EB, et al. Lercanidipine reduces matrix metalloproteinase-9 activity in patients with hypertension[J]. Cardiovasc Pharmacol, 2006, 47(1):1 17-122.
[16] Glowinska-Olszewska B, Urban M. Elevated matrix metalloproteinase 9 and tissue inhibitor of metalloproteinase 1 in obese children and adolescents[J]. Metabolism, 2007, 56(6):799-805.
[17] Bouloumie A, Sengenes C, Portolan G, et al. Adipocyte produces matrix metalloproteinases 2 and 9: involvement in adipose differentiation[J]. Diabetes, 2001, 95(6): 2993-3001.
[18] Valle M, Martos R, Gascon F, et al. Low-grade systemic inf ammation, hypoadiponectinemia and a high concentration of leptin are present in very young obese children, and correlate with metabolic syndrome[J]. Diabetes Metab, 2005,31(1): 55-62.
[19] W eyer C, Funahashi T, Tanaka S, et al. Hypoadiponectinemia in obesity and type 2 diabetes: close associationwith insulin resistance and hyperinsulinemia[J]. Clin Endocrinol Metab, 2001, 86(5): 1930-1935.
[20] S tefan N, Bunt JC, Salbe AD, et al. Plasma adiponectin concentrations in children: relationships with obesity and insulinemia[J]. Clin Endocrinol Metab, 2002, 87(10): 4652-4656.
[21] Reinehr T, Roth C, Menke T, et al. Adiponectin before and after weight loss in obese children[J]. Clin Endocrinol Metab, 2004, 89(8): 3790-3794.
[22] Kumada M, Kihara S, Ouchi N, et al. Adiponectin specif -cally increased tissue inhibitor of metalloproteinase-1 through interleukin-10 expression in human macrophages[J].Circulation, 2004, 109(17): 2046-2049.
[23] Alpert MA. Management of obesity cardiomyopathy[J]. Am J Med Sci, 2001, 321(4): 237-241.
[24] Mahoney LT, Schieken RM, Clarke WR, et al. Left ventricular mass and exercise responses predict future blood pressure[J].Hypertension, 1988, 12(2): 206-213.
[25] Kinik ST, Varan B, Yildirim SV, et al. The effect of obesity on echocardiographic and metabolic parameters in childhood[J]. Pediatr Endocrinol Metab, 2006, 19(8): 1007-1014.
[26] Kono Y,Yoshinaga M, Oku S, et al. Ef fect of obesity on echocardiographic parameters in children[J]. Int J Cardiol,1994, 46(1): 7-13.
[27] Sharpe JA, Naylor LH, Jones TW, et al. Impact of obesity on diastolic function in subjects [28] Mehta SK, Holliday C, Hayduk L, et al. Comparison of myocardial function in children with body mass indexes>/=25 versus those<25 kg/m2[J]. Am J Cardiol, 2004,93(12): 1567-1569. [29] Uner A, Dogan M, Epcacan Z, et al. The effect of childhood obesity on cardiac functions[J]. Pediatr Endocrinol Metab,2013, 36(1-2):1-11. [30] Garavaglia GE, Messerli FH, Nunez BD, et al. Myocardial contractility and left ventricular function in obese patients with essential hypertension[J]. Am J Cardiol, 1988, 62(2):594-597. [31] Hijova E. Matrix metalloproteinases: their biological functions and clinical implications[J]. Am J Bratisl Lek Listy,2005, 106(3): 127-132.

