持续被动运动通过抑制软骨细胞NO合成下调MMP-1和MMP-13表达
李洪武
(郑州航空工业管理学院体育部,河南郑州 450015)
骨关节炎(osteoarthritis,OA)是一种慢性、渐进性和退行性关节病变,以关节软骨退变、滑膜炎症为特征,引起关节疼痛和功能障碍,严重时需要进行全关节置换。OA是老年人最常见的关节疾病,在年龄超过50岁的人群中,OA在导致长期残疾的疾病中仅次于心血管疾病,因此严重危害老年人的健康和生活质量[1]。临床实践证实,运动疗法对 OA具有显著疗效[2],针对活动能力受限的OA患者,持续被动运动(continuous passive motion,CPM)方式可促进组织修复、恢复关节活动度、减轻疼痛、预防深静脉血栓、缩短住院时间并减少开支[3,4]。目前的观点认为:CPM最早可在OA患者术后麻醉尚未消退时进行[5]。但运动治疗OA的具体机制仍不清楚。研究表明,基质金属蛋白酶(matrix metalloproteinase,MMPs)和一氧化氮(nitric oxide,NO)在 OA 发病机制中起重要作用[6],MMPs对软骨细胞外基质(extracellular matrix,ECM)有极强的降解作用[7],NO 由一氧化氮合酶(nitric oxide synthase,NOS)催化产生并介导软骨ECM降解和软骨细胞凋亡[8]。针对内皮细胞的研究指出,NO可提高MMPs的表达和/或活性[9],但OA发生时,软骨组织内NO对MMPs调控的机制尚不确定。动物实验与临床研究均表明,CPM对OA的疗效与MMPs表达下调有关[10],但CPM是否通过抑制NO信号途径调控MMPs水平,尚不得而知。硝酸甘油(nitroglycerin,NG)在体内代谢产生1,2-二硝基甘油和亚硝酸盐,亚硝酸盐在线粒体内进一步代谢生成NO,因此NG是NO的供体。本研究以雄性新西兰大白兔为研究对象建立膝关节OA模型,观察CPM和补充NG对软骨细胞MMP-1和MMP-13表达以及NO含量的影响,探讨CPM下调MMPs的可能机制。在众多MMPs中,我们选取MMP-1和MMP-13是由于二者均属于胶原酶亚型(降解软骨ECM中含量最多的Ⅱ型胶原)且在OA中起关键作用[6,11],而且其他 MMPs也是通过二者起作用的[7]。
1 材料与方法
1.1 材料
(1)实验动物:纯种雄性新西兰大白兔30只,3~4月龄,体重2.8kg~4.2kg,由河南省实验动物中心提供(实验动物批号:20110302;许可证号:SCXK(豫)-2011-0001)。(2)药物:2%NG软膏,购自协和药业有限公司,生产批号:H20100195。(3)试剂:NO含量测定试剂盒购自南京建成生物工程研究所;RNA提取试剂盒、逆转录试剂盒、PCR引物、MMP-1和MMP-13抗体、免疫组化试剂盒购自北京宝泰克生物科技有限公司;DAB显色盒购自武汉博士德生物工程公司。其余试剂均为市售分析纯。(4)仪器:CPM仪由中南大学湘雅二医院提供;美国Beckman公司DU800型可见-紫外分光光度计;美国ABI公司7900 hT型实时荧光定量PCR仪。
1.2 模型制备
30只大白兔,取24只行单侧膝关节前交叉韧带切断术建立膝关节OA模型[12]。3%戊巴比妥钠经由耳缘静脉麻醉动物后使其仰卧固定于兔台上,于膝内侧切开关节囊,打开关节腔,将膝关节内侧副韧带、前交叉韧带切断并切除内侧半月板。造模成功后,冲洗关节腔,逐层缝合。另取6只进行假手术,暴露内侧副韧带、前交叉韧带和内侧半月板,不做切断而直接闭合关节腔。术后连续3d肌注青霉素20万单位/次/d预防感染。在麻醉清醒后笼内休息l天,术后第2天开始正式实验。
1.3 干预分组
将6只假手术动物作为正常对照组(normal control group,NC组)。另外24只OA模型动物,术后随机分为4组,每组各6只:(1)OA对照组(osteoarthritis control group,OA组):与NC组均不实施任何干预,笼中自由饲养;(2)OA硝酸甘油给药组(nitroglycerin group,NG组):于膝内侧切口无毛处,局部涂抹2%NG软膏0.1mg,每天2次,共4周;(3)OA持续被动运动组(continuous passive motion group,CPM组):在CPM仪上进行膝关节持续被动运动(匀速运动,范围为40°~110°),每天早晚各一次,每次4h,共4周[13];(4)OA持续被动运动+硝酸甘油给药组(continuous passive motion+nitroglycerin group,CPM+NG组):运动方案同CPM组,给药方案同NG组,共4周。
1.4 取材与组织切片制作
实验结束后24h,空气栓塞处死动物。按前次手术入路暴露股骨髁关节面,用高速电钻钻取软骨标本,分为三份。一份直接投入液氮,转入﹣80℃低温冰箱冻存待测NO含量以及MMP-1和MMP-13 mRNA表达;另外一份于4%多聚甲醛固定48 h后石蜡包埋,切片,HE染色,光镜观察软骨形态学变化(软骨表面是否规则、有无裂隙,细胞数量、分布、排列是否规则,潮线是否完整)并参考Mankin’s评分标准[14]对HE染色标本进行评分比较;最后一份软骨组织用多聚甲醛固定后,再用10%EDTA(乙二胺四乙酸)脱钙10天,常规脱水、透明、石蜡包埋,5μm连续切片,进行MMP-1和MMP-13免疫组化检测。
1.5 NO含量测定
软骨组织匀浆后,采用硝酸还原酶法测定NO含量,550nm波长处,0.5cm光径测定吸光度值。计算公式为:NO含量(μmol/L)=(测定管吸光度值-空白管吸光度值)÷(标准管吸光度值-空白管吸光度值)×标准品浓度值×样品测试前的稀释倍数。
1.6 RQ-PCR检测MMP-1和MMP-13 mRNA水平
取10mg软骨组织匀浆后利用Trizol法(RNA提取试剂盒)抽提细胞总RNA,分光光度计检测RNA质量和浓度。取总RNA 3μg进行逆转录反应(逆转录试剂盒)得 cDNA。利用Primer 5.0设计上下游引物:MMP-1:上游:5’-AAGCCAGATGCTGAAACCCTG -3’,下 游:5’ - GACCCTTGGAGACTTTGGTGAAT-3’,扩增产物长度为328bp。MMP-13:上游:5’-TTGACCACTCCAAGGACCCAG -3’,下游:5’-GAGGATGCAGACGCCAGAAGA-3’,扩增产物长度252bp。内参为GAPDH:上游:5’-GAGCTGAACGGGAAACTCAC -3’,下游:5’-GGTCTGGGATGGAAACTGTG -3’,扩增长度 476bp。将cDNA样品配置于Real-time PCR 50μL反应体系中:10×Buffer 5μL,dNTP 混合液 1μL,MgCl2 溶液 3μL,Taq 聚合酶2μL,上下游引物各 2μL,cDNA 为 2μL,三蒸水 33μL。混合离心后置于实时荧光定量PCR仪中进行扩增反应,反应条件:94℃预变性5min,40 个 PCR 循环(94℃,30s;55℃,40s;72℃,30 s),最后72℃延伸5min。依据循环阈值(CT值)计算各基因的相对表达量(NC组的倍数)。
1.7 免疫组化检测MMP-1和MMP-13蛋白水平
石蜡切片常规脱蜡水化,0.1%胰酶37℃水浴20min进行抗原修复,3%H2O2室温浸泡10min灭活内源性酶。滴加5%BSA封闭液,室温封闭20min。加入稀释的羊抗兔MMP-1和MMP-13抗体(一抗),4℃孵育过夜,PBS缓冲液振洗3次,加入辣根过氧化物酶标记的二抗,室温孵育1h,PBS缓冲液振洗3次,DAB显色,镜下控制显色时间。脱水、透明,中性树脂封片。
用Image Pro Plus图像分析系统对软骨组织中出现的棕褐色阳性产物的灰度进行分析,步骤为:在切片中随机选取6个高倍镜(10×40光镜)不重叠视野作图像分析,镜下有棕褐色颗粒者为阳性细胞,测定阳性颗粒平均灰度值,取每张切片的均值作为MMP-1和MMP-13蛋白表达量。
1.8 统计学方法
数据以均数±标准差表示。组间比较使用单因素方差分析,LSD法进行两两比较。P<0.05为显著性水平,P<0.01为非常显著性水平。统计分析软件为SPSS 14.0 for Windows。
2 结果
2.1 体重的变化
NC组体重在整个实验过程中逐渐增加(P<0.01);OA组和NG组体重在第15天开始下降并持续到实验结束(P<0.01),可能与OA时关节疼痛导致的活动减少和饮食不足有关;CPM组和CPM+NG组体重无显著性变化(P>0.05)。见图1。
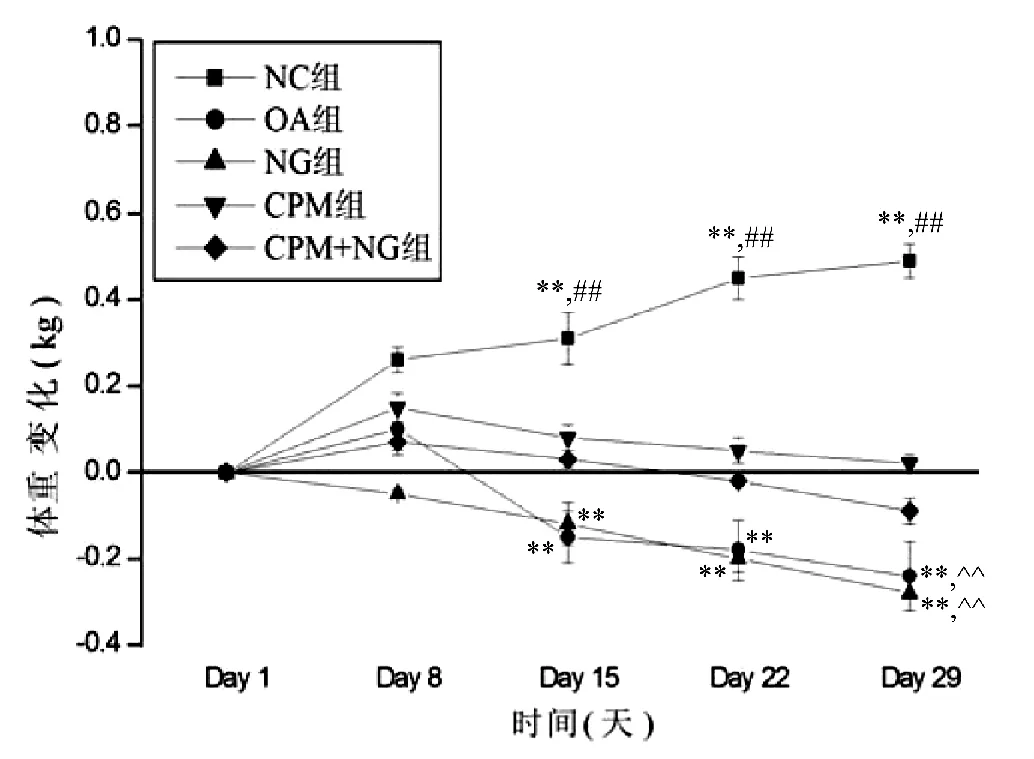
图1 各组动物体重的变化
2.2 HE染色观察
NC组为正常软骨组织,表面平整光滑无破损,软骨细胞核呈蓝色、排列整齐,潮线清晰可见,基质呈淡粉色,着色均匀;OA组关节软骨表面呈网格状硬化,软骨细胞丢失,潮线紊乱甚至消失,纤维结缔组织增生,基质破坏明显;NG组病理学变化较OA组更为明显,软骨细胞胞核、胞质结构无法辨认,细胞广泛丢失伴细胞坏死,基质染色明显不均并出现玻璃样变性,;CPM组可见软骨表面粗糙,细胞出现轻度变形或排列紊乱,细胞核固缩,潮线紊乱,基质染色尚均匀,基质变性较OA和NG组明显减轻;CPM+NG组软骨表面粗糙,有小的裂隙形成,细胞与基质破坏较OA和NG组有所减轻,但仍较CPM组严重。见图2。Mankin’s评分比较见表1。
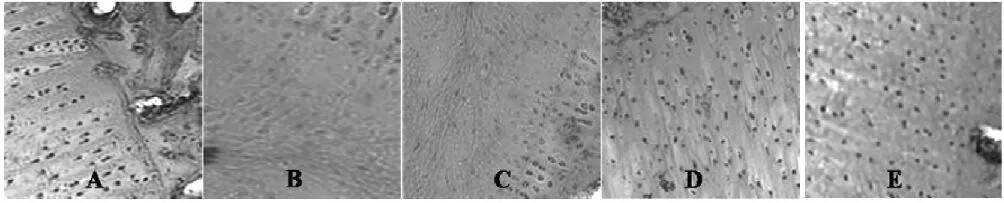
图2 HE染色(10×20)
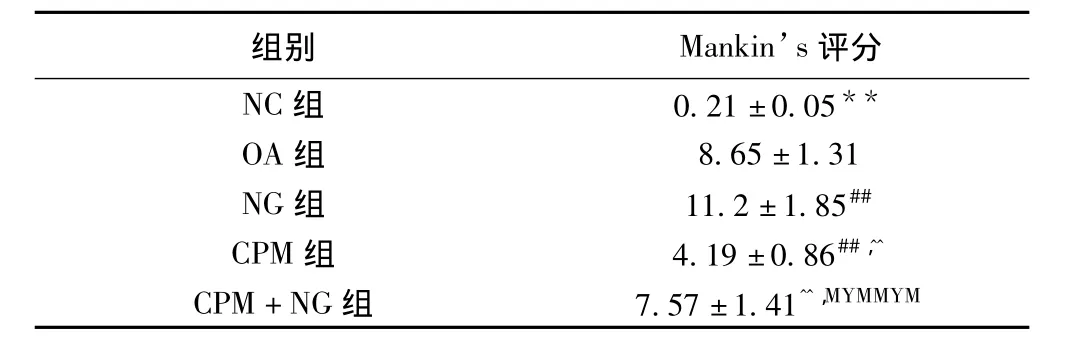
表1 各组软骨组织Mankin’s评分比较
2.3 NO含量
NC组NO含量低于其他各组(P<0.01);NG组高于OA组(P<0.01);CPM组低于OA组和NG组(P<0.01);CPM+NG组低于NG组(P<0.01),但高于CPM组(P<0.01),与OA组无显著性差异(P>0.05)。见图3。
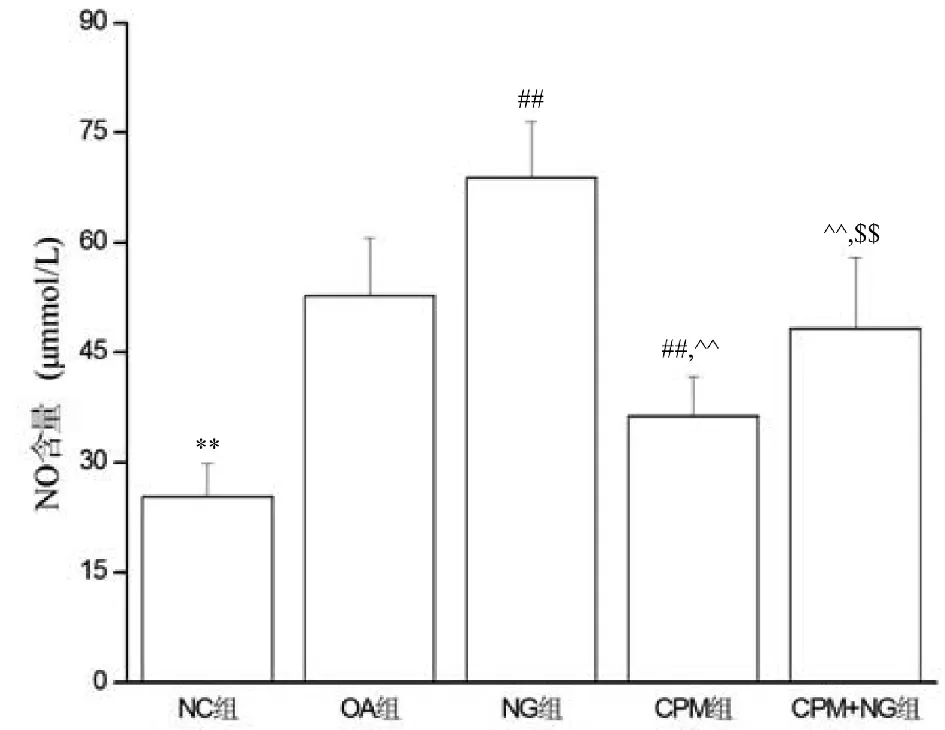
图3 各组NO含量的变化
2.4 MMP-1和MMP-13 mRNA变化
4周实验结束后,与NC组比较,其他各组MMP-1和MMP-13 mRNA均显著性升高(P<0.01);NG组高于OA组(P<0.01);CPM组高于低于OA组和NG组(P<0.01);CPM+NG组低于NG组(P<0.01),高于CPM组(P<0.01),与OA组无显著性差异(P>0.05)。见图4。
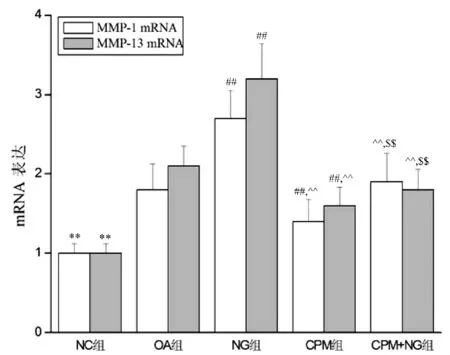
图4 各组MMP-1和MMP-13 mRNA的变化
2.5 MMP-1和MMP-13蛋白的变化
NC组MMP-1和MMP-13均呈弱阳性表达,仅在表层软骨细胞内偶见少许棕褐色颗粒;OA组MMP-1和MMP-13呈强阳性表达,全层可见,软骨基质、胞浆中均有深棕褐色颗粒。NG组阳性细胞表达率较OA组明显增多且染色深;CPM组可见阳性细胞表达,但其分布明显较OA组和NG组分布稀疏,且染色较浅;CPM+NG组MMP-1、MMP-13均较OA组合NG组表达降低(P<0.01),但仍高于CPM组。见图5和图6。灰度值范围0~255,灰度值越小,免疫染色程度越高,即蛋白表达量越多。结果显示,MMP-1和MMP-13蛋白表达量与mRNA的变化趋势基本一致,见表2。
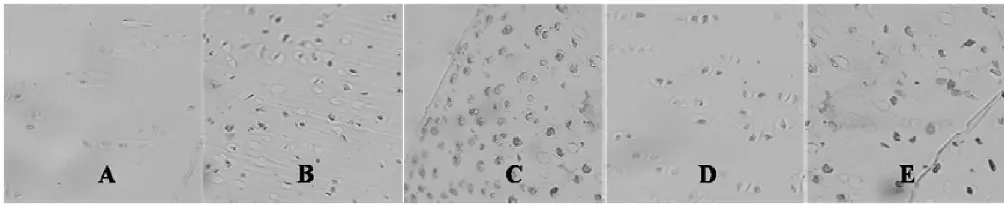
图5 MMP-1免疫组化(10×40)
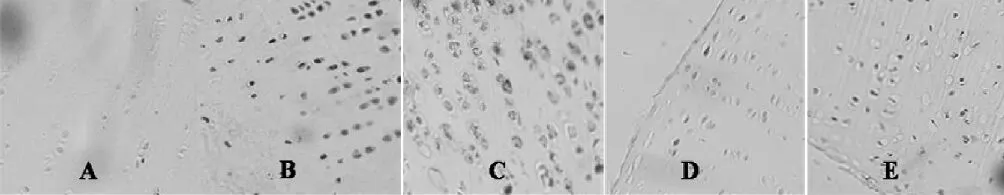
图6 MMP-13免疫组化(10×40)

表2 各组关节软骨中MMP-1和MMP-13染色平均灰度值
3 讨论
3.1 MMPs和NO在OA发病机制中的作用
关节软骨退变是OA最重要的标志。关节软骨属透明软骨,由软骨细胞和软骨ECM共同组成。软骨ECM起着缓冲机械负荷和减小关节摩擦的作用,主要成分是水、胶原和蛋白聚糖,其中胶原以II型胶原为主(占胶原总量的90%左右)[7]。MMPs是降解ECM的主要酶系,是维持正常组织可塑性和完整性以及在病理状态下(如OA)诱导软骨退变的主要因子[7],其中MMP-1和MMP-13可直接降解软骨ECM中最具特征、含量最多的Ⅱ型胶原,其表达增高程度与软骨组织破坏程度一致[6,11],而且其他 MMPs亚型对Ⅱ型胶原的降解也需要通过MMP-1或MMP-13起作用[7],因此两者的变化最能反映软骨基质的代谢变化。在本研究中,NC组(即正常软骨组织)MMP-1和MMP-13微量表达,以维持软骨ECM的代谢稳态与更新;而OA组MMP-1和MMP-13表达显著上调,打破了ECM合成分解的动态平衡,降解作用增强,软骨出现破坏,这与前人的研究一致[11],进一步证实了MMPs在OA中的作用。
NO由NOS催化左旋精氨酸产生,可作为信号分子、神经递质和免疫效应分子在体内多种生理病理过程中扮演关键角色。研究发现,正常软骨组织中无NOS表达,而OA时软骨细胞中NOS表达上调,NO合成增加[15],同时OA患者关节滑液中NO含量升高,提示NO在OA中起关键作用。本研究证实了这一结论,即OA组NO含量显著高于NC组。将NOS基因转入软骨细胞后发现,软骨细胞产生的大量NO可抑制软骨基质合成,促进胶原蛋白降解并诱导软骨细胞凋亡[8]。应用iNOS抑制剂则能够抑制NO的过量释放,改善软骨代谢环境,对软骨有一定的保护作用[16]。本研究建立兔OA模型后,给予NG处理后,发现NG组关节软骨退变明显较OA组加重,与Cake等[17]对绵羊的研究结果相似,说明OA时NOS过表达催化NO大量合成,促进软骨基质降解。OA时发生炎症反应和氧化应激并产生众多信号分子如白细胞介素 -1β(IL-1β)、肿瘤坏死因子 -α(TNF-α)和氧自由基(ROS),上述因子通过作用于NOS基因启动子序列进而激活NOS转录和翻译[7]。
3.2 NO对MMP-1和MMP-13的调节作用
尽管对OA时内源性NO抑制软骨基质合成作用较为肯定,但具体机制尚不明确。研究表明,多种组织中NO可上调MMPs,如在内皮细胞中,外源性补充NO可诱导MMP-13表达升高,NOS失活后 MMP -13表达下调[18,19],NO 可通过 cGMP-PKG信号途径(转录水平)[18]以及对蛋白(酪氨酸残基 -Tyr338)硝基化作用(翻译后修饰)[20]调控 MMP-13基因表达;骨发育过程中,NO通过cGMP-PKG途径磷酸化Cbfa-1,上调成骨细胞MMP-13表达,进而促进骨发生[21];软骨细胞培养证实,NO可上调MMP-2活性和表达量[22],而NOS抑制剂则可下调MMP-1表达[23]。结合上述研究,我们推测,在OA中,NO对软骨基质的降解作用可能是通过上调MMPs表达实现的。本研究建立OA模型,于在体条件下直接证实了这一假设,即OA组MMP-1和MMP-13的mRNA和蛋白表达量显著高于NC组,给予硝酸甘油处理后,其表达上调作用得到了加强,即NG组MMP-1和MMP-13的表达量显著高于OA组,提示NO可通过上调MMPs表达发挥对OA的负性效应。因此,NOS-NO-MMP-1/MMP-13是造成OA时ECM降解和病情进展的关键信号通路。
3.3 CPM通过抑制软骨细胞NO合成下调MMP-1和MMP-13表达
传统观点认为:OA(特别是创伤性OA)患者需要较长时间制动,往往因肌肉萎缩、关节内粘连等因素妨碍关节功能恢复,导致关节僵硬、运动能力受限。如何促进受损关节软骨的愈合与修复,是OA治疗研究中的重点内容。在目前常用的处理方法中,不管是制动、药物治疗、手术治疗还是组织工程学等方法,均有其不足之处。20世纪70年代,Salter等[24]提出CPM理论,并将其应用于关节软骨缺损后的修复过程,取得了令人满意的效果,为临床上防治OA的发生提供了新思路[3,4]。由于MMPs在OA发病机制中起关键作用,因此推测CPM对OA的疗效可能与MMPs下调有关。研究发现,关节过度使用(如长期超负荷运动)和废用(如关节固定)均可上调关节软骨MMPs表达并造成软骨组织降解,进而发生OA,而生理负荷强度运动(如日常活动)则具有维持关节软骨内环境稳态、预防软骨降解和改善关节功能的作用[10]。Leong等[10]的研究发现,中等强度被动运动可下调OA时软骨细胞MMP-1表达。利用血流切应力模拟运动负荷对体外培养的软骨细胞实施干预后发现,低切应力(5dyn/cm2)使MMP-1和MMP-13表达稍有下调,而高切应力(20 dyn/cm2)则使两者表达显著升高[25]。上述研究提示,运动对软骨细胞MMPs表达的效应具有运动强度依赖性。本研究采用的CPM方式,属于典型的中低强度运动负荷[24],结果发现,CPM 组 NO 含量、MMP-1和 MMP-13表达量虽然高于NC组,但均低于OA组,提示CPM通过抑制MMPs表达对OA起保护作用。
CPM是否通过抑制NO信号途径调控MMPs水平是本研究的主要目的,以期为临床OA患者治疗方案的制定(运动联合药物)提供理论依据,这一机制目前尚无报道。本研究在证实了NO和MMPs介导OA时软骨退变以及软骨细胞过量产生的NO诱导MMP-1和MMP-13表达上调的基础上,给予OA兔模型补充NG并实施运动干预,结果发现,与CPM组比较,CPM+NG组NO含量、MMP-1和MMP-13表达量均显著升高,虽然低于NG组,但与OA组无显著性差异,说明CPM对MMPs表达的抑制作用可被NO逆转,提示CPM对OA时软骨细胞的保护作用至少部分是通过减少NO合成实现的。当然,运动对OA时MMPs的调控除了NO信号途径外,还可能存在其他不依赖于NO的信号通路,如OA时TGF-β(转化生长因子-β)-ALK(活化素样激酶)-Smad信号途径可上调MMP-13表达[26],但运动对此信号转导的作用尚待进一步研究。
4 结论与展望
OA时软骨细胞NO大量产生并上调MMP-1和MMP-13表达,介导软骨基质降解和软骨损伤;CPM则通过抑制软骨细胞NO合成下调MMP-1和MMP-13表达,进而对软骨细胞起保护作用。这一分子机制的揭示对于临床OA患者运动康复以及CPM与相关药物(NO和MMPs抑制剂)的联合应用具有一定的理论与现实意义。
OA时不依赖于NO的MMPs调控机制以及运动干预的作用鲜有研究,此外,运动对软骨组织 NOS亚型(iNOS、eNOS、nNOS)的影响以及不同运动方式、不同运动强度对OA时NO、MMPs的影响尚无报道,今后的研究应进一步探讨运动以及运动联合药物对OA的作用机制并最终确定OA患者运动康复疗法的最佳运动方式和运动负荷以及临床治疗的最佳方案。
[1]Iversen MD.Rehabilitation interventions for pain and disability in osteoarthritis:a review of interventions including exercise,manual techniques,and assistive devices[J].Orthop Nurs,2012,31(2):103 -108
[2]Hiyama Y,Yamada M,Kitagawa A,et al.A four-week walking exercise programme in patients with knee osteoarthritis improves the ability of dual-task performance:a randomized controlled trial[J].Clin Rehabil,2012,26(5):403 - 412
[3]Fitzgerald GK,Piva SR,Gil AB,et al.Agility and perturbation training techniques in exercise therapy for reducing pain and improving function in people with knee osteoarthritis:a randomized clinical trial[J].Phys Ther,2011,91(4):452 -469
[4]Du Plessis M,Eksteen E,Jenneker A,et al.The effectiveness of continuous passive motion on range of motion,pain and muscle strength following rotator cuff repair:a systematic review[J].Clin Rehabil,2011,25(4):291 - 302
[5]王东,魏更生,宋华伟,等.持续被动运动在膝关节置换术后早期康复治疗中的作用[J].中国康复理论与实践,2011,17(5):459 -461
[6]窦晓丽,段晓琴,夏玲,等.骨关节炎:关节软骨退变的相关研究与进展[J].中国组织工程研究与临床康复,2011,15(20):3763-3766
[7] Goldring MB.Chondrogenesis,chondrocyte differentiation,and articular cartilage metabolism in health and osteoarthritis[J].Ther Adv Musculoskelet Dis,2012,4(4):269 -285
[8]Zhao Z,Ji H,Jing R,et al.Extracorporeal shock-wave therapy reduces progression of knee osteoarthritis in rabbits by reducing nitric oxide level and chondrocyte apoptosis[J].Arch Orthop Trauma Surg,2012,132(11):1547 -1553
[9]Zaragoza C,Balbin M,Lopez-Otin C,et al.Nitric oxide regulates matrix metalloprotease-13 expression and activity in endothelium[J].Kidney Int,2002,61(3):804 -808
[10]Leong DJ,Li YH,Gu XI,et al.Physiological loading of joints prevents cartilage degradation through CITED2[J].FASEB J,2011,25(1):182 -191
[11]马文明,董启榕,谢宗刚,等.MMP-1、MMP-13在大鼠骨关节炎软骨中的表达[J].中国现代医药杂志,2011,13(3):5-7
[12]熊鹏程,沈霖,熊昌源.三联疗法对兔膝骨性关节炎软骨MMP-1,MMP-13及 TIMP-1 mRNA的影响[J].中国中医骨伤科杂志,2009,17(3):9-12
[13]兰纯娜,张长杰,伍钢,等.不同的持续被动运动时间对软骨损伤后发生骨性关节炎的影响[J].中华物理医学与康复杂志,2005,27(8):468-472
[14]Moody HR,Heard BJ,Frank CB,et al.Investigating the potential value of individual parameters of histological grading systems in a sheep model of cartilage damage:the Modified Mankin method[J].JAnat,2012,221(1):47 - 54
[15]任晓晋,李璐,张煜,等.不同时期兔膝骨关节炎关节液中白细胞介素-1与一氧化氮的含量变化[J].中国药物与临床,2011,11(10):1154-1155
[16]孙炜,王吉兴,金大地,等.iNOS抑制剂对兔关节软骨修复组织胶原表达的影响[J].实用骨科杂志,2009,15(2):106-107
[17]Cake MA,Read RA,Appleyard RC,et al.The nitric oxide donor glyceryl trinitrate increases subchondral bone sclerosis and cartilage degeneration following ovine meniscectomy[J].Osteoarthritis Cartilage,2004,12(12):974 -981
[18]Lopez-Rivera E,Lizarbe TR,Martinez-Moreno M,et al.Matrix metalloproteinase 13 mediates nitric oxide activation of endothelial cell migration[J].Proc Natl Acad Sci U S A,2005,102(10):3685 -3690
[19]Tarin C,Gomez M,Calvo E,et al.Endothelial nitric oxide deficiency reduces MMP-13-mediated cleavage of ICAM-1 in vascular endothelium:a role in atherosclerosis[J].Arterioscler Thromb Vasc Biol,2009,29(1):27 -32
[20]Lizarbe TR,Garcia-Rama C,Tarin C,et al.Nitric oxide elicits functional MMP-13 protein-tyrosine nitration during wound repair[J].FASEB J,2008,22(9):3207 - 3215
[21]Zaragoza C,Lopez-Rivera E,Garcia-Rama C,et al.Cbfa-1 mediates nitric oxide regulation of MMP-13 in osteoblasts[J].JCell Sci,2006,119(Pt 9):1896 -1902
[22]Kumar DA,Raju KV,Settu K,et al.Effect of a derivatized tetrapeptide from lactoferrin on nitric oxide mediated matrix metalloproteinase-2 production by synovial fibroblasts in collagen - induced arthritis in rats[J].Peptides,2006,27(6):1434-1442
[23]梁鹏展,江建明,刘传芳,等.一氧化氮合酶抑制剂对白细胞介素1β诱导软骨细胞增殖和基质金属蛋白酶表达的影响[J].中国组织工程研究与临床康复,2008(15):2820-2824
[24]Salter RB.Continuous passive motion:from origination to research to clinical applications[J].J Rheumatol,2004,31(11):2104-2105
[25]Yokota H,Goldring MB,Sun HB.CITED2-mediated regulation of MMP-1 and MMP-13 in human chondrocytes under flow shear[J].J Biol Chem,2003,278(47):47275 - 47280
[26] Blaney DEN,Remst DF,Vitters EL,et al.Increase in ALK1/ALK5 ratio as a cause for elevated MMP-13 expression in osteoarthritis in humans and mice[J].J Immunol,2009,182(12):7937 -7945

