超声波协同流水净化对克氏原螯虾中菌落总数及菌相构成的影响
杨振泉,周海波,高 璐,饶胜其,尹永祺,方维明
(扬州大学食品科学与工程学院,江苏 扬州 225127)
超声波协同流水净化对克氏原螯虾中菌落总数及菌相构成的影响
杨振泉,周海波,高 璐,饶胜其,尹永祺,方维明
(扬州大学食品科学与工程学院,江苏 扬州 225127)
目的:研究超声波协同流水净化对活体克氏原螯虾携带的细菌数量及菌相构成的影响。方法:测定了净化过程中克氏原螯虾壳+肉、腮部和肠道部位菌落总数变化,并应用随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)指纹图谱结合16S rDNA测序鉴定分析龙虾在净化处理前后不同部位的菌相构成。结果:超声波协同流水处理能够显著减少虾壳+肉、腮和肠道部位的细菌载量,降低量分别达到2.18、2.23、1.01(lg(CFU/g))。挑取的218个单菌落中存在21种不同的RAPD谱型,不同谱型的细菌属于9个属18个种,其中气单胞菌属、黄杆菌属、嗜冷杆菌属、希瓦氏菌属和肠杆菌属细菌为虾壳肉和腮中的优势菌群,净化处理后虾中分布的细菌种群数降低为6个属9个种,其中温和气单胞菌(Aeromonas sobria)、阴沟肠杆菌(Enterobacter cloacae)、黄杆菌(Flavobacterium granuli)和腐败希瓦氏菌(Shewanella putrefaciens)是残留的优势细菌种群。结论:超声波协同流水净化对活体克氏原螯虾具有良好的减菌效果。
克氏原螯虾;净化;超声波;菌群
克氏原螯虾(Procambarus clarkii)俗称小龙虾,味道鲜美、风殊独特,是一种低脂肪、高蛋白的优质水产食品,深受广大消费者欢迎。克氏原螯虾原产于北美洲,是我国目前养殖范围最广的淡水螯虾种类。近年来,江浙沪地区大中城市的年小龙虾消费量都在万吨以上,仅江苏地区小龙虾产品(虾仁和整肢龙虾)出口量达5 500 t[1]。由于小龙虾生长环境复杂但适应性强,其体内外会携带大量的微生物[2],其中包括一些重要的人兽共患病原如致病性嗜水气单胞菌[3]、副溶血性弧菌[4]、致病性螺旋体[5]等,若控制不当,食用后会对人体健康产生危害并造成贸易障碍[6-7]。流水净化系统是国外常见的虾类净化体系[8-9],原料虾经过系统净化1~2 d可以清除小龙虾肠道消化食物,改善外观,增加市场价值,并能够降低去壳虾仁的细菌数量[9]。但我国目前小龙虾清洗净化体系尚未形成工业化规模,清洗操作简单,相关研究也很少,给小龙虾及其产品的安全性和品质带来隐患。随着我国小龙虾养殖和加工产业的不断发展以及为保证消费者的食用安全,开展相关研究非常必要。近年来研究表明,超声波在液体中的空化效应导致液体中产生瞬间高温、高压及其交变能够在极短的时间内杀灭和破坏多种微生物[10],利用超声波协同其他杀菌技术如热处理、紫外线、化学杀菌剂量在食品加工和水处理中显示广阔的应用前景[11-12]。但超声波协同流水净化系统是否能够实现活体小龙虾中微生物有效减除目前国内外尚没有相关研究报道。本实验对克氏原螯虾在超声波协同流水净化处理过程中壳肉、腮部和肠道部位的菌落总数变化进行了研究,并应用随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)指纹图谱结合16S rDNA测序鉴定对菌相构成及变化进行了分析,旨在为原料克氏原螯虾的减菌化处理和高效清洗和净化体系建立奠定基础。
1 材料与方法
1.1材料、培养基与试剂
克氏原螯虾(Procambarus clarkii)样品来源于扬州本地的生态农业有限公司,平均质量为(39.5±1.5)g/只。
营养肉汤琼脂培养基和LB培养基 广州环凯生物试剂有限公司;蛋白酶K、10×Buffer、dNTPs、Taq酶、DNA Marker、细菌16S rDNA扩增引物(8F:5’-AGAGTTTGATCCTGGCTCAG-3’和15R:5’-AAGGAG GTGATCCAGCCGCA-3’)、随机引物(AP31:5’-AGGGGTCTTG-3’) 生工生物工程(上海)股份有限公司;其他化学试剂均为国产分析纯。
1.2仪器与设备
BS210S型电子天平 北京赛多利斯天平有限公司;KQ5200超声波洗涤器 昆山市超声仪器有限公司;FSH-2型可调高速匀浆机 金坛市荣华仪器制造公司;UV-2401PC紫外分光光度计 日本岛津公司;TG16-WS型台式高速离心机 湘仪离心机仪器有限公司;SX-500型高压蒸汽灭菌锅 日本Tommy公司;DGX-9053B-2型生化培养箱 上海福玛实验有限公司;ABI2720热循环仪 美国Life Technologies公司;DYYSB型稳压稳流电泳仪 北京市六一仪器厂;凝胶成像系统 法国Vilber Lourmat公司。
1.3方法
1.3.1样品采集
从捕捞不超过2 h的克氏原螯虾中,挑选色泽均一、体格健硕、活力强的个体,加冰块保藏并运送到实验室后立即实验。
1.3.2净化处理
随机选取10只克氏原螯虾测定起始带菌量,其余虾随机分成3组,每组30只放入3只容量10 L的超声波洗涤器(40 kHz,160 W),将净水器过滤的自来水接入洗涤池,调节水流量为45 L/h,净化时间为12 h。处理组1不加超声波处理;处理组2在2 h超声处理1次,持续时间120 s;处理组3在2、6 h超声处理2次,持续时间均为120 s,净化过程中每隔4 h取样1次,每次10只用于菌落总数测定。
1.3.3菌落总数测定
将克氏原螯虾头尾分开,无菌条件下分别取腮部,肠道以及尾部的壳与肉部分,将取下的三部分样品分别称质量后参考文献[13]的方法与灭菌生理盐水按1∶10(m/V)的比例混合并匀浆,无菌吸取匀浆1 mL用灭菌生理盐水做10倍递增稀释。选择5个连续稀释度,每个稀释度取250 ☒L涂布营养肉汤琼脂培养基,每个稀释度涂布2个培养皿,倒置于37℃培养箱培养36 h,人工计数并计算菌落总数(CFU/g),实验重复3次,取平均值表示样品中的菌落总数。
1.3.4细菌分离
每个样品选择3个分离良好(菌落数在100~300 CFU/g之间,菌落无黏连)的菌落计数平板挑取单菌落,每个平板随机挑取总菌落数的10%~15%,挑取的单菌落在营养肉汤琼脂平板上划线纯化,挑取单菌落接种于LB液体培养基,37℃条件下培养24 h,培养物进行标号后加15%甘油于-70℃条件下冻存备用。
1.3.5细菌基因组DNA的提取
细菌基因组DNA的提取方法参照文献[14]所述的十六烷基三甲基溴化铵(hexadecyltrimethy ammonium bromide,CTAB)法提取。
1.3.6 RAPD指纹图谱扩增
菌株之间的基因型差异通过RAPD指纹图谱鉴别。以细菌基因组DNA为模板,应用AP31随机引物进行RAPD扩增。将DNA提取物用ddH2O稀释至50 ng/μL,随机引物浓度稀释至10 pmol/μL,优化的聚合酶链式反应(polymerase chain reaction,PCR)体系为:模板2.0 ☒L,dNTPs 0.5 ☒L,随机引物2.0 ☒L,10×Buffer 2.5 ☒L,MgCl22.5 ☒L,Taq酶0.3 ☒L,ddH2O 15.7 ☒L;RAPD反应循环参数为:94℃预变性3 min,94℃变性1 min;36℃退火55 s;72℃延伸2 min,35个循环;72℃补充延伸10 min。取10 ☒L产物在1.5%的琼脂糖凝胶上进行电泳(电压5 V/cm)1.5 h,EB染色20 min,凝胶成像系统拍照记录,根据条带清晰程度,弥散背景以及带型强弱情况选择稳定的指纹图谱进行分析。
1.3.7指纹图谱聚类分析
根据在指纹图谱中同一迁移率位点上的扩增条带的“有”和“无”进行数字化处理,用“1”表示“有”,“0”表示“无”,建立矩阵,应用DPS7.05数据处理系统中的0-1系统聚类分析程序,选择Nei氏遗传距离和类平均法进行聚类分析。
1.3.8 16S rDNA扩增及测序鉴定
以基因组DNA为模板进行16S rDNA的PCR扩增。PCR反应体系(50 ☒L)包括:模板(50 ng/☒L)2.0 ☒L、dNTPs(10 mmol/L)2.0 ☒L、25 pmol/☒L引物8F和15R各2.0 ☒L、10×Buffer 5.0 ☒L、MgCl2(25 mmol/L)2.0 ☒L、Taq酶(5 U/☒L)0.3 ☒L,最后加ddH2O补足至50 ☒L。热循环参数为:94℃预变性5 min;94℃变性1 min,50℃退火50 s,72℃延伸2.0 min,35次循环;72℃延伸10 min。取7.0 ☒L PCR产物用1.0%的琼脂糖凝胶电泳检测片段大小,其余PCR产物委托生工生物工程(上海)有限公司测序,所得序列在GenBank(http∶// www. ncbi.nlm.nih.gov)数据库中进行在线比对,序列同源性大于99%设为相同种。
2 结果与分析
2.1超声波协同流水处理对克氏原螯虾中菌落总数的影响
由图1A可知,虾壳+肉中的菌落总数为6.64(lg(CFU/g)),由图1B、1C可知,腮部和肠腺中的菌落总数显著高于虾壳+肉,达到7.18、7.22(lg(CFU/g)),总体带菌水平略低于李明彦[15]测定的结果(7.63~8.43(lg(CFU/g))),可能与虾来源与养殖环境有关。通过流水净化(处理组1)可以显著降低不同部位的细菌含量,处理12 h后的虾壳肉、腮部和肠腺中菌落总数比起始值分别降低了0.59、1.05、0.44(lg(CFU/g)),腮中的细菌在流水中比其他部位容易去除。超声波处理能够显著促进净化过程中的细菌减除,在2 h超声处理120 s(处理组2),虾壳+肉、腮部和肠腺中最终菌落总数比起始值分别降低了1.71、2.11、0.84(lg(CFU/g));处理组3在2 h和6 h各超声处理120 s,最终菌落总数分别降低了2.18、2.23、1.01(lg(CFU/g)),处理组2和3中克氏原螯虾的最终菌落总数水平均极显著低于未加超声波的处理组1(P<0.01),结果表明超声波协同流水处理对克氏原螯虾的虾壳+肉和腮部具有良好的减菌效果。虾死亡率是评价净化工艺的重要指标[8-9],本实验中在净化中使用两次超声处理(间隔4 h,持续120 s),净化结束后未出现克氏原螯虾死亡,活力与未处理组也无明显差别,表明在净化中加入适当超声波处理是可行的。
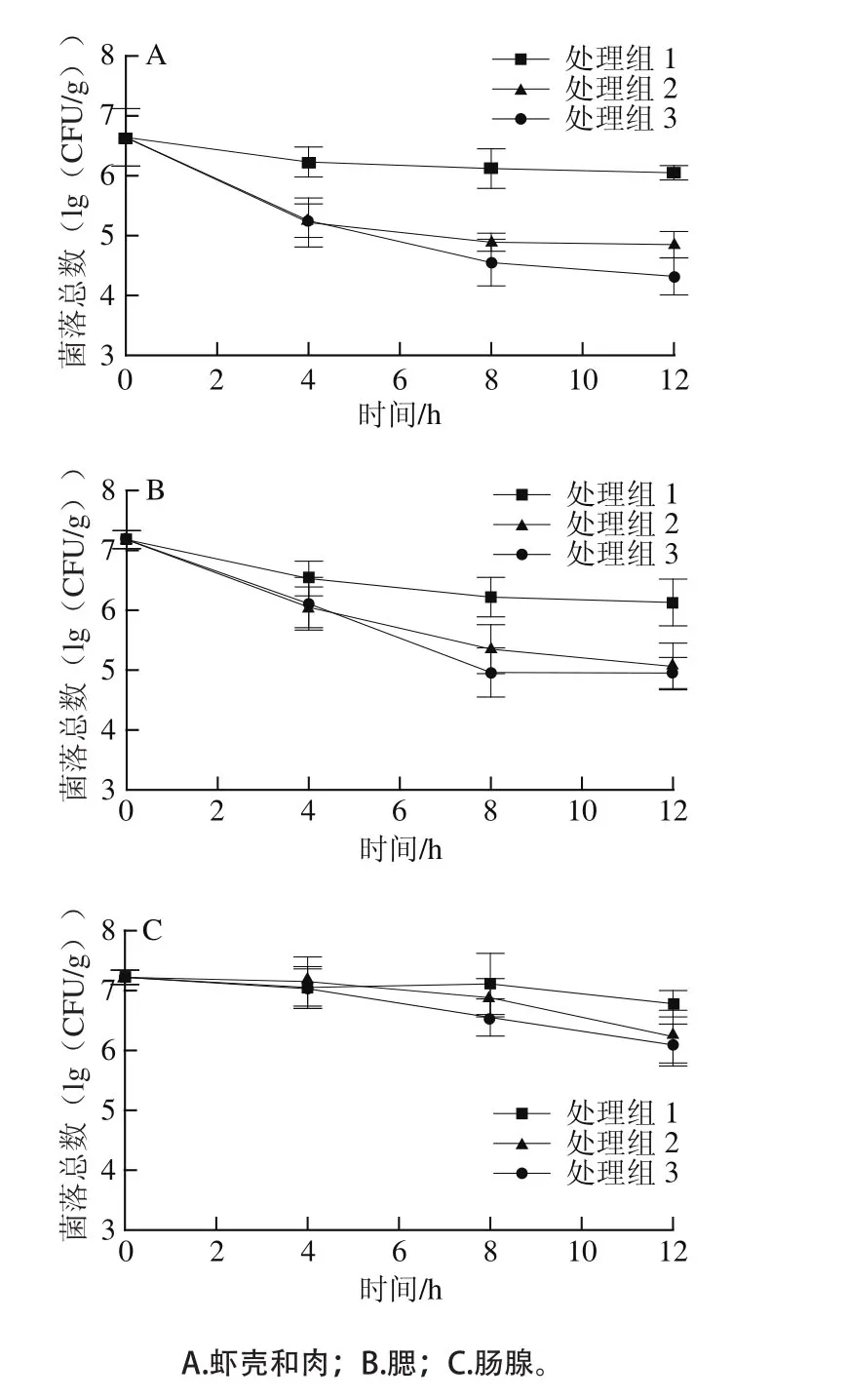
图1 活体克氏原螯虾在流水协同超声波净化过程中菌落总数变化Fig.1 Changes in total aerobic colony number in live crawfish during the purification process
2.2细菌分离
根据1.3.4节方法,共分离获得218个分离株,其中净化前分离菌落虾壳+肉部分52个(编号为KR1-1~KR1-52),腮部分61个(编号为TS1-1~TS1-61);净化后分离菌落虾壳+肉部分49个(编号为KR3-1~KR3-49),腮部分56个(编号为TS3-1~TS3-56),所有菌落通过划线纯化后保种。
2.3指纹图谱结果
将所有分离株提取基因组DNA,结果发现提取物OD260nm/OD280nm在1.86~2.28之间,定量结果显示DNA质量浓度在157~475 ☒g/mL,琼脂糖凝胶电泳结果表明DNA完整,没有断裂和降解现象。以100 ng DNA作为模板进行RAPD指纹图谱扩增,共获得21个不同的指纹图谱模式(A~U),表明所采用的随机引物AP31和建立的体系具有较好的分型效率。克氏原螯虾中主要好氧和兼性厌氧菌群显示较高的分子多样性,按不同指纹图谱的相似性进行聚类分析,结果如图2所示,在Nei’s遗传距离50%处可以明显分成5簇:Ⅰ(28%,包括A、B和N);Ⅱ(27%,包括H、O、R、Q、T、K和J);Ⅲ(27%,包括L、U、M和P);Ⅳ(1%,包括C);Ⅴ(17%,包括D、G、I、S、E和F)。其中指纹图谱为N、P和J的菌株占47.7%,是克氏原螯虾中的优势菌群。RAPD技术快速、廉价、简便,在微生物分子生态学研究中有着广泛的应用[16],但分型效率与随机引物序列密切相关,随机引物AP31在前期研究中显示了良好的种内分型能力[17],本研究结果表明常规培养结合AP31建立的RAPD体系可以实现克氏原螯虾中菌群构成的快速分析。

图2 细菌RAPD指纹图谱扩增及聚类分析结果Fig.2 Cluster analysis of RAPD patterns of bacterial isolates
2.4 16S rDNA测序鉴定结果
研究表明RAPD指纹图谱可以应用于鉴别种内差异[18],因此本研究将具有相同指纹图谱模式的菌株认为具有相同种属,选取代表菌株进行16S rDNA测序鉴定,结果应用引物8F和15R及建立的PCR方法能够顺利扩增出产物,片段大小为1 500 bp左右,将扩增产物委托生工生物工程(上海)股份有限公司测序,测序结果进行在线比对,结果如表1所示。结果表明21个谱型的细菌属于9个属18个种,其中不动杆菌属(Acinetobactersp.)包括A型和B型菌株;气单胞菌属(Aeromonassp.)包括R、H、T、Q和O型菌株;芽孢杆菌属(Bacillussp.)包括C型菌株;肠杆菌属(Enterobactersp.)包括J型菌株;黄杆菌属(Flavobacteriumsp.)包括N型菌株;假单胞菌属(Pseudomonassp.)包括E和F型菌株;嗜冷杆菌属(Psychrobactersp.)包括D、G、I和S型菌株;希瓦氏菌属(Shewanellasp.)包括M、L、U和P型菌株;K型菌株属于丛毛单胞菌属(Comamonas jiangduensis)。Scott等[2]研究表明41%的淡水龙虾血淋巴中携带不动杆菌属、气单胞菌属、节细菌属、芽孢杆菌属、棒状杆菌属、黄杆菌属、假单胞菌属和弧菌属的细菌,本研究中共分离9个属细菌,其中的5个属与Scott等研究一致,表明这些细菌是克氏原螯虾普遍携带的菌群,另外分离到的4个属(肠杆菌属、嗜冷杆菌属、希瓦氏菌属、丛毛单胞菌属)可能与本地克氏原螯虾的养殖水体环境有关。

表1 不同基因型细菌分离株的16S rDNA测序鉴定结果Table1 16S rDNA sequencing identification results for different genotypes of bacterial isolates
2.5细菌种群变化
结合菌株指纹图谱的分布和测序鉴定结果,对超声波协同流水处理前后克氏原螯虾携带菌群的构成进行分析,结果如表2所示。结果显示超过50%的种群在净化以后不能被检测到,表明超声波协同流水处理极大地减少了虾壳肉和腮中携带的细菌种群数量,在虾壳+肉部分,起始菌群中包括13个RAPD谱型,净化以后能检测到的只有6个RAPD型,分别属于Pseudomonas putida、Psychrobacter glacincola、Shewanella baltica、Flavobacterium granuli、Shewanella putrefaciens、Aeromonas sobria6个种。在克氏原螯虾的腮部起始菌群极具多样性,能够检出18个RAPD型,净化以后只能检测到9个RAPD型,分别属于Aeromonas piscicola、Aeromonas sobria、Aeromonas hydrophila、Pseudomonas putida、Psychrobacter glacincola、Enterobacter cloacae、Flavobacterium granuli、Shewanella putrefaciens8 个种,其中Aeromonas sobria、Enterobacter cloacae、Flavobacterium granuli和Shewanella putrefaciens是净化以后克氏原螯虾中残留的优势种群,这4种细菌广泛分布于土壤和水体环境中,是鱼类等水生动物疾病的重要病原菌[19-20],但对龙虾的致病性尚未见报道,其中Aeromonas sobria和Enterobacter cloacae能够产生毒素并对人类具有致病性[21-24],Flavobacterium granuli和Shewanella putrefaciens水产食品的重要腐败菌[20,25],尤其Shewanella putrefaciens冷藏水产类的主要腐败菌,其腐败活性强,在低温和低氧条件下能够代谢产生腐败效应[26],在克氏原螯虾及其产品加工中应该针对这4种细菌采取抑菌措施,确保产品安全和卫生。

表2 超声波协同流水净化对克氏原螯虾菌群构成的影响Table2 Effect of ultrasonic and running water treatments on bacterial community composition of crawfish
3 结 论
克氏原螯虾携带高水平的好氧和兼性好氧细菌,壳+肉部分携带量为6.64(lg(CFU/g)),腮部和肠腺中达到7.18、7.22(lg(CFU/g)),流水净化可以降低克氏原螯虾中的细菌载量,处理12 h后,腮部细菌总数降低最多,达到1.05(lg(CFU/g))。超声波处理能够显著促进流水净化过程中的细菌减少,两次超声处理使虾壳肉、腮部和肠道中细菌载量最终降低2.18、2.23、1.01(lg(CFU/g)),表明超声波协同流水处理对活克氏原螯虾的虾壳+肉和腮部具有良好的减菌效果。
克氏原螯虾携带菌群构成具有高度种属和分子多样性,主要包括不动杆菌属、气单胞菌属、芽孢杆菌属、肠杆菌属、黄杆菌属、假单胞菌属、嗜冷杆菌属、希瓦氏菌属以及Comamonas属,其中气单胞菌属、黄杆菌属、嗜冷杆菌属、希瓦氏菌属和肠杆菌属细菌为优势菌群。超声处理协同流水净化能有效降低虾壳肉和腮部携带的好氧和兼性好氧细菌种群数量,50%以上的种群在净化以后不能被检测到,但温和气单胞菌(Aeromonas sobria)、阴沟肠杆菌(Enterobacter cloacae)、黄杆菌(Flavobacterium granuli)和腐败希瓦氏菌(Shewanella putrefaciens)仍然是净化以后克氏原螯虾中残留的优势种群,在后期加工中可以针对这4个属种细菌采取抑菌措施。
[1] 沈毅. 江苏省小龙虾产业发展报告[J]. 中国水产, 2010(6)∶ 14-16.
[2] SCOTT J R, THUNE R L. Bacterial flora of hemolymph from red swamp crawfish, Procambarus clarkii (Girard), from commercial ponds[J]. Aquaculture, 1986, 58(3/4)∶ 161-165.
[3] 马小荣, 薛晖, 唐建清. 克氏原螯虾致病性嗜水气单胞菌的分离鉴定及药敏试验[J]. 水产养殖, 2012, 33(8)∶ 45-47.
[4] 陈昌福, 刘远高, 何广文, 等. 克氏原螯虾暴发病细菌性病原的研究[J].华中农业大学学报, 2009, 28(2)∶ 193-197.
[5] WANG Junhai, HUANG Hua, FENG Qi, et al. Enzyme-liked immunosorbent assay for the detection of pathogenic spiroplasma in commercially exploited crustaceans from China[J]. Aquaculture, 2009, 292(3/4)∶ 166-171.
[6] 陈秀开. 出口淡水小龙虾产品风险分析研究[D]. 青岛∶ 中国海洋大学, 2004∶ 6-14.
[7] 倪治明. 浙北地区餐饮业小龙虾重点危害因子调查及风险评估[D].杭州∶ 浙江大学, 2013∶ 30-36.
[8] LAWSON T B, DRAPCHO C M. A comparison of three crawfish purging treatments[J]. Aquacultural Engineering, 1989, 8(5)∶ 339-347.
[9] MCCLAIN W R. Assessment of depuration system and duration on gut evacuation rate and mortality of red swamp crawfish[J]. Aquaculture, 2000, 186(3/4)∶ 267-278.
[10] COLLIS J, MANASSEH R, LIOVIC P, et al. Cavitation microstreaming and stress fields created by microbubbles[J]. Ultrasonics, 2010, 50(2)∶ 273-279.
[11] BROEKMAN S, POHLMANN O, BEARDWOOD E S, et al. Ultrasonic treatment for microbiological control of water systems[J]. Ultrasonics Sonochemistry, 2010, 17(6)∶ 1041-1048.
[12] 栗星, 包海蓉. 超声波在食品杀菌中的研究现状[J]. 农产品加工业, 2008(6)∶ 25-28.
[13] 食品安全国家标准. GB 4789.2—2010食品微生物学检验菌落总数测定[S]. 北京∶ 中国标准出版社, 2010.
[14] 奥斯伯. 精编分子生物学指南[M]. 5版. 北京∶ 科学出版社, 2008∶39-40.
[15] 李明彦. HACCP 体系在冻煮龙虾仁生产中的应用研究[D]. 杨凌∶西北农林科技大学, 2008∶ 34-36.
[16] KWON G H, LEE H A, PARK J Y, et al. Development of a RAPDPCR method for identification of Bacillus species isolated from Cheonggukjang[J]. International Journal of Food Microbiology, 2009, 129(3)∶ 282-287.
[17] YANG Z Q, JIAO X A, ZHOU X H, et al. Isolation and molecular characterization of Vibrio parahaemolyticus from fresh, lowtemperature preserved, dried, and salted seafood products in two coastal areas of eastern China[J]. International Journal of Food Microbiology, 2008, 125(3)∶ 279-285.
[18] NANVAZADEH F, KHOSRAVI A D, ZOLFAGHARI M R, et al. Genotyping of Pseudomonas aeruginosa strains isolated from burn patients by RAPD-PCR[J]. Burns, 2013, 39(7)∶ 1409-1413.
[19] 姚东瑞, 邴旭文, 朱明, 等. 泥鳅(Misgurnus anguillicaudatus)病原温和气单胞菌(Aeromonas sobria)分子鉴定及耐药性研究[J]. 海洋与湖沼, 2010, 41(5)∶ 756-762.
[20] ZAMORA L, VELAA I, SANCHEZ-PORRO C, et al. Characterization of flavobacteria possibly associated with fish and fish farm environment. Description of three novel Flavobacterium species∶Flavobacterium collinsii sp. nov., Flavobacterium branchiarum sp. nov., and Flavobacterium branchiicola sp. nov.[J]. Aquaculture, 2013, 416/417∶ 346-353.
[21] 李刚山, 王惠萱 王意银, 等. 云南战区部队驻地腹泻患者中首次检出温和气单胞菌[J]. 中国热带医学, 2012, 12(11)∶ 1317-1319.
[22] SANDER W E, SANDERS C C. Enterobacter spp.∶ pathogens poised to flourish at the turn of the century[J]. Clinical Microbiology Reviews, 1997, 10(2)∶ 220-241.
[23] 何海明, 刘金波. 阴沟肠杆菌感染的临床特点及耐药性分析[J]. 武警医学院学报, 2010, 19(7)∶ 530-532.
[24] KROVACEK K, FARIS A, MANSSON I. Growth of and toxin production by Aeromonas hydrophila and Aeromonas sobria at low temperatures[J]. International Journal of Food Microbiology, 1991, 13(2)∶ 165-175.
[25] J☒RGENSEN B R, HUSS H H. Growth and activity of Shewanella putrefaciens isolated from spoiling fish[J]. International of Journal Food Microbiology, 1989, 9(1)∶ 51-62.
[26] L☒PEZ-CABALLERO M E, S☒NCHEZ-FERN☒NDEZ J A, MORAL A. Growth and metabolic activity of Shewanella putrefaciens maintained under different CO2and O2concentrations[J]. International Journal of Food Microbiology, 2001, 64(3)∶ 277-287.
Effect of Synergistic Purification with Ultrasonic and Running Water on Bacterial Load and Microflora in Crawfish (Procambarus clarkii)
YANG Zhenquan, ZHOU Haibo, GAO Lu, RAO Shengqi, YIN Yongqi, FANG Weiming
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Objective∶ To examine the effect of synergistic purification with ultrasonic and running water on bacterial quantity and community composition in live crawfish (Procambarus clarkii). Methods∶ The bacterial colony numbers in the unshelled meat, grills and intestinal parts of crawfish were determined during the purification process and changes in bacterial community composition were analyzed using random amplified polymorphic DNA (RAPD) fingerprint technique combined with 16S rDNA sequencing identification.Results∶ The purification procedure by ultrasonic combined with running water significantly reduced the bacterial loads in the unshelled meat, grills and intestine of crawfish to 2.18, 2.23 and 1.01 (lg (CFU/g)), respectively. A total of 218 single colonies were collected from bacterial counting plates, fingerprint patterns of 21 colonies of which were obtained through RAPD analysis. The 16S rDNA sequencing identification showed that the isolates with different fingerprint patterns belonged to 9 bacterial genera including 18 species, among whichAeromonassp.,Flavobacteriumsp.,Pseudomonassp.,Shewanellasp. andEnterobactersp. were the predominant bacterial groups for crawfish shell, meat and gills. After being purified with ultrasonic and running water, the remaining bacterial groups were reduced to 9 species from 6 genera, among which,Aeromonas sobria,Enterobacter cloacae,Flavobacterium granuliandShewanella putrefacienswere the major residual bacteria species. Conclusion∶ The synergistic purification with ultrasonic and running water is highly effective in reducing bacterial level and species in live crawfish.
Procambarus clarkii; purification; ultrasonic; microflora
S986.1
1002-6630(2015)17-0173-06
10.7506/spkx1002-6630-201517033
2014-11-24
苏北科技发展计划项目(BC2013438);江苏省科技支撑计划项目(BE2013733);江苏省青蓝工程资助项目
杨振泉(1975—),男,副教授,博士,主要从事食品微生物资源开发与利用研究。E-mail:yangzq@yzu.edu.cn

