黄藤材主要变色菌的分离和鉴定
郑雅娴,吕文华
(中国林业科学研究院 木材工业研究所,北京100091)
棕榈藤是仅次于木材和竹材的重要非木材林产品,能够在维持天然生态环境的条件下,提供与伴生树木相同甚至更多的使用效益,对替代木材和保护森林资源发挥着重要作用[1]。黄藤(Daemonorops margaritae)是我国特有的经济价值较高的多用途棕榈藤。以棕榈藤为原料制作的藤家具,享有工艺美术家具的美誉,是传统的出口创汇商品之一。变色一般不影响藤材强度,但严重影响产品外观品质。变色菌通常侵染藤材表面,如不及时加以预防或控制,可从藤材表面渗透到内部,导致深层变色[2]。由于菌丝的穿透作用,变色材渗透性和吸湿性增加,更易吸潮引起腐朽菌入侵。
国内外研究表明,木材变色真菌有150多种,大多数属于子囊菌和半知菌的Ceratocystis Sensu Lato,Ophiostoma Piceae 和 Verticicla Diella 属[3]。有些腐朽菌也会引起木材变色,如红木色孔菌Tinctoporellus epimiltinus (Berk.&Broome)Ryvarden[4-6]。我国竹材变色真菌多属于半知菌亚门丝孢纲暗色孢科各属,丝孢科(Hyphomycelaceae)的青霉属(PenicilllumLink.)、曲霉属(Aspergillus(Mich.)Link)和木霉属(Trichoderma Pers.)等霉菌主要引起竹材绿、兰、黄、红、灰等变色[7-8];暗色孢科 (Dematlaceae)的 枝 孢 霉 属 (Cladosporium Link)、节棱孢属(Arthrinum Kunze)、链格孢属(Altemarla Nees)、轮枝孢属(VerticilliumNees)等属主要引起竹材褐变和黑变[9]。引起藤材变色的真菌与引起木材变色的真菌相似,使活立藤变色的主要真菌有:Colletotrichum gloeosporoides,Fusariumspp.和Rhizoctonia solani等,侵染藤制品的变色真菌有:边材变色菌Bostryodiplodia theobromae、Ceratostomella sp.、Aspergillus sp.、Cystospora calami Syd.、Cratocystis 属、Diplodia 属 和子囊菌科Melonomastia属真菌和霉菌(Penicillium spp.、Trichoderma sp.、Fusariumspp.)等。白藤和单叶省藤上可分离出日本曲霉原变种(Aspergillus japonicas Saito var.Japonicus)、草酸青霉(Penicillium oxalicumCurrie Thorn)和可可毛壳色单隔孢 (Lasiodiplodia theobromae (Pat.)Griff.&Maub1.)和1种毛霉(Mucro spp.)[10]。地区不同侵染菌种不同,如南方常见的竹材尖孢枝孢和绿木霉在北方少见。
黄藤分布于中国南部如海南岛、广东东南部、广西西南部、香港和云南西双版纳等地区,产地气候温暖湿润,黄藤藤条原色多为乳白色或米黄色,但伐后颜色加深很快,呈黄色、红黄色或棕黄色,尤其是在春夏高温多雨季节,藤材在运输、存放、加工及使用过程中,容易发生蓝变、褐变、红变或黑斑等现象,大大降低藤材使用价值[11-12]。藤材变色防治,既提高藤材经济效益,也在一定程度上保护或节约棕榈藤资源。对黄藤材变色菌进行分离、培养和鉴定,通过藤材接种等试验,了解其变色的性质和过程,可为藤材真菌变色的防治提供重要的理论基础和实际指导。
本研究选取典型的变色黄藤材进行变色真菌的分离和纯化,通过对健全黄藤材的模拟接种试验,选择对黄藤材颜色影响较大的几种变色菌,首先根据真菌的菌丝形态、孢子产生的方式、形态和大小,结合培养特性等进行形态学上的鉴定;再辅以DNA测序等分子生物学手段予以确认。研究中真菌的形态学鉴定及其学名的采用,参照Ellis、Hawksworth、戴芳澜[13-14]等人的著作。由于分生孢子有时难以发现或真菌难以产孢,菌落特征又可能因基因的异质性有较大的变化,因此形态学鉴定真菌有一定的局限性[15]。利用真菌在rDNA的ITS区段具有保守性和在科、属、种水平上均有特异性序列的特性,对ITS区进行PCR扩增、测序及序列分析,进行分子鉴定,力求明确其准确的分类地位,为藤材的变色防治提供更科学的依据[16]。
1 材料与方法
1.1 材料
黄藤(Daemonorops margaritae),采自广东省肇庆市金鸡坑林场,攀生于杉树,约15年生。藤条直径10~20mm,长15~25m,节间长度15~25 cm。选取典型的黄藤变色材进行变色真菌的分离。用于接种变色菌的藤材,为藤全长1/3至2/3中部处的非节部健全藤茎加工成的藤片,试件尺寸为50 mm(顺纹长度)×D(宽度,藤径)×2mm(厚度)。
1.2 变色菌的分离和纯化
选取典型黄藤变色材,用75%酒精消毒,再无菌水漂洗3次,轻轻刮去表层,切取小块变色材,放在PDA平板培养基上,在温度26~28℃,相对湿度75%的培养箱中培养;采用尖端菌丝挑取法,挑取形态不同的菌落,转到PDA培养基上进行纯化;纯化后的菌种转接到斜面培养基上,于4℃下保存备用。PDA培养基:马铃薯200g/L,葡萄糖20g/L,琼脂20g/L,自然pH值。平板培养基为直径90mm的培养皿,斜面培养基为10mm×100mm试管。
1.3 变色菌的模拟接种
将分离、纯化后的变色菌,采用菌悬液涂布法,回接到经过湿热灭菌(121℃,30min)的健全藤材上进行培养,培养条件同分离与培养试验,观察藤材变色情况与分离该菌的藤材变色是否一致,并重新从变色部位分离纯化得到该菌,确定为藤材变色菌。
1.4 藤材颜色测定
将正常材和变色材在103℃下烘干,清除藤材表面的粉尘、菌丝和孢子,称重,测色。采用国际照明委员会CIE L*a*b*(1976)系统表色和计算色差[11]。采用日本MINLTA生产的CR-300台式测色仪,D65标准光源,0/d(垂直照明/漫反射),测得色度学参数L*(亮度)、a*(蓝绿指数)和b*(黄红指数),每种菌株3个重复,每片试材测3个点,取均值。
1.5 变色菌的形态学鉴定
将变色菌接种到PDA平板上,每种3个重复,观察、记录菌落生长速度、菌落形态、颜色及培养基变色情况,定期挑取菌丝,制成水载显微切片,通过光学显微镜(Leica DM6000B-CTR6000),观察菌丝形态、产孢与否、孢子形态和大小、分生孢子形状等微观特征,将未观察到分类特征的菌株接种到琼脂培养基上或通过液体摇培方式产孢,并结合培养特性进行最终鉴定[17]。
1.6 变色菌的分子生物学鉴定
将菌丝置于研钵中液氮冷冻后研磨,采用O-mega公司试剂盒(EZNA Fungal DNA Kit)提取藤材变色菌总DNA。采用真菌通用引物ITS1(TCCGTAGGTGAAC CTGCGG)和 ITS4(TCCTCCGCTT ATTGA TATGC)[17],由上海生工生物工程技术服务有限公司合成。利用北京冠普佳科技有限公司PCR扩增试剂盒(PCR Amplification Kit),在基因扩增仪上(ABI公司Veriti)进行扩增。扩增程序为:94℃预变性5min后,随即进入94℃变性40s、54℃退火40s、72℃延伸1min的循环,共进行35次循环,最后72℃延伸10min,终止温度4℃。对PCR产物进行凝胶电泳,经1%琼脂糖凝胶电泳检测,对符合条件的PCR产物送北京百泰克生物技术有限公司,纯化后进行双向测序,把测序所得序列在美国 http://www.ncbi.nlm.nib.gov的 Gen-Bank数据库中进行BLAST检索分析。
2 结果与分析
2.1 藤材接种变色菌后的颜色变化
研究从黄藤蓝变、褐变、红变等变色材中共计分离得到15种变色真菌,分别编号为F1~F15。从红变材中共分离得到4种变色菌;从蓝变材中共分离得到13种变色菌;褐变材与蓝变材的分离情况大致相同。颜色均匀、单一的藤材变色,常为某一种变色菌所引起;藤材变色较为斑杂的,常可分离出多种变色菌。将15种变色菌分别接种到正常藤材上,接种2周后的藤材颜色变化如表1所示。表中,ΔL*、Δa*、Δb*分别代表亮度指数L*、蓝绿指数a*和黄红指数b*的差值;总色差ΔE*代表总体颜色差异,ΔE*>3为可识别的颜色变化,ΔE*>6为显而易见的颜色差异[11]。接种变色菌2周后,藤材发生了明显的颜色变化,全部ΔE*值都>3;其中,有6种菌株使藤材ΔE*值>6,最大ΔE*值达19.75,颜色变化极显著。试验表明,变色菌对藤材的侵染较快,接种仅1周时藤材就发生了明显的蓝变、褐变及红变等颜色变化。
图1是分离频次较高且对藤材颜色影响显著的6种真菌分离前及接种后的藤材颜色。颜色比对表明,藤材接种变色菌后发生的变色,与变色菌分离藤材的颜色基本一致。结合变色菌的分离和培养性状认为,黄藤的蓝变、褐变等真菌变色主要由真菌菌丝体颜色和其分泌色素被藤材组分吸收所致。
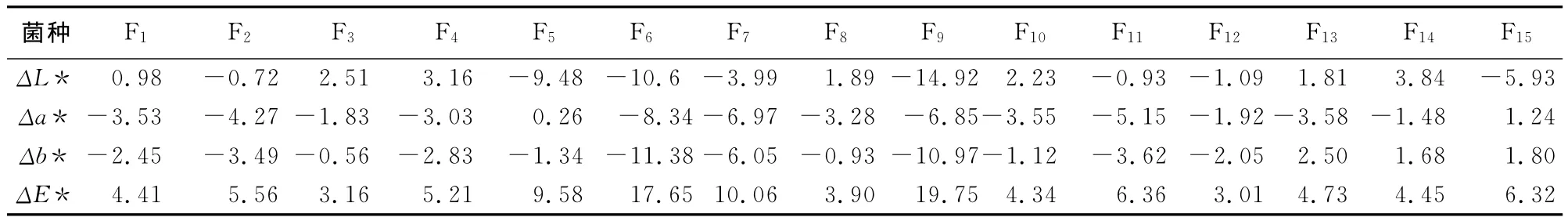
表1 黄藤材经变色菌接种侵染2周后的颜色变化Table 1 Color changes of fungus-stained D.margaritae canes after 2weeks inoculation
2.2 藤材变色菌的形态学鉴定
通过对黄藤健全藤材进行接种,选取对藤材颜色影响较大的6种主要变色菌F2、F6、F7、F9、F11和F15进行形态学鉴定。黄藤材主要变色菌的形态学特征如图2所示。
F2菌株:菌落圆形,粉末状;菌株绿色,培养基茶褐色;营养菌丝有隔膜;分生孢子梗直立,多次分枝,小枝对生,顶端不膨大,排列成帚状间枝,分生孢子串成不分枝的链状,单个孢子球形、卵圆形,光滑,绿色,初步鉴定为青霉属Penicillium真菌。
F6菌株:菌落初为白色,渐变为灰白至灰黑色,最后变成黑色,菌落绒毛状至棉絮状,逐渐加厚成绒毡状;菌落生长快,培养基蓝黑色;菌丝种类单一,黑色、黑灰色或灰褐色,粗壮、长、多分枝、分隔明显。偶见菌丝端头鼓泡状;在基内菌丝中有大量粗壮的念珠状菌丝;PDA培养2月未见产孢,初步鉴定为半知菌类真菌。
F7菌株:菌落圆形,生长较慢,绒状,绿色,偶见黄褐色;菌株分泌物在菌落中心呈油滴状聚集;培养基呈黄绿色或紫红色,排列成同心轮纹;菌丝有隔膜,无色或淡色;分生孢子梗从壁厚而膨大的菌丝细胞生出,无隔膜,光滑,粗大,顶端膨大成半球形泡囊;从泡囊全部表面以放射状生出小梗,顶端着生成串的球形分生孢子,初步鉴定为半知菌类曲霉属Aspergillus真菌。
F9菌株:与F6菌株的形态特征和培养特性相似,但该菌株颜色较浅,为灰褐色,其PDA颜色也较浅,呈放射状渐变;其基生菌丝产生的念珠更多更密集,初步鉴定为半知菌类真菌。F6和F9菌株的分离频次高,各自培养性状都较稳定,都使黄藤材变色严重。
F11菌株:菌落圆形,粉末状,分散生长,生长快,青绿色;培养基桔黄色或黄红色;菌丝细长、分枝少,分隔,蓝绿色;基内菌丝密集,气生菌丝稀少;2种菌丝均产孢;气生菌丝几乎都是分生孢子梗及分生孢子,梗侧生,直立,一轮分枝,小枝对生,顶端不膨大,排列成帚状间枝,分生孢子串成不分枝链状,单个孢子球形、卵圆形,绿色,初步鉴定为青霉属Penicillium真菌。

图1 真菌分离前及接种后的藤材颜色Fig.1 Color comparison of fungi-isolated and fungi-inoculated canes
F15菌株:菌落圆形,绒毛状,渐变成厚绒状,生长快;菌丝白色,接种点周围的菌丝渐变成红色或紫红色;培养基变红色或紫红色;菌丝长,分枝较多,有分隔;在较粗菌丝上分生多个短梗,其上着生大量分生孢子;孢子镰刀形,具有3~5个隔膜;初步鉴定为镰孢属Fusarium真菌。
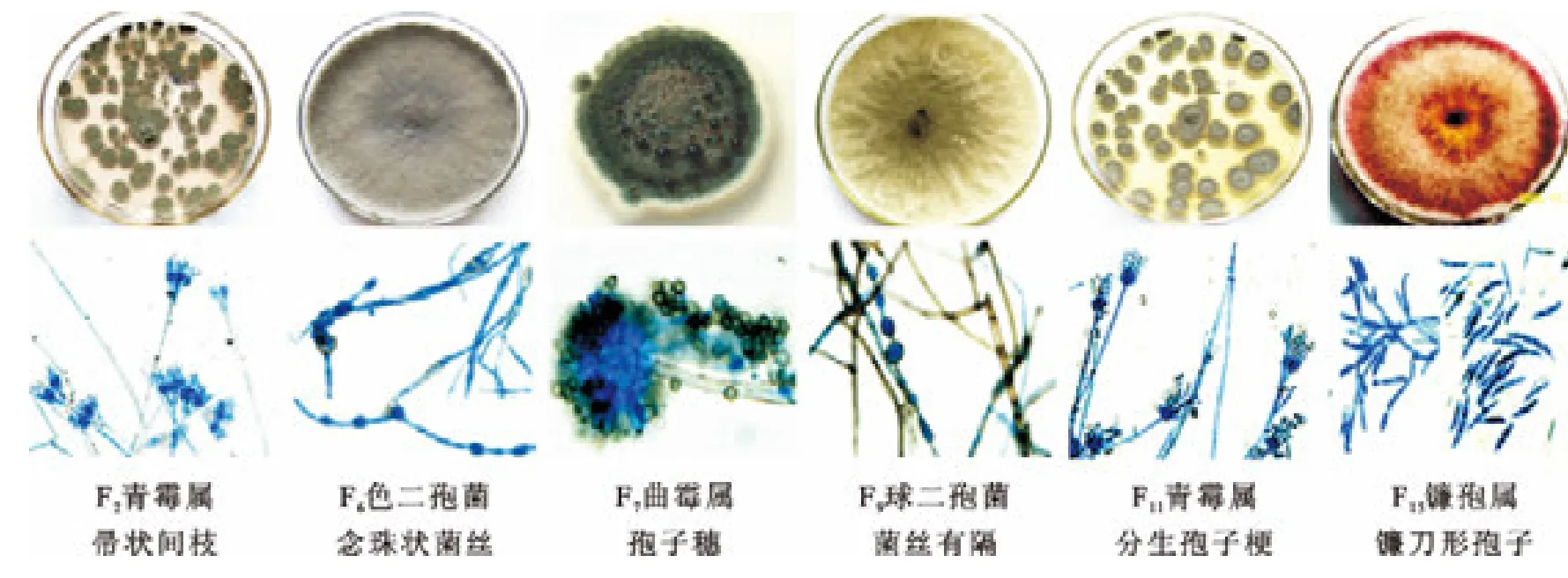
图2 黄藤材变色菌的形态学特征Fig.2 Morphological characters of D.margaritae canes'stain fungi
2.3 藤材变色菌的分子生物学鉴定
将图3中的ITS特征条带切取回收并进行克隆,克隆转化测序后得到序列,递交NCBI数据库进行核酸BLAST序列比对,结果见表2。从表2可看出,F2菌株与青霉菌Penicillium sumatrense同源性达99%;F6菌株与色二孢菌Botryodiplodia rhodina(=Lasiodiplodia theobromae)同源性达99%;F7菌株与萨氏曲霉Aspergillus sydowii同源性达99%;F9菌株与球二孢菌Botryodiplodia rhodina同源性达99%;F11菌株与青霉菌Penicillium sclerotiorum 同源性达97%;F15菌株与镰刀菌Fusarium kyushuense同源性达97%。这与传统形态鉴定方法所得鉴定结果相一致。
3 结论与讨论
本研究分离出的黄藤材变色菌-青霉、曲霉、球色二孢菌与已报道藤材变色菌相似,另外还分离出了引起藤材红变的镰刀菌。真菌的形态鉴定和分子鉴定相辅相成。在实际工作中,形态鉴定是最方便、最常用的方法,某些特定菌种的分类须通过形态学表述,而分子生物学方法可使真菌分类更合理,更接近自然分类系统。基于形态学和分子生物学研究结果认为,对黄藤材色影响较大的几种变色菌,分别是萨氏曲霉A.sydowii、青霉菌P.sumatrense和P.sclerotiorum、色二孢菌L.theobromae、球二孢菌B.rhodina和镰孢菌F.kyushuense。

图3 黄藤材变色菌ITS序列的扩增电泳图Fig.3 PCR electrophoresis of ITS sequences of the stain fungi
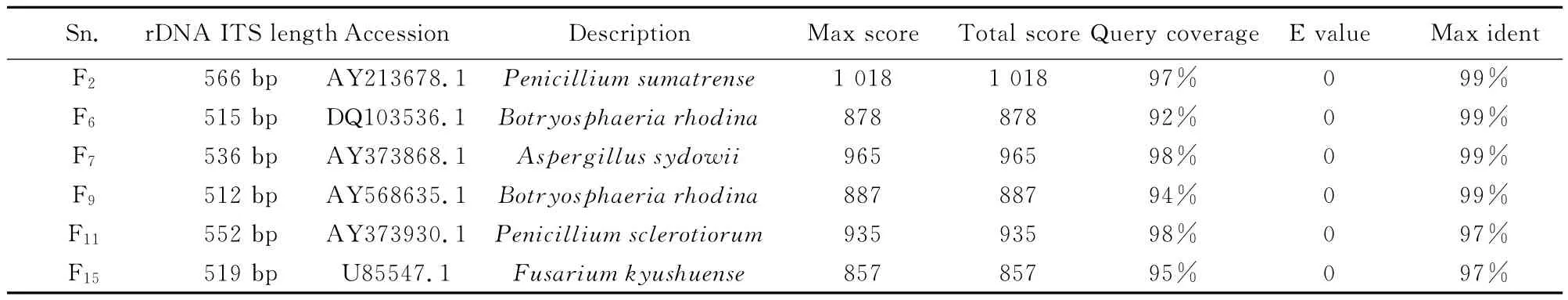
表2 黄藤材变色菌的DNA序列BLAST比对结果Table 2 BLAST comparison results of DNA sequence of D.margaritae cane stained fungus
藤材变色菌的分离和鉴定,可为藤材真菌变色的防治提供重要的理论基础和实际指导。本研究分离得到的黄藤材变色菌,从接种到藤材上的培养特性来看,变色菌的菌丝颜色或其所分泌的色素颜色,与分离变色菌的藤材变色大致相同,这表明变色菌在藤材上的生长性状可能通过其在培养基上的生长性状进行表达。变色菌的菌丝颜色和其分泌的色素颜色是引起藤材变色的主要原因。通过对藤材进行及时的药剂处理,抑制相应真菌生长,可有效防止黄藤材真菌变色。
[1] JIANG Z H.Bamboo and rattan in the world [M].Beijing:China Forestry Publishing House,2007.
[2] 吕文华,江泽慧,任海青,等.藤材的防护和综合利用 [J].世界竹藤通讯,2007,5(2):9-11.LV W H,JIANG Z H,REN H Q,et al.Rattan cane protection and its comprehensive utilization[J].World Bamboo And Rattan,2007,19(4):38-44.(in Chinese)
[3] 吕文华,江泽慧,吴玉章,等.木、竹、藤材的变色防治 [J].世界林业研究,2006,19(4):38-44.LV W H,JIANG Z H,WU Y Z,et al.Research on wood,bamboo and rattan cane discoloration[J].World Forestry Research,2006,19(4):38-44.(in Chinese)
[4] 姚拓,杨俊秀,景耀.秦岭落叶松林真菌病害区系 [J].西北林学院学报,1997,12(2):57-63.
[5] 戴玉成.中国多孔菌名录 [J].菌物学报,2009,28(3):325-327.DAI Y C.A checklist of pollypores in China [J].Mycosystema,2009,28(3):325-327.(in Chinese)
[6] 戴玉成.中国木本植物病原木材腐朽菌研究 [J].菌物学报,2012,31(4):493-509.DAI Y C.Pathogenic wood-decaying fungi on woody plants in China[J].Mycosystema,2012,31(4):493-509.(in Chinese)
[7] 徐梅卿,戴玉成,范少辉,等.中国竹类病害记述及其病原物分类地位(上)[J].林业科学研究,2006,19(6):692-699.XU M Q,DAI Y C,FAN S H,et al.Records of bamboo diseases and the taxonomy of their pathogens in China(Ⅰ)[J].Forest Research,2006,20(1):45-52.(in Chinese)
[8] 徐梅卿,戴玉成,范少辉,等.中国竹类病害记述及其病原物分类地位(下)[J].林业科学研究,2007,20(1):45-52.XU M Q,DAI Y C,FAN S H,et al.Records of bamboo dis-eases and the taxonomy of their pathogens in China(Ⅱ)[J].Forest Research,2007,19(6):692-699.(in Chinese)
[9] 马星霞,蒋明亮,覃道春,等.我国竹材变色菌和霉菌的分离与鉴定 [J].竹子研究汇刊,2009,28(4):35-39.MA X X,JIANG M L,QIN D C,et al.Isolation and identification of stain and mould fungi of bamboo wood in China[J].Journal of Bamboo Research,2009,28(4):35-39.(in Chinese)
[10] 邢嘉琪.我国藤材主导霉菌的分离及其室内抑制试验 [J].木材工业,2005,19(5):23-24,27.XING J Q.Laboratory inhibition of the dominant moulds isolated from Chinese common rattan [J].China Wood Industry,2005,19(5):23-24,27.(in Chinese)
[11] 吕文华,刘杏娥,刘君良.黄藤材的真菌变色 [J].林业科学,2011,47(8):196-200.LV W H,LIU X E,LIU J L.Fungal staining of Daemonorops margaritae canes[J].Scientia Silvae Sinicae,2011,47(8):196-200.(in Chinese)
[12] 刘杏娥,汪佑宏,江泽慧,等.黄藤材发育过程中维管束的变化 [J].西北林学院学报,2010,25(2):152-155.LIU X E,WANG Y H,JIANG Z H.Vascular bundle variation in the growth of Daemonorops margaritae [J].Journal of Northwest Forestry University,2010,25(2):152-155.(in Chinese)
[13] MARTIN B E,ELLIS J P.Microfungi on land plants:an identification handbook[M].New York:Macmillan Publishing Co.,1997.
[14] HAWKSWORTH D L,KIRK P M,SUTTON B C,et al.Ainsworth &Bisby's dictionary of the fungi [M].New York:Oxford University Press,1996.
[15] GARDES M,BRUNS T D.ITS primer with enhanced specificity for basidiomycetes:Application to the identification of mycorrizae and rust[J].Molecular Ecology,1993,2(2):113-118.
[16] 陈剑山,郑服从.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786,3792.CHEN J S,ZHENG F C.Application of ITS sequences in fungi classification and identification [J].Journal of Anhui Agri,2007,35(13):3785-3786,3792.(in Chinese)
[17] 王家明,宋亚琼,刘宏亮,等.雷公藤内生真菌的分离鉴定及抗肿瘤活性菌株筛选 [J].西北林学院学报,2011,26(5):145-148.WANG J M,SONG Y Q,LIU H L,et al.Isolation of endophytic fungi fromTripterygium wilfordii and the screening of its antitumor activities[J].Journal of Northwest Forestry University,2011,26(5):145-148.(in Chinese)

