Cd2+对毛蚶的毒性效应及对其SOD活性和TAOC的影响
阎 波,李 英,高 楠,詹志华,高 杨,张静雯
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
Cd2+对毛蚶的毒性效应及对其SOD活性和TAOC的影响
阎 波,李 英,高 楠,詹志华,高 杨,张静雯
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
在实验室条件下研究了CdCl2对毛蚶的急性毒性效应及对其超氧化物歧化酶(SOD)活性和总抗氧化能力(TAOC)的影响.CdCl2对毛蚶24、48、72、96,h的半致死浓度(LC50)分别为24.88、14.52、10.54、6.20,mg/L,随着暴露时间的增加LC50逐渐变小,说明Cd2+对毛蚶的毒性逐渐增加,毛蚶长时间暴露在较低质量浓度的CdCl2溶液或短时间暴露在高质量浓度的CdCl2溶液中均可产生致死效应.同时测定了不同质量浓度 Cd2+(100、500,µg/L)胁迫9,d和清洁海水恢复后毛蚶体内SOD活性和TAOC值的变化,毛蚶体内SOD活性和TAOC值总体被诱导,SOD活性在第9天达到最大值,TAOC诱导率在染毒第7天达到峰值,随后下降.消除Cd2+的胁迫进行清水恢复后,毛蚶SOD活性降低,TAOC变化不明显(P>0.05),表明Cd2+对毛蚶的氧化胁迫作用不会在短时间之内得到恢复.
Cd2+;毛蚶;急性毒性;超氧化物歧化酶(SOD);总抗氧化能力(TAOC)
重金属镉是一类存在于海洋水体和沉积物中的主要污染物,具有来源广、残毒时间长、易蓄积、污染后不易被发现并且难于去除的污染特征[1].过量的重金属离子能导致生物体内产生大量的活性氧类物质如、·OH、H2O2,从而引起机体氧化应激,造成生物大分子和膜脂质过氧化,进而诱发多种机体损害[2].单质金属镉毒性很低,但其化合物毒性很大,其中毒性最大的为CdCl2.生物体内有一套有效的抗氧化防御系统来防止活性氧对机体的损伤,研究较多的抗氧化酶有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽(GSH)和酚氧化酶(PO)等[3–6].SOD等酶活的大小可间接反映体内自由基的产生和毒物对细胞的损伤情况,亦可反映组织内清除自由基的能力.由于酶活性测定受温度等条件的影响较大,对测定的准确性目前存在争议.近年来,发展出用总抗氧化能力(TAOC)来评估机体抗氧化系统功能状况的综合性指标[7].如计勇等[8]分析了鲫鱼大脑与肌肉组织中TAOC 强弱与水体污染程度之间的响应关系,认为脑组织中TAOC 对外源污染物胁迫反应敏感,适宜作为污染水体的总抗氧化能力生物标志物.高春生等[9]选择SOD、CAT、GPx和TAOC为指标,研究了水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响.王艳艳等[10]同样以SOD、CAT、GPx和TAOC为指标,研究了Pb2+对建鲤幼鱼抗氧化酶活性和总抗氧化能力的影响.目前关于这方面的研究主要集中于各种水生鱼类,而对于底栖生物研究相对较少.
毛蚶是我国渤海海域优势底栖生物,是常用的监测海洋污染物生物有效性的指示生物[11].而且毛蚶作为一种经济生物,是重要的海产品资源,其生物安全性与人类健康息息相关.本实验以渤海湾天津海域潮间带典型底栖生物毛蚶为受试生物,研究了Cd2+污染胁迫对毛蚶的急性毒性及其SOD活性和TAOC的影响,旨在从生化水平上揭示污染物对生物的毒性机制.
1 材料与方法
1.1 实验材料
实验所用毛蚶购于塘沽海产品市场.实验前选择健康的毛蚶驯养7,d,驯养期间每日换水一次,连续曝气,并定时投喂角毛藻.然后选择新鲜、健康、大小均匀,体质量(9.00±2.00)g,平均壳高(2.0±0.5)cm的毛蚶进行实验.实验海水为海水晶配制的人工海水,盐度30.
CdCl2·2.5H2O,分析纯,天津市化学试剂三厂;SOD、TAOC、蛋白质测试试剂盒,南京建成生物工程研究所.
1.2 实验方法
1.2.1 急性毒性实验
配制质量浓度为500,mg/L的CdCl2使用液.首先进行预实验,确定CdCl2对毛蚶的最小致死浓度(MLC)和最大致死浓度(LC100)后,设置CdCl2溶液质量浓度系列为1.00、2.00、3.98、7.94、15.84,mg/L (等对数间隔).每个浓度组放入10只毛蚶,同时设立对照组,每个浓度组设3个重复.每24,h更换实验溶液一次并昼夜连续曝气.实验期间毛蚶禁食.实验过程中及时捞出死亡个体,观察并记录各浓度组毛蚶的24、48、72、96,h 的死亡数.死亡标准是两壳长久张开、多次刺激无反应.CdCl2溶液对毛蚶的半致死浓度(LC50)确定采用概率单位法,即根据毛蚶的死亡率查百分数和概率单位对照表,得到死亡率的概率单位,然后以质量浓度的常用对数为横坐标,死亡率的概率单位为纵坐标,通过回归方程,分别求出不同暴露时间的LC50.
1.2.2 SOD活性和TAOC测定
实验采用静态染毒法,设定CdCl2溶液染毒质量浓度分别为100,µg/L和500,µg/L,同时设立对照组,每组放入20只毛蚶,每24,h更换实验溶液一次,及时捞出死亡的个体.连续曝气,定时投喂角毛藻.染毒实验共进行9,d,之后换成干净的未染毒海水,进行2,d的恢复实验.在静态染毒后的1、3、5、7、9,d和恢复实验的第3天进行取样,从各浓度组随机取2只毛蚶,迅速去除外壳,取出其肉体,用滤纸吸去表面水分,称量后用剪刀剪碎,放入玻璃匀浆器中,按照质量(g)∶体积(mL)=1∶9的比例加入9倍的生理盐水,在冰浴中制备成10%,的组织匀浆,经冷冻离心机(0~4,℃,3,500,r/min)离心15,min后,取上清液,置于-20,℃下待测.
SOD活性、TAOC和蛋白质含量的测定均参照试剂盒说明书进行.其中SOD的测定采用黄嘌呤氧化酶法,定义每毫克组织蛋白在1,mL反应液中SOD抑制率达50%,时所对应的SOD量为一个SOD活力单位,单位为U/mg.其计算公式为

TAOC的测定采用菲啉类物质比色法.定义在37,℃时,每分钟每毫克组织蛋白使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位,单位为U/mg.其计算公式为

蛋白含量采用考马斯亮兰法进行测定,单位为mg/mL.所有指标吸光度值均用752型紫外-可见分光光度计(上海光谱仪器有限公司)进行测定.
1.3 实验数据处理
实验结果采用SPSS 统计软件进行数据的统计分析.结果用“平均数±标准偏差”表示.采用回归分析方法进行剂量–效应关系分析;用单因素方差分析法分析不同组别之间的差异,用LSD法比较组间数据,P≤0.01表明差异极显著,0.01<P≤0.05 表明差异显著,P>0.05 表明差异不显著.
2 结果与讨论
2.1 Cd2+对毛蚶的急性毒性效应
Cd2+对毛蚶具有较强的毒性,在本实验条件下,表现出明显的中毒症状.将24、48、72、96,h Cd2+各染毒浓度胁迫下毛蚶的死亡率分别换算成概率单位,与各浓度的常用对数进行线性回归(图1),得到不同暴露时间Cd2+对毛蚶的LC50,结果见表1.

图1 不同暴露时间Cd2+浓度对数与毛蚶死亡率概率单位的线性回归曲线Fig.1 Linear curve of the probability unit of the death rata of Anadara subcrenata and the logarithm of Cd2+concentration for different exposure time

表1 不同暴露时间下Cd2+对毛蚶的LC50Tab.1 The LC50of Cd2+on Anadara subcrenata for different exposure time
Cd2+对毛蚶的LC50值随着暴露时间的增加而逐渐变小,说明随着暴露时间的增加,Cd2+对毛蚶的毒性逐渐增加,毛蚶长时间暴露在较低质量浓度的CdCl2溶液或短时间暴露在高质量浓度的CdCl2溶液中均可产生致死效应.陈建华等[12]研究了石油烃和镉对毛蚶的单一急性毒性和联合毒性,得到CdCl2对毛蚶的24、48、72、96,h LC50值分别为12.27、7.86、6.16、5.17,mg/L,均略小于本实验结果,可能与受试生物生长地域、发育状态、实验室条件等因素不同有关.王召根等[13]研究了Cd2+和Cu2+对泥蚶的急性毒性,得到CdCl2对泥蚶的96,h LC50值为6.189,mg/L;徐彦等[14]研究了Cd2+和Pb2+对菲律宾蛤仔的急性毒性,得到其24、48、96,h 的LC50值分别为11.146、7.584、4.740,mg/L,可见对于不同生物,Cd2+对其急性毒性效应略有差别.
2.2 Cd2+对毛蚶SOD活性的影响
在Cd2+作用下,随着实验天数的增加,SOD活性变化情况见图2.由图2可见:染毒实验期间毛蚶SOD活性整体呈现被诱导的趋势.计算出的毛蚶SOD诱导率见表2.以下图表中,*表示相同胁迫时间段内染毒组与对照组间结果存在显著性差异(P≤0.05);3*代表清水恢复第3天.

图2 Cd2+对毛蚶体内SOD活性的影响Fig.2 Effect of Cd2+ on the SOD activity of Anadara subcrenata

表2 不同暴露时间下Cd2+对毛蚶SOD诱导率的影响Tab.2Effect of Cd2+on the induction rate of SOD of Anadara subcrenata for different exposure time
低质量浓度组(100,µg/L)第3天和第5天SOD活性与对照组相比被抑制,但染毒组1、3、5,d SOD活性没有出现大的变化,在实验第7天,SOD活性显著被诱导,第9天达到最大值,诱导率为25.06%,.高质量浓度组(500,µg/L)在染毒期间SOD活性随时间增加逐渐升高,实验第9天SOD活力达到峰值,诱导率达到33.17%,.可见高质量浓度Cd2+对毛蚶SOD活性的诱导作用大于低质量浓度Cd2+.消除Cd2+的胁迫,进行清水恢复后,毛蚶SOD活力水平有一定降低,低质量浓度组(100,µg/L)与对照组无显著性差异(P>0.05),高质量浓度组与对照组相比,仍有显著性差异(P<0.01).
通常在污染物的胁迫作用下,SOD等酶活可能会发生诱导或抑制两种应激反应,诱导效应可以看作是生物体克服污染胁迫可能引起的不良反应而表现出的一种适应性改变,而抑制效应反映出生物体由于对污染胁迫比较敏感,可能受到了一定程度的损伤.在本实验中,在Cd2+的作用下,毛蚶SOD活性呈现被诱导的趋势,可以看作是毛蚶对外界环境的胁迫产生的应激和自我保护反应,通过提高SOD的活性来适应Cd2+的氧化胁迫作用.毛蚶对高质量浓度Cd2+的应激效应大于低质量浓度Cd2+.消除Cd2+的作用后,SOD活性有一定程度的降低,表明低质量浓度Cd2+胁迫带来的氧化压力是可以逐渐恢复的,而高质量浓度Cd2+胁迫带来的氧化压力不能在短时间之内得到恢复.
2.3 Cd2+对毛蚶TAOC的影响
在Cd2+的胁迫下,通过对毛蚶经静态染毒后1、3、5、7、9,d和恢复实验的第3天进行取样分析,得到其不同质量浓度(100、500,µg/L)Cd2+作用下TAOC随时间的变化情况,如图3所示.

图3 Cd2+对毛蚶体内TAOC值的影响Fig.3 Effect of Cd2+ on TAOC in Anadara subcrenata
由图3可知:在实验期间,由于Cd2+的胁迫作用,染毒组毛蚶体内TAOC值明显高于对照组(P≤0.05),表现出TAOC被诱导的效应.随着实验天数的增加,染毒组TAOC值总体呈现先升高后降低的趋势.计算出毛蚶TAOC的诱导率,见表3.
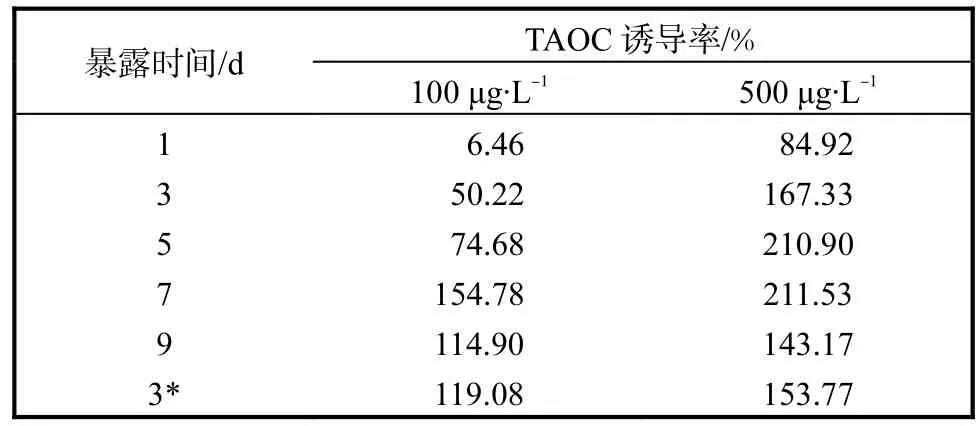
表3 毛蚶TAOC的诱导率变化趋势Tab.3The changing trend of induction rate of TAOC in Anadara subcrenata
由表3可知:高质量浓度Cd2+(500,µg/L)对毛蚶TAOC的诱导作用大于低质量浓度Cd2+(100,µg/L).高质量浓度Cd2+组在实验第5天,毛蚶体内TAOC值即被诱导到极高水平,第7天诱导率继续保持较高水平,并达到峰值211.53%,,随后诱导率略有降低;低质量浓度Cd2+组TAOC值在实验第7天达到最大值,诱导率为154.78%,,随后诱导率出现下降趋势.消除Cd2+的胁迫进行清水恢复后,高、低质量浓度Cd2+染毒组毛蚶TAOC诱导率均略有上升,与染毒第9天TAOC值相比无显著性差异(P>0.05).高春生等[9]的研究表明黄河鲤暴露于低于0.50,mg/L的Cu2+溶液时,TAOC 高于对照组,而Cu2+质量浓度高于0.50,mg/L 时,TAOC 随着暴露时间的延长而减小(P<0.05).王艳艳等[10]的研究表明在Pb2+的作用下,建鲤幼鱼肾、肠中TAOC 随暴露浓度的升高活性增强;肝胰脏、鳃、肌肉中TAOC随着暴露浓度的升高先上升后下降.可见重金属的种类和浓度对不同海洋生物总抗氧化能力的影响略有差别.
TAOC是用于衡量机体抗氧化系统功能状况的综合性指标,它的大小可以反映机体对外源化合物胁迫下的总抗氧化能力,与以往很多学者研究的抗氧化酶系统相比,TAOC值既可包括酶促系统(如SOD、CAT、GPX等),又包括非酶促系统(如GSH,维生素E、C、K、A 等,尿酸,血浆铜蓝蛋白(CP),胡萝卜素,葡萄糖氨基酸,金属蛋白等),其强弱与生物体健康程度存在着密切的关系[15].在Cd2+的作用下,会诱导机体产生活性氧产物,对毛蚶产生一定程度的氧化胁迫,毛蚶体内TAOC呈现被诱导的趋势,表明毛蚶在Cd2+的胁迫下,首先借助自身的抗氧化系统来维持机体自由基的代谢平衡,用以清除Cd2+诱导产生的过多活性氧自由基(如SOD活性的增加),同时在维生素等非酶促系统的共同作用下,力图保持生物体内活性氧产生和抗氧化系统的酶反应对活性氧清除之间的动态平衡[16],但是随着染毒时间的延长,抗氧化防御系统的动态平衡被打破,TAOC的诱导率出现下降趋势,细胞内的自由基不能被有效清除,从而产生一定程度氧化胁迫.高质量浓度Cd2+对毛蚶的氧化胁迫作用大于低质量浓度Cd2+.在消除Cd2+的胁迫后,TAOC变化不明显(P>0.05),表明由于Cd2+对毛蚶的氧化胁迫作用,对酶促系统和非酶促系统均产生影响,消除Cd2+的作用后,虽然SOD活性有一定程度降低,Cd2+对酶促系统的氧化压力有一定程度恢复,但毛蚶的总抗氧化能力不会在短时间之内得到恢复.尤其是在高质量浓度Cd2+的作用下随着时间的延长能否恢复尚需进一步的研究.
3 结 语
(1)CdCl2对毛蚶的24、48、72、96,h LC50值分别为24.88、14.52、10.54、6.20,mg/L,随着暴露时间的增加LC50值逐渐变小,说明Cd2+对毛蚶的毒性逐渐增加.毛蚶长时间暴露在较低质量浓度的CdCl2溶液或短时间暴露在高质量浓度的CdCl2溶液中均可产生致死效应.
(2)在本实验的染毒条件下,毛蚶体内SOD活性和TAOC值呈现被诱导的效应,SOD活性在第9天达到最大值,TAOC诱导率在染毒第7天达到峰值,随后出现下降趋势,说明毛蚶已出现一定程度的氧化胁迫.消除Cd2+的胁迫进行清水恢复后,高、低质量浓度Cd2+染毒组毛蚶SOD活性有一定降低,TAOC变化不明显,表明Cd2+对酶促系统的氧化压力有一定程度恢复,但毛蚶的总抗氧化能力不会在短时间之内得到恢复.
(3)毛蚶SOD和TAOC 对Cd2+反应敏感,可以作为生物标志物来指示水体低剂量Cd2+的污染.
致谢:本研究得到天津科技大学科学研究基金(20120120)的资助,谨表谢忱.
[1] Yap C K,Shahbazi A,Zakaria M P.Concentrations of heavy metals(Cu,Cd,Zn and Ni)and PAHs in Perna viridis collected from seaport and non-seaport waters in the Straits of Johore[J].Bull Environ Contam Toxicol,2012,89(6):1205-1210.
[2] 王晓宇,杨红生,王清.重金属污染胁迫对双壳贝类生态毒理效应研究进展[J].海洋科学,2009,33(10): 112–118.
[3] 杨进孙,周书林.金属离子对不同螺龄湖北钉螺酚氧化酶活性的影响[J].中国媒介生物学及控制杂志,2014,25(3):246–248.
[4] 胡蓉,唐正义.铯对蚯蚓CAT和SOD活性的影响[J].西南大学学报:自然科学版,2014,36(10):70–75.
[5] 王群,孟范平,李永富,等.北部湾文蛤体内氧化逆境标志物对重金属积累的响应研究[J].中国科学:化学,2013,43(9):1189-1199.
[6] 李艳红.温度和铜离子对近江牡蛎抗氧化物酶活力及相关基因表达的影响[D].湛江:广东海洋大学,2013.
[7] Mukai K,Morimoto H,Okauchi Y,et al.Kinetic study of reactions between tocopheroxyl radicals and fatty acids[J].Lipids,1993,28(8):753–756.
[8] 计勇,陆光华.污染水体的总抗氧化能力生物标志物研究[J].中国环境科学,2010,30(3):395-399.
[9] 高春生,王春秀,张书松.水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响[J].农业环境科学学报,2008,27(3):1157-1162.
[10] 王艳艳,姚俊杰,梁正其,等.Pb2+对建鲤幼鱼抗氧化酶活性和总抗氧化能力的影响[J].淡水渔业,2013,43(1):55-58.
[11] 李厦,刘宪斌,田胜艳,等.天津大港近岸海域生物体内重金属、石油烃含量及其安全风险评价[J].安全与环境学报,2013,13(3):157–160.
[12] 陈建华,阎斌伦,李盈蕾,等.石油烃和镉对毛蚶的急性毒性与联合毒性效应研究[J].水生态学杂志,2010,3(3):85–89.
[13] 王召根,吴洪喜,王瑶华,等.Cd2+和Cu2+对泥蚶的急性毒性和联合毒性试验[J].海洋科学,2014,38(8):16–20.
[14] 徐彦,王悠,周斌,等.Cd2+和Pb2+的单一和复合作用对菲律宾蛤仔的急性毒性效应研究[J].海洋环境科学,2013,32(1):6–10.
[15] Regoli F,Principato G.Glutathione,glutathionedependent and antioxidant enzymes in mussel,Mytilus galloprovincialis,exposed to metals under field and laboratory conditions:Implications for the use of biochemical biomarkers[J].Aquatic Toxicology,1995,31(2):143–164.
[16] Sun Y Y,Yin Y,Zhang J F,et al.Bioaccumulation and ROS generation in liver of freshwater fish,goldfish Carassius auratus under HC Orange No.1,exposure[J].Environmental Toxicology,2007,22(3):256–263.
责任编辑:周建军
Toxic Effects of Cadmium on Anadara Subcrenata as well as its SOD Activity and Total Antioxidative Competence
YAN Bo,LI Ying,GAO Nan,ZHAN Zhihua,GAO Yang,ZHANG Jingwen
(Tianjin Key Laboratory of Marine Resource and Chemistry,College of Marine Science and Engineering,Tianjin University of Science & Technology,Tianjin 300457,China)
The acute toxicity of CdCl2on Anadara subcrenata as well as its SOD activity and total antioxidative competence have been studied under experimental conditions.The result showed that the LC50of cadmium exposed to Anadara subcrenata for 24,48,72 and 96 hours were 24.88,14.52,10.54 and 6.20 mg/L,respectively.With the increase of exposure time,the LC50value decreased gradually,which indicated that the acute toxicity of CdCl2on Anadara subcrenata increased with the increase of exposure time,and Anadara subcrenata would face lethal risk after being exposed to low concentration CdCl2solution for a long time or to high concentration CdCl2solution for a short time.The SOD activity and TAOC value were measured after Anadara subcrenata being exposured to different concentrations(100,µg/L,500,µg/L)of cadmium separately for 9 days and then recovered in clean water.The results showed that the SOD activity and TAOC were induced.The SOD activity reached the maximum at the 9th day,the induction rates of TAOC reached the peak value after 7 days contamination and then declined.The SOD activity fell after Anadara subcrenata was transferred to clean water,but the difference of TAOC was not significant,which indicated that Anadara subcrenata cannot recover from the stress effects of Cd2+in a short time.
Cd2+;Anadara subcrenata;acute toxicity;superoxide dismutase(SOD);total antioxidative competence(TAOC)
X503.225
A
1672-6510(2015)05-0048-05
10.13364/j.issn.1672-6510.20140154
2014–11–28;
2015–01–03
天津市应用基础与前沿技术研究计划资助项目(15JCYBJC23200);天津科技大学大学生实验室创新基金资助项目(1305A207)
阎 波(1973—),女,河南人,副教授,yanbo@tust.edu.cn.

