2型糖尿病合并骨质疏松症患者血管钙化的相关因素分析
郑淑君,张 娟,李奇全,于献泽(太钢总医院内分泌科,太原 030003;太钢总医院内科门诊;通讯作者,E-mail:shujun666@6.com)
糖尿病性骨质疏松症(diabetic osteoporosis,DO)是糖尿病在骨骼系统的重要并发症之一。随着世界人口老龄化趋势,糖尿病发病率逐年增加,DO的患病率也有明显增多的趋势。本研究针对DO人群,测定胸部正位片、颈部血管彩超、踝肱指数(ABI)评价动脉钙化情况,同时测定该人群的骨钙素(BGP)、Ⅰ型胶原C端肽(CTX)、超敏C反应蛋白(hs-CRP)和同型半胱氨酸(Hcy),评价骨质疏松症(osteoporosis,OP)基础治疗人群钙化率是否高于未治疗人群,探讨这些指标与该人群血管钙化的关系。
1 资料与方法
1.1 病例选择
选择2012-01~2015-01山西医科大学附属太钢总医院2型糖尿病合并原发性OP住院患者96例,男44例,女52例,年龄(66.9 ±9.2)岁;2 型糖尿病无 OP患者100例,男55例,女45例,年龄(65.8 ±7.8)岁。两组间年龄、性别、体重、病程、糖化血红蛋白差异无统计学意义(P>0.05,见表1)。
表1 2型糖尿病合并骨质疏松患者一般情况分析(±s)
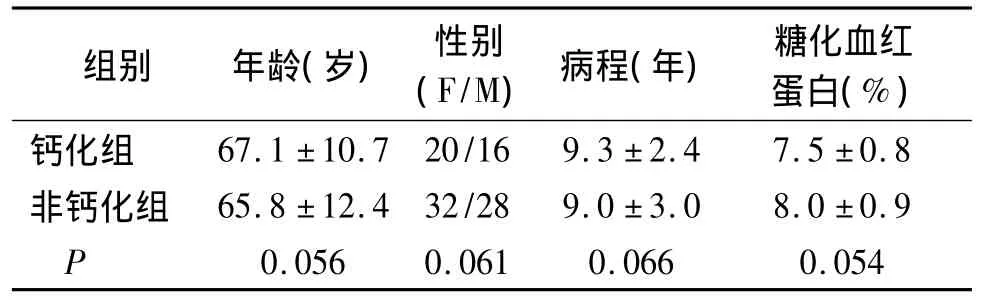
表1 2型糖尿病合并骨质疏松患者一般情况分析(±s)
组别 年龄(岁) 性别(F/M) 病程(年) 糖化血红蛋白(%)67.1 ±10.7 20/16 9.3 ±2.4 7.5 ±0.8非钙化组 65.8 ±12.4 32/28 9.0 ±3.0 8.0 ±0.9 P钙化组0.056 0.061 0.066 0.054
1.2 方法
1.2.1 患者分组 按2型糖尿病有无OP分为两组:2型糖尿病合并原发性OP组与2型糖尿病无OP组。DO患者96例,2型糖尿病诊断均符合1999年WHO的糖尿病诊断及分型标准。判断OP的标准参照1994年WHO的诊断标准,即受试者骨密度(BMD)降低程度等于和大于同性别、同种族正常成人的BMD峰值2.5个标准差(T≤-2.5)。2型糖尿病无OP患者100例,不包括平时服用钙剂人群。DO按是否存在动脉钙化分为两组:钙化组40例和非钙化组56例。DO按是否予骨质疏松基础治疗分为两组:治疗组46例,该组患者均服用骨化三醇每日0.25 μg,碳酸钙 D 片每日600 mg(2011年中国原发性骨质疏松症诊治指南推荐量),不包括应用二磷酸盐类治疗患者,期间每3月监测血钙、血磷1次,如有高钙血症需减量或停用,停用后不能入组;非治疗组50例。
另外排除有以下疾病的患者:有影响骨代谢的内分泌疾病(性腺、肾上腺、甲状腺及甲状旁腺疾病等),其他代谢性骨病(如骨软化症和成骨不良),类风湿性关节炎等免疫性疾病,影响钙及维生素D吸收及调节的消化道和肾脏疾病,合并肿瘤、血液、结缔组织病,长期服用糖皮质激素和其他影响骨代谢药物。有心、肾、肝功能不全者,急性脑血管意外及长期卧床者。
1.2.2 指标测定 骨密度测定:采用双能X线吸收法测骨密度,对腰椎L1-L4和股骨颈进行测量,其中精度误差百分变异系数 LS为0.9%,股骨颈为1.2%。除外继发因素明确原发性OP患者符合入选要求者入骨质疏松组,无OP患者符合入选要求者入非骨质疏松组。
血管钙化判定:通过西门子Vx Plus行胸部正位片;两组患者通过应用西门子2000彩色多普勒系统和9.0 MHz探头探测颈部动脉,钙化斑块判断标准:与血管外膜相比强回声并伴有声影;通过ES-100V3双向多普勒血流仪测定ABI,2003年美国糖尿病协会指出糖尿病患者ABI>1.3则提示动脉钙化[1]。三种方法反映不同部位:胸主动脉、颈动脉、足背及胫后动脉,有其一支持钙化即认为有血管钙化。
骨转换生化标志物及hs-CRP,Hcy测定:取患者清晨空腹静脉血6 ml,置于含2%EDTA-Na2100 μl试管中;3 000 r/min离心10 min;分离血清置于-70℃冰箱保存待检。采用 cobas 6000(德国罗氏)E601模块及原装配套试剂电化学发光法全自动免疫分析BGP、CTX及维生素D;用邻甲酚酞络合剂直接比色法测定血钙,血磷;免疫比浊法测定hs-CRP,采用循环酶法测定Hcy。
1.3 统计学处理
2 结果
2.1 DO患者血管钙化组和非钙化组骨质疏松程度比较
钙化组骨密度T值(-3.2±0.6),非钙化组骨密度T值(-2.6±0.4),差异有统计学意义(P=0.043)。
2.2 T2DM合并OP组与非OP组患者血管钙化率比较
OP组钙化40例,非钙化56例;非OP组钙化28例,非钙化72例,两组间血管钙化率比较差异有统计学意义(χ2=4.037 6,P=0.044 5)。
2.3 OP治疗组和非治疗组血管钙化率比较
OP治疗组钙化40例,非钙化56例;非治疗组钙化28例,非钙化72例,两组间钙化率差异无统计学意义(χ2=0.278 3,P=0.597 0)。
2.4 DO患者血管钙化与相关指标分析
OP钙化组CTX高于非钙化组,BGP低于非钙化组,差异有统计学意义(P<0.01);血钙在OP钙化组高于非钙化组,但差异无统计学意义(P>0.05),两组间维生素D和血磷差异无统计学意义(P>0.05);OP钙化组hs-CRP和Hcy高于非钙化组,差异有统计学意义(P<0.01,见表2)。
表2 2型糖尿病骨质疏松患者血管钙化与相关指标分析(±s)
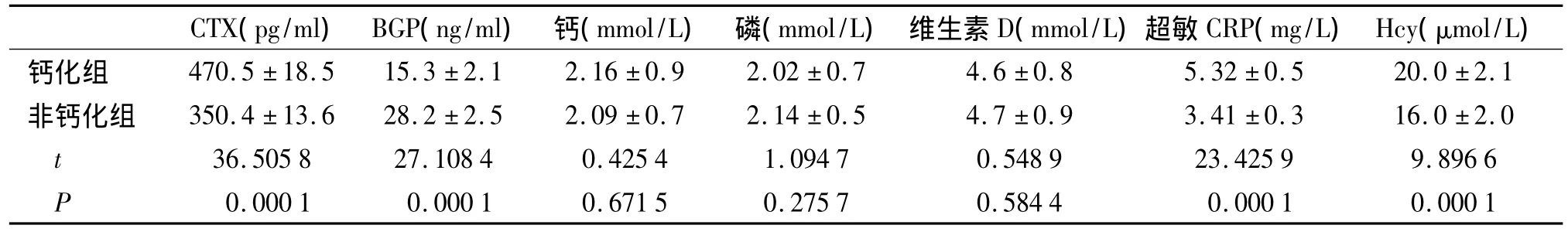
表2 2型糖尿病骨质疏松患者血管钙化与相关指标分析(±s)
CTX(pg/ml)BGP(ng/ml) 钙(mmol/L) 磷(mmol/L) 维生素D(mmol/L)超敏CRP(mg/L)Hcy(μmol/L)钙化组 470.5 ±18.5 15.3 ±2.1 2.16 ±0.9 2.02 ±0.7 4.6 ±0.8 5.32 ±0.5 20.0 ±2.1非钙化组 350.4 ±13.6 28.2 ±2.5 2.09 ±0.7 2.14 ±0.5 4.7 ±0.9 3.41 ±0.3 16.0 ±2.0 t 36.505 8 27.108 4 0.425 4 1.094 7 0.548 9 23.425 9 9.896 6 P 0.000 1 0.000 1 0.671 5 0.275 7 0.584 4 0.000 1 0.000 1
3 讨论
OP是一种以骨量减少、骨的微结构退化、骨强度减低、脆性增加、骨折发生率增高为特征的系统性骨骼疾病。原发性OP是除外继发于其他影响骨代谢的疾病后诊断的,不包括T2DM。流行病学调查显示,DO 的发病率高达 52.1%[2]。李小凤等[3]研究发现,T2DM患者会由于各种危险因素导致OP的发生。其可能原因是:T2DM长期高血糖引发渗透性利尿,使钙、磷排泄增加而影响骨吸收,同时胰岛素缺乏导致骨基质合成、转换等下降;另外,随着T2DM病程延长,其并发症也会对骨吸收产生不良影响。
血管壁上钙过量沉积称为血管钙化。血管钙化是动脉硬化的一种,是动脉粥样硬化、糖尿病、肾病、衰老、高血压等多种疾病的病理生理基础,是心血管疾病的主要危险因子。主要表现为血管壁僵硬性增加,顺应性降低,易导致心肌缺血、左心室肥大和心力衰竭,引发血栓形成、斑块破裂,是心脑血管疾病高发病率和高死亡率的重要因素之一[4]。本研究通过胸片正位片及进行糖尿病并发症筛查的颈部血管彩超、下肢多普勒血流仪综合评价不同部位钙化,可提高诊断的敏感性,但与钙化程度及技术人员技术有关。这三种方法均有价格低廉、较少放射性暴露优点,对于钙化评价最可靠的是电子束 CT(EBCT)和多层螺旋CT(MDCT),但由于价格昂贵、设备缺乏、电离的暴露等不适合在临床中广泛应用。
本研究结果示:DO患者血管钙化组较非钙化组骨质疏松程度较重。既往有研究证明:OP与血管钙化之间存在密切的联系,推测血管钙化与骨代谢异常有共同机制。本研究证明DO治疗组较非治疗组钙化率无增高,因维生素D对代谢的影响是双向的,生理浓度则提高成骨细胞活性,病理浓度则提高破骨细胞活性,维生素D使用不当,可能会造成钙化;适宜的维生素D水平可以抑制血管钙化[5]。本研究人群患者应用补钙及补充维生素D剂量均为低临床剂量,故相对血管钙化高发的尿毒症人群的大剂量使用(大剂量冲击疗法基础起始剂量每次1-2 μg,1周2次),普通OP治疗量的钙剂及维生素D对血管钙化无促进作用。
本研究表明hs-CRP,Hcy与动脉钙化呈显著相关。这与陈观生等[6]、何朝生等[7]的研究证明得出的冠状动脉钙化及心脑血管事件与hs-CRP等炎性因子因素密切相关的结论相符合,从而进一步证明机体微炎症状态在血管钙化发展中的作用[7]。Krivosikov等[8]通过对体外细胞培养发现,随着Hcy表达的增加,反映破骨细胞活性的CTX活性亦随之增强,提示促进骨吸收可能是Hcy诱发OP发生、发展的机制之一。骨钙素又称骨钙蛋白(BGP),是反映骨形成的生化指标,是成骨细胞晚期分化的标志分子,成骨细胞产生BGP降低,对软骨及胶原组织的异常钙化抑制,故有致骨质疏松作用,同时在血管的管壁细胞形成钙结节[9]。故本研究证明DO钙化组较非钙化组BGP降低、CTX偏高,hs-CRP和Hcy偏高与既往研究一致。
近年血管钙化的细胞分子机制研究结果表明,血管的管壁细胞包括管周细胞、成纤维细胞、内皮细胞、肥大细胞、吞噬细胞、尤其是血管平滑肌细胞(VSMCs)在诱导条件下(炎症因子、转化生长因子、25-羟化胆固醇等)均可转变为具有合成和分泌功能的成骨细胞样表型,能合成和分泌多种骨形成蛋白如碱性磷酸酶、骨形态发生蛋白、骨桥蛋白(OPN)、骨连接素和骨钙蛋白(BGP)等,在细胞外基质或胞质中形成钙结节[10]。故hs-CRP可促进血管钙化。
DO和血管钙化都是致残、致死的重要因素,二者互为因果,互相促进。骨质疏松基础治疗不增加血管钙化风险,积极治疗骨质疏松,临床中应注意糖尿病人群应注意OP及血管钙化的筛查。血清BGP测定降低,CTX升高;hs-CRP,Hcy升高,对该人群血管钙化风险评估有指导作用。
[1]American Diabetes Association.Peripheral arterial disease in people with diabetes[J].Diabetes Care,2003,26(12):3333-3341.
[2]Ito T,Schaffer SW,Azuma J.The potential usefulness of taurine on diabetes mellitus and its complications[J].Amino Acids,2012,42(5):1529-1539
[3]李小凤,施秉银,庞雅玲,等.2型糖尿病并发骨质疏松的相关危险因素分析[J].西安交通大学学报(医学版),2010,31(2):197-199.
[4]李桂英,吕波,邸彬,等.2型糖尿病骨质疏松的发病率及其相关因素分析[J].中国骨质疏松杂志,2009,15(8):568-571.
[5]Kveiborg M,Rattan SI,Clark BF,et al.Treatment with 1.25-dihydroxyvitamin D3 reduces impairment of human osteoblast functions during cellular aging in culture[J].Cell Physiol,2001,186(10):128-133.
[6]陈观生,欣洲,郑磊,等.尿毒症透析患者冠状动脉钙化的相关因素分析[J].海南医学,2006,17(10):5-7.
[7]何朝生,史伟,梁馨苓,等.尿毒症患者微炎症状况与心血管事件的相关性研究[J].中华血液净化,2010,7(5):256-259.
[8]Krivosikov Z,Krajeov-kudlckov M,Spustov V,et al.The association between high plasma homocysteine Levels and lower bone mineral density in slovak women:the impart of vegetarian diet[J].Eur J Nutr,2010,49(2):147-153.
[9]齐永芬.重视对血管钙化的基础研究[J].中华老年心脑血管病杂志,2004,6(5):358-360.
[10]Chen NX,Moe SM.Arterial calcification diabetes[J].Curr Diabin Rep,2003,3(6):28-32.

