肝再生过程中胆汁酸对肝细胞cyclin D1和NTCP蛋白表达的影响
董秀山,贺杰峰,赵浩亮(山西大医院普通外科,太原 030032;通讯作者,E-mail:haoliangzhao@hotmail.com)
肝再生是临床各种急慢性肝病和肝脏外科手术后重要的病理生理过程。维持正常的肝再生是修复肝损伤的必然机制,肝再生失调和重型肝炎、肝硬化以及肝癌等疾病的发生发展密不可分。因此,深入分析和阐述肝再生调控及影响机制,对治疗临床肝病具有非常重要的意义。前期的研究结果发现大鼠肠道胆汁酸缺乏使再生肝细胞的增殖细胞核抗原PCNA、Ki-67表达显著下降,并伴随血清总胆汁酸水平的下降和胆汁酸合成限速酶(CYP7A1)mRNA表达的升高[1]。提示胆汁酸是维持正常肝再生的重要内源性物质,CYP7A1的表达升高抑或为在肝再生过程中对机体缺乏胆汁酸的反应性调节。在此基础上,本实验重点观察在肝再生过程中,肠道缺乏胆汁酸对肝细胞基膜侧胆盐摄取系统Na+依赖牛磺胆酸钠协同转运蛋白(NTCP)以及细胞周期蛋白D1(cyclin D1)表达的影响。
1 材料与方法
1.1 动物分组及模型建立
清洁级雄性Wistar大鼠72只(山西医科大学动物实验中心),体重200-280 g,随机分为3组。肠道胆酸缺乏组于术前7 d饲喂含2%无水考来烯胺饲料;胆酸负荷组于术前7 d饲喂含0.2%胆酸饲料;对照组饲喂标准饲料,每组根据处死模型大鼠的时间不同即6 h,12 h和24 h又分为三小组,每小组大鼠8只。所有大鼠均在乙醚麻醉下行70%(肝左叶+肝中叶)肝部分切除术(partial hepatectomy,PH),建立肝再生大鼠动物模型。术后根据分组继续给予相应饲料喂养,分别于6 h,12 h和24 h乙醚麻醉处死大鼠,收集肝脏标本于-80℃保存。
1.2 主要试剂和仪器
胆酸钠(C24H40O5,408.58),美国 Sigma 公司;无水考来烯胺,南京厚生药业有限公司;兔抗NTCP抗体,美国ADL公司;兔抗大鼠cyclin D1抗体,北京博奥森生物技术有限公司;BCA试剂盒、辣根过氧化物酶标记山羊抗兔IgG,碧云天生物技术研究所;超声粉碎仪,上海楚定分析仪器有限公司;低温离心机,美国Beckman-Coulter公司;Tanon-2500凝胶成像系统,上海天能科技有限公司。
1.3 Western blot检测cyclin D1和NTCP蛋白表达
按试剂操作说明书提取蛋白质,整个过程尽量在冰上进行。为了保证上样量的均衡,用BCA试剂盒测定蛋白含量,然后加入适量样品和Buffer在90℃变性20 min。取各组制备的蛋白样品用10%SDS-PAGE分离,电转移至PVDF膜上,并用丽春红染色检测转移效果。封闭液37℃下孵育1 h,分别加兔抗大鼠cyclin D1抗体(1∶500)和兔抗NTCP抗体(1∶400),4℃封闭过夜。TBST冲洗,滴加辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)孵育1 h,TBST冲洗,化学发光法显色,洗片。凝胶成像分析系统分析条带的灰度值,以β-actin作为内参,计算各组相应的灰度值比值。
1.4 统计学分析
2 结果
2.1 大鼠肝细胞cyclin D1蛋白表达的比较
通过比较三组大鼠在70%肝部分切除术后6 h cyclin D1相对表达量,发现胆酸缺乏组大鼠肝组织的表达量显著低于对照组(P<0.05),而胆酸负荷组显著高于对照组(P<0.05)和胆酸缺乏组(P<0.01)(见图1)。在术后12 h时,胆酸缺乏组和对照组无统计学差异,但显著低于负荷组(P<0.05,见图2)。
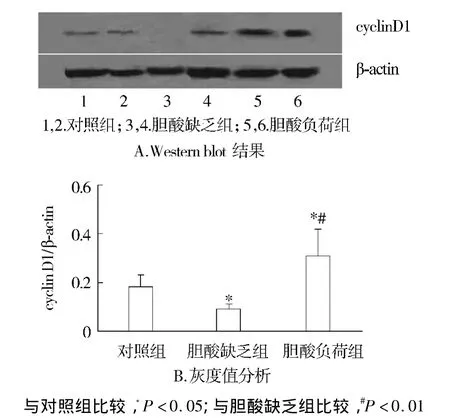
图1 三组大鼠PH后6 h肝组织cyclin D1蛋白表达Figure 1 Expression of cyclin D1 protein in liver tissues at 6h after the operation
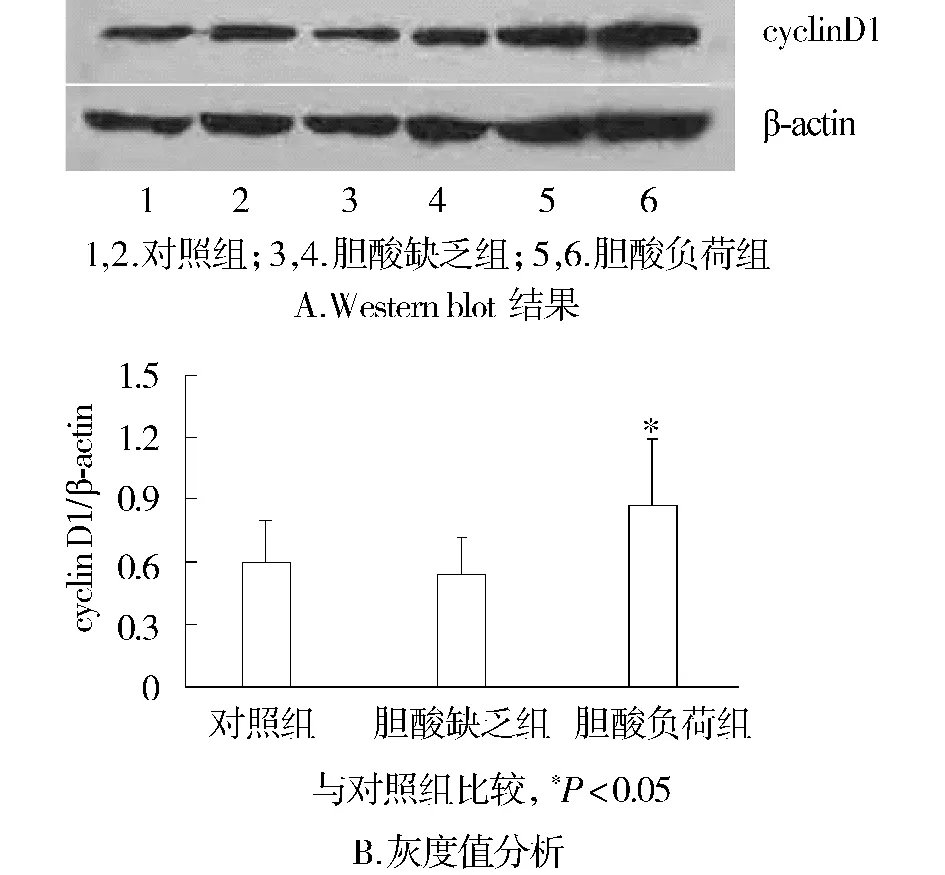
图2 三组大鼠PH后12 h肝组织cyclin D1蛋白表达Figure 2 Expression of cyclin D1 protein in liver tissues at 12 h after the operation
2.2 肝部分切除术后24 h NTCP蛋白表达
前期研究显示在术后24 h大鼠血清总胆汁酸和肝再生情况变化最为显著。因此,检测术后24 h肝细胞基膜侧胆盐摄取系统Na+依赖牛磺胆酸钠协同转运蛋白(NTCP)对肝再生时评估肝细胞对胆汁酸重吸收能力更具有意义。蛋白图像分析的数据显示(图3),胆酸缺乏组的NTCP蛋白相对表达量最高,胆酸负荷组NTCP的表达量最低,与对照组比较,差异均有统计学意义(P<0.05)。
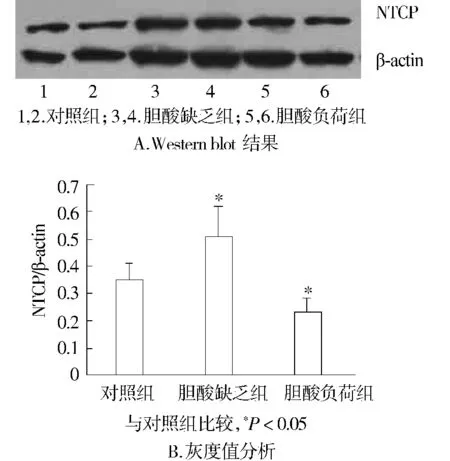
图3 三组大鼠PH后24 h肝组织NTCP蛋白表达Figure 3 Expression of NTCP in liver tissues at 24 h after the operation
3 讨论
一般认为,胆汁酸对脂类和脂溶性物质的消化吸收以及调节胆固醇代谢发挥着重要作用。然而,1999年胆汁酸受体(farnesoid X receptor,FXR)的发现使人们开始重新认识胆汁酸的生理作用,即胆汁酸在糖、脂和能量代谢等方面发挥着重要作用[2-4]。本课题前期研究发现适当增加体内胆汁酸含量显著促进大鼠肝部分切除术(PH)后肝细胞DNA合成,反之则显著抑制,且伴有肝细胞DNA合成的高峰延迟[1]。本实验数据显示70%PH后6 h,肝组织cyclin D1蛋白表达由高到低依次为胆酸负荷组、对照组和胆酸缺乏组(P<0.05);70%PH后12 h,胆酸缺乏组和对照组的肝组织cyclin D1蛋白表达无统计学差异,但显著低于胆酸负荷组(P<0.05),这些结果进一步说明胆汁酸在肝再生过程中发挥着重要作用。
究其机制,在过去10多年中,大量关于FXR功能的研究已经证实FXR是一种关键的代谢调节剂,主要调节胆汁酸内环境稳态、脂蛋白和葡萄糖代谢,认为FXR可能充当着代谢压力的一般感应器和调节特定群组基因表达的调节器的角色从而达到保护肝脏的目的[5]。因此,胆汁酸作为肝脏的重要代谢产物,目前的研究结果不能完全诠释胆汁酸调节肝再生的机制,其机制仍需进一步深入研究。
肝细胞是高度极性化的上皮细胞,肝细胞极性是肝脏独特生理功能的基础,是研究正常肝脏生理功能及肝再生过程中重要的物质结构。肝细胞极性主要由生理功能不同的基底侧膜(血窦侧)、顶端膜(胆管侧)和侧面膜构成。在肝再生过程中,肝细胞基膜侧胆盐摄取系统Na+依赖牛磺胆酸钠协同转运蛋白(NTCP)对调节肝细胞内胆汁酸发挥着重要作用[6]。本课题通过检测PH后24 h肝组织NTCP蛋白表达,显示胆酸缺乏组的NTCP蛋白相对表达量最高,而胆酸负荷组NTCP的表达量最低。这些可能是在肝再生过程中,体内对肝细胞缺乏胆汁酸的一种自我调节,通过上调NTCP来增加肝细胞内胆汁酸的含量。
事实上,再生肝细胞极性重建不是细胞增殖的后续效应,而是肝再生过程中不可分割的一部分。2011年Fu等[7]研究发现胆汁酸在肝细胞极性形成中发挥着一个新的重要作用,添加牛磺胆酸钠促进大鼠肝细胞极性形成,提示胆汁酸可能是肝细胞极性紊乱的潜在治疗物质。因此,进一步观察胆汁酸和肝细胞极性形成的相互关系可能为研究肝再生和胆汁淤积肝病提供新思路。
[1]Dong X,Zhao H,Ma X,et al.Reduction in bile acid pool causes delayed liver regeneration accompanied by down-regulated expression of FXR and C-Jun mRNA in rats[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(1):55-60.
[2]Parks DJ,Blanchard SG,Bledsoe RK,et al.Bile acids:natural ligands for an orphan nuclear receptor[J].Science,1999,284(5418):1365-1368.
[3]Makishima M,Okamoto AY,Repa JJ,et al.Identification of a nuclear receptor for bile acids[J].Science,1999,284(5418):1362-1365.
[4]Wang H,Chen J,Hollister K,et al.Endogenous bile acids are ligands for the nuclear receptor FXR/BAR[J].Mol Cell,1999,3(5):543-553.
[5]Li T,Jahan A,Chiang JY.Bile acids and cytokines inhibit the human cholesterol 7 alpha-hydroxylase gene via the JNK/c-jun pathway in human liver cells[J].Hepatology,2006,43(6):1202-1210.
[6]Attakpa ES,Djibril NM,Baba-Moussa F,et al.Expression and role of the genes involved in the transport of bile acids in the liver and kidneys in mice[J].J Basic Clin Physiol Pharmacol,2013,24(2):97-103.
[7]Fu D,Wakabayashi Y,Lippincott-Schwartz J,et al.Bile acid stimulates hepatocyte polarization through a cAMP-Epac-MEK-LKB1-AMPK pathway[J].Proc Natl Acad Sci U S A,2011,108(4):1403-1408.

