早产胎盘组织中差异表达基因的研究
孙 健,汪 云,陶建英,陈 瑛(南京医科大学附属苏州医院产科,苏州 500;南京医科大学附属苏州医院新生儿科;通讯作者,E-mail:cyandzh@sohu.com)
早产是指妊娠不足37周而分娩[1],是一种常见、重要且复杂的妊娠并发症,能显著增加产褥期并发症以及新生儿的各种疾病和病死率,约75%的围产儿死亡与早产有关[2]。全世界每年约1 490万早产儿降生,约占总新生儿的11.1%,而且比例有不断上升的趋势[3]。目前研究认为,早产是多种因素相互作用所致的一种综合征,年龄、孕产史、不良行为、感染、遗传因素、炎症、宫缩和子宫颈长度等与早产相关[4,5],但是早产发生的确切机制还不明确。随着芯片技术的发展,发现基因的异常表达是引起早产的重要原因。Chim等[6]的研究发现,孕晚期母亲血清中基因的差异表达导致早产。而有关早产胎盘中基因表达谱的研究还很少,所以本研究应用基因芯片技术通过对早产的胎盘组织及足月产胎盘组织进行基因表达谱的检测及qRT-PCR验证,旨在筛选及确定与早产相关的基因,从而为早产的预防、诊断提供新的分子标志物。
1 材料与方法
1.1 材料来源与分组
选择2013-02~2013-10在南京医科大学附属苏州医院产科常规产前检查并且早产的早产儿16例为病例组,参照第7版《妇产科学》诊断标准,选取同期的健康足月产儿20例为对照组,获取两组胎盘组织作为研究材料。两组均为单胎妊娠,年龄20-40岁的初产妇或经产妇,排除原发性高血压、肾病、糖尿病、心脏病、前置胎盘等内外科疾病及产科并发症,两组孕妇详细情况见表1。所有孕妇均已签署知情同意书,方案通过南京医科大学附属苏州医院伦理委员会批准。
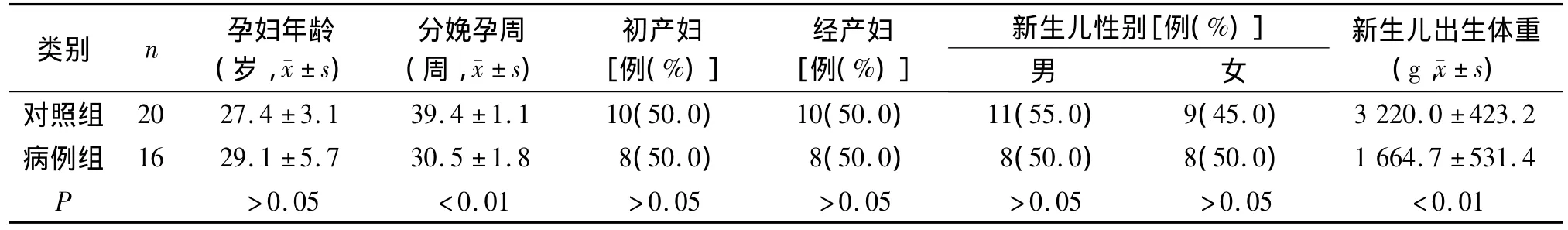
表1 两组孕妇及其新生儿一般情况比较Table 1 Comparison of general data of pregnant women and neonates between two groups
1.2 胎盘标本采集
标本采集于胎盘娩出后5 min内迅速完成。于胎盘胎儿面,避开钙化点,在胎盘不同区域剪取数块胎盘组织,每块约1 cm见方,经DEPC(焦碳酸二乙酯)处理过的PBS漂洗2次,在滤纸上去除水分,分装于冻存管内,迅速置于液氮中速冻后转入-70℃冰箱保存。
1.3 总RNA的提取
采用总RNA抽提试剂盒(QIAGEN’s RNeasy),参照生产商的步骤提取胎盘组织总RNA。用分光光度计Nano Drop ND-1000测定RNA的浓度和纯度,通过琼脂糖甲醛变性凝胶电泳检测RNA质量,RNA中无DNA、无蛋白质污染、无明显降解,可用于基因芯片检测及实时荧光定量PCR(qRT-PCR)实验。
1.4 基因芯片的杂交、清洗及扫描
病例组中随机选取9例,对照组中随机选取4例进行基因芯片分析,采用芯片为GeneChip Primeview Human Gene Expression Array(Affymetrix公司)。每例样本取500 ng总RNA,使用IVT express kit(Affymetrix公司)扩增标记 cRNA,取15 μg标记好的cRNA,配制成 cocktail,加入芯片中于 Hybridization Oven 640(Affymetrix公司)中45℃杂交16 h,杂交好的芯片在FS450全自动洗涤工作站(Affymetrix公司)上洗涤染色,用GeneChip®scanner7G(Affymetrix公司)扫描芯片并通过AGCC软件得到原始数据,原始数据导入Expression Console软件(Affymetrix公司)得到质控数据。
1.5 芯片数据分析
采用商业软件Partek GS 6.5进行数据比对分析,去掉弱信号(信号值<400)后,用各个样本杂交信号值的中位值进行归一化处理,筛选差异表达基因,采用国际上通用的基因功能分析法,即基因本体(gene ontology,GO)功能注释分析法和KEGG通路分析法,对差异表达基因进行功能注释与分析。
1.6 qRT-PCR 验证
从芯片筛选到的差异表达的基因中,选择可能具有一定临床意义的基因在所有的样本中进行qRT-PCR验证(包括做基因芯片的样本)。提取的每例样本的总RNA通过HiScript®1st Strand cDNA Synthesis Kit(Vazyme)逆转录成cDNA,应用AceQ®qPCR SYBR®Green Master Mix(Vazyme)在 ABI 7500荧光定量PCR仪上进行qRT-PCR。以磷酸甘油醛脱氢酶(G3PDH)为内参,采用相对定量法分析病例组及对照组胎盘组织中基因mRNA的表达,使用2-ΔΔCt法分析所选基因的相对表达水平。
1.7 统计学分析
芯片结果采用统计软件SPSS 11.7进行分析,组间差异采用t检验(two-tailed),其中2倍以上变化,P<0.05认为差异具有统计学意义。qRT-PCR实验每组样品均设3个复孔,至少重复3遍。采用统计软件SPSS 11.7进行分析。计量资料以±s表示,组间差异采用t检验(two-tailed),P<0.05认为差异具有统计学意义。
2 结果
2.1 基因芯片结果
基因芯片包含了条36 000个转录本的信息,根据该芯片的结果,将病例组和对照组的表达谱进行对比,其中2倍以上变化并且差异有统计学意义认为是差异表达的基因。符合条件的基因共有75个,其中表达上调的有9个,表达下调的有66个。PSG9是上调倍数最多的基因,而LEP则为下调倍数最多的基因(见表2),聚类分类图见图1。
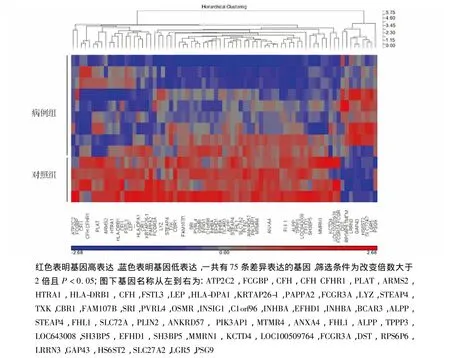
图1 4例对照胎盘组织和9例病例组胎盘组织差异表达基因聚类分析图Figure 1 Cluster analysis of 75 differentially expressed genes in placentas from 4 control placentas and 9 preterm placentas
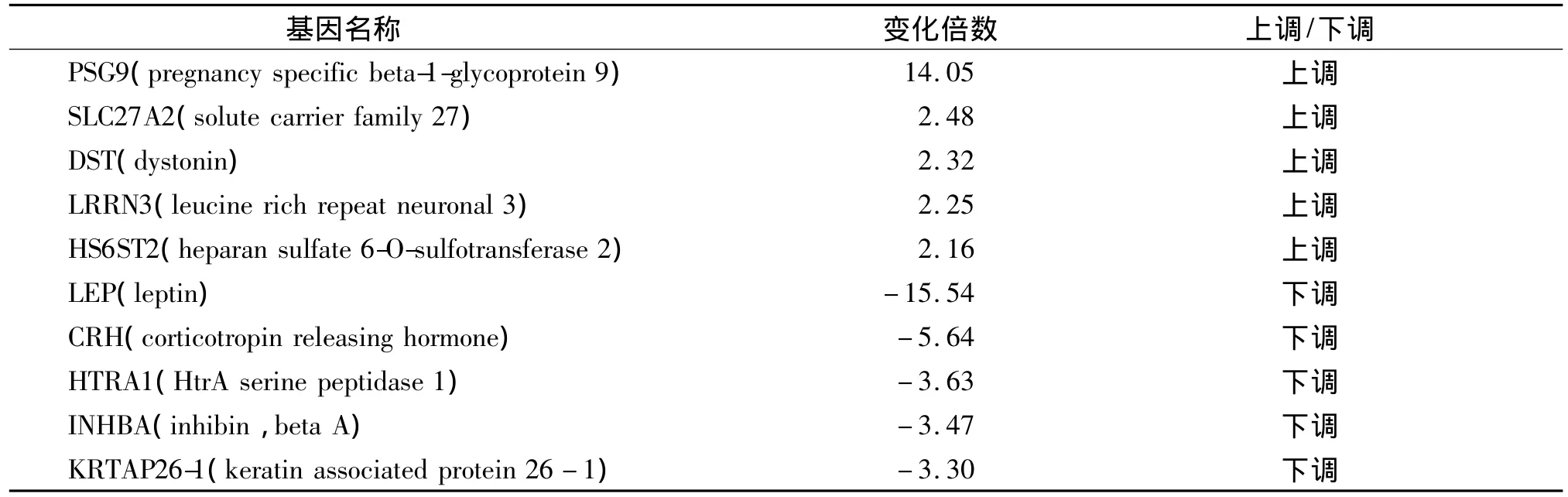
表2 基因芯片检测的人早产胎盘差异表达基因Table 2 Differentially expressed genes in placental tissues of the preterm neonates detected by microarray
2.2 GO功能注释分析以及KEGG通路富集分析结果
对75个差异表达基因分别进行GO功能注释分析以及KEGG通路分析。GO功能注释分析结果:差异表达基因主要参与抗原加工提呈、免疫应答、伤害应答和系统进程的调节等信号途径,筛选出的GO功能注释名称及其基因数见表3。KEGG通路分析结果:将差异显著基因在KEGG数据库中进行查询,设定P<0.05为显著性标准,差异表达基因中有全身性红斑狼疮相关、哮喘相关、同种异体移植物排斥相关、移植物抗宿主相关等信号通路相关作用的基因,筛选出的生物学通路名称及其基因数见表4。
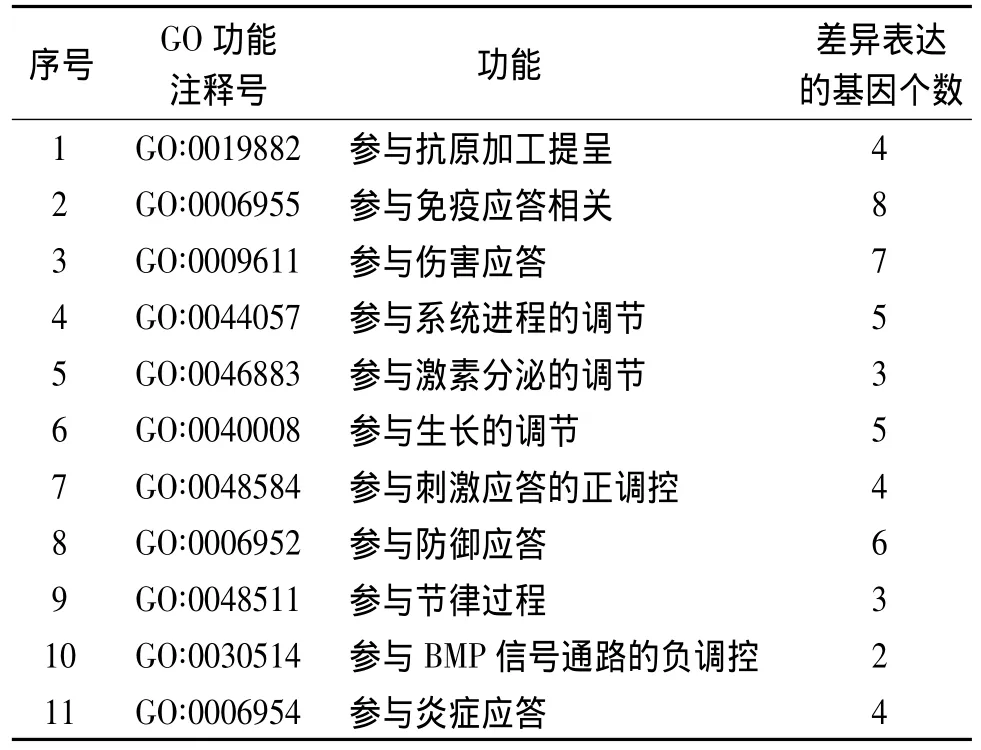
表3 差异表达基因的GO功能注释结果Table 3 GO enrichment analysis of differentially expressed genes

表4 差异表达基因的KEGG通路及其基因数Table 4 KEGG pathways and gene numbers of differentially expressed genes
2.3 qRT-PCR验证差异表达基因的结果
选取芯片中表达有差异的4个基因:妊娠特异性β-1糖蛋白9(PSG9)、促肾上腺皮质激素释放激素(CRH)、人妊娠相关血浆蛋白2(PAPPA2)和抑制素β-A(INHBA),以磷酸甘油醛脱氢酶(G3PDH)为对照基因,应用qRT-PCR技术在16例病例组胎盘和20例对照组胎盘中进行验证。结果表明,PSG9基因在病例组胎盘组织中的表达水平显著高于对照组,与对照组相比表达上调1.82倍;而CRH、PAPPA2和INHBA基因在病例组中的表达水平低于对照组,与对照组相比分别表达下调3.28倍、2.98倍和2.19倍,其结果与基因芯片技术检测结果基本相符(见表5)。
表5 差异表达基因的qRT-PCR验证结果(±s)Table 5 Confirmation of differentially expressed genes by RT-PCR(±s)
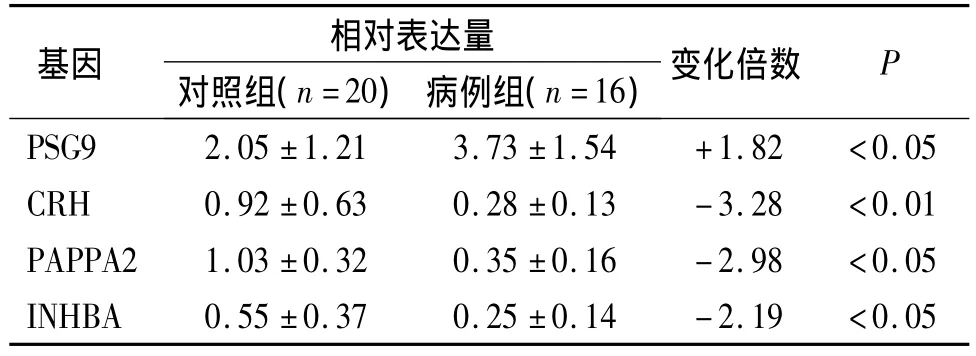
表5 差异表达基因的qRT-PCR验证结果(±s)Table 5 Confirmation of differentially expressed genes by RT-PCR(±s)
基因 相对表达量对照组(n=20) 病例组(n=16)变化倍数P PSG9 2.05 ±1.21 3.73 ±1.54 +1.82 <0.05 CRH 0.92 ±0.63 0.28 ±0.13 -3.28 <0.01 PAPPA2 1.03 ±0.32 0.35 ±0.16 -2.98 <0.05 INHBA 0.55 ±0.37 0.25 ±0.14 -2.19 <0.05
3 讨论
早产所致的围生儿发病率、病死率以及后遗症问题已成为一个世界性的卫生问题,然而早产的病因、发病机制尚不明确,可能通过遗传和环境的相互作用而发病,临床上尚缺乏有效的对因防治措施[7],因此找到早产的致病基因,从基因水平上预防治疗早产十分重要。基因芯片检测技术是鉴定疾病相关基因的有力工具[8],在产科相关疾病中有着广泛的应用[9,10]。本研究通过基因芯片技术从早产胎盘中鉴定出75个差异表达的基因,并对芯片中有显著差异表达的4个基因(PSG9、CRH、PAPPA2和INHBA)扩大样本量进行了qRT-PCR检测,其结果与基因芯片技术检测结果基本相符。
PSG9是妊娠特异性糖蛋白(PSG)家族中的一员,在GO功能注释中参与防御应答,PSG是在人类怀孕期间母体血液中含量最丰富的滋养层蛋白质。有文献表明低PSGs血清浓度与生长受限有关系[11],部分文献报道异常低浓度的PSGs与先兆子痫有关,但是也有研究表明异常低浓度的PSGs与先兆子痫没有关系[11,12],另外宫内孕和宫外孕PSGs的表达差异可以作为宫外孕临床检测的标记物[13]。但是PSG9与早产的关系还鲜有报道,我们的结果表明PSG9在早产胎盘样本中表达上调,提示可能改变机体的防御应答功能,从而早产中可能发挥重要作用,有望成为早产预测的一个分子标记物。
CRH在GO功能注释中参与激素分泌的调节、防御应答和炎症应答。在子宫、胎盘和卵巢中高表达,被认为参与妊娠的蜕膜化,胚胎植入和正常的怀孕过程以及分娩的开始[14]。胎盘源的CRH循环水平在孕期接近分娩时呈指数级增加,显示CRH可能是孕期长短的影响因素。与Mayor-Lynn等[15]的报道不一致,他们在5名早产胎盘和5名足月产胎盘中进行qRT-PCR验证得出相对于足月产胎盘,CRH在早产胎盘中过度表达。不一致的原因可能与个体差异和样本量有关,他们一共10例,我们36例。我们的结果发现CRH在早产胎盘中表达下调,可能改变了机体的激素分泌的调节、防御应答或炎症应答功能,提示CRH在胎盘中表达下调可能与早产的发生有关。
PAPPA2在GO功能注释中参与生长的调节。在人类胎盘中高表达,通过水解活性裂解胰岛素样生长因子结合蛋白(IGFBPs),PAPPA2裂解IGFBP5和可能裂解IGFBP3,因此调节胰岛素样生长因子的释放,以促进胎儿胎盘的生长。有研究表明,PAPPA2在胎盘中的异常表达可能与孕期并发症有关,PAPPA2蛋白在孕妇的外周血中可以检测到,因此可以用来作为胎盘异常的标记物[16]。我们的研究结果表明PAPPA2基因在早产胎盘中低表达,可能抑制胎盘的生长,从而在早产中起作用,有望成为早产预测的一个分子标记物。
INHBA在GO功能注释中参与生长的调节、防御反应和激素分泌的调节。与α亚单位一起由二硫键结合而成抑制素A,抑制素A是一种异源二聚体糖蛋白,绝大多数学者认妊娠早期胎盘是抑制素A的主要来源,影响着妊娠的发生、发展及胎儿的生长发育。研究表明胎盘中INHBA的表达与生长受限有相关性,并且在子痫前期患者的胎盘中差异表达[17];Zahra 等[18]的研究表明,母亲孕中期血清中抑制素A的升高容易引起早产,可以作为预测早产的标记物。我们的研究结果表明INHBA基因在早产胎盘中低表达,而在早产中的功能还需要进一步的功能研究。
本研究存在着一些不足之处。首先,本研究例数较少,虽然基因芯片检测结果与许多文献报道相符,但还需要更大样本重复上述实验,以更准确地了解早产胎盘的基因表达谱。其次,本研究仅筛选并验证了早产的差异基因,但相关差异表达基因在早产中所起的作用还需要功能试验阐明。
综上所述,本研究采用基因表达谱芯片技术检测到早产胎盘组织中存在异常表达的基因谱和信号通路,并用qRT-PCR技术验证了部分差异表达基因,与基因芯片检测的结果一致,这些结果为早产的后续研究提供了新的思路。
[1]WHO.Recommended definitions,terminology and format for statistical tables related to the perinatal period and use of a new certificate for cause of perinatal deaths.Modifications recommended by FIGO as amended October 14,1976[J].Acta Obstet Gynecol Scand,1977,56(3):247-253.
[2]McCormick MC.The contribution of low birth weight to infant mortality and childhood morbidity[J].N Engl J Med,1985,312(2):82-90.
[3]Blencowe H,Cousens S,Oestergaard MZ,et al.National,regional,and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries:a systematic analysis and implications[J].Lancet,2012,379(9832):2162-2172.
[4]Romero R,Espinoza J,Kusanovic JP,et al.The preterm parturition syndrome[J].BJOG,2006,113:17-42.
[5]Par˘ízek A,Koucky˘M,Dušková M.Progesterone,inflammation and preterm labor[J].J Steroid Biochem,2014,139:159-165.
[6]Chim SS,Lee WS,Ting YH,et al.Systematic identification of spontaneous preterm birth-associated RNA transcripts in maternal plasma[J].PLoS One,2012,7(4):e34328.
[7]Goldenberg RL,Culhane JF,Iams JD,et al.Preterm birth 1:epidemiology and causes of preterm birth[J].Lancet,2008,371(9606):75.
[8]Schadt EE,Zhang B,Zhu J.Advances in systems biology are enhancing our understanding of disease and moving us closer to novel disease treatments[J].Genetica,2009,136(2):259-269.
[9]Elovitz MA,Brown AG,Anton L,et al.Distinct cervical microRNA profiles are present in women destined to have a preterm birth[J].Am J Obstet Gynecol,2014,210(3):221.e1-11.
[10]宋英娜,杨剑秋,刘俊涛,等.早发型重度子痫前期孕妇胎盘组织中差异表达基因的研究[J].中华妇产科杂志,2014(7):501-505.
[11]Pihl K,Larsen T,Laursen I,et al.First trimester maternal serum pregnancy-specific beta-1-glycoprotein(SP1)as a marker of adverse pregnancy outcome[J].Prenat Diagn,2009,29(13):1256-1261.
[12]Bersinger NA,Odegard RA.Second-and third-trimester serum levels of placental proteins in preeclampsia and small-for-gestational age pregnancies[J].Acta Obstet Gynecol Scand,2004,83(1):37-45.
[13]Rausch ME,Sammel MD,Takacs P,et al.Development of a multiple marker test for ectopic pregnancy[J].Obstet Gynecol,2011,117(3):573-582.
[14]Grammatopoulos DK.Placental corticotrophin-releasing hormone and its receptors in human pregnancy and labour:still a scientific enigma[J].J Neuroendocrinol,2008,20(4):432-438.
[15]Mayor-Lynn K,Toloubeydokhti T,Cruz AC,et al.Expression profile of microRNAs and mRNAs in human placentas from pregnancies complicated by preeclampsia and preterm labor[J].Reprod Sci,2010,18(1):46-56.
[16]Wang J,Qiu Q,Haider M,et al.Expression of pregnancy-associated plasma protein A2 during pregnancy in human and mouse[J].J Endocrinol,2009,202(3):337-345.
[17]Eidem HR,Ackerman WT,Mcgary KL,et al.Gestational tissue transcriptomics in term and preterm human pregnancies:a systematic review and meta-analysis[J].BMC Med Genomics,2015,8:27.
[18]Sehat Z,Goshetasbi A,Taheri AM.Investigating association between second trimester maternal serum biomarkers and pre-term delivery[J].Iran J Reprod Med,2013,11(2):127-132.

