Wnt信号通路中GSK-3β和CD44v6在人结直肠肿瘤组织中的表达及意义
吴红霞,郑绘霞,梁建芳(山西医科大学第二医院西院病理科,太原 03000;山西医科大学第一临床医学院病理科;通讯作者,E-mail:liangjianfang000@63.com)
Wnt信号通路异常激活在结直肠癌(colorectal cancer,CRC)中被确认为是与肿瘤相关的一个关键性信号通路,大约90%的结直肠癌存在Wnt信号通路的异常激活,Wnt信号通路过度激活也常引起肿瘤侵袭转移能力的增强[1,2]。GSK-3β 为 Wnt信号通路中重要的负向调节因素,黏附分子CD44v6是Wnt信号通路突出的靶基因,本文通过研究二者在结直肠癌中的表达情况,探讨GSK-3β及CD44v6在结直肠癌发生发展中的的作用及二者相互作用关系,为临床预后及治疗提供一定的依据。
1 材料与方法
1.1 临床资料
选择山西医科大学第二医院西院病理科2014-01~2015-07间的石蜡包埋标本,包括20例正常结直肠肠黏膜、19例结直肠腺瘤和45例结直肠腺癌。正常肠黏膜组均为距肿瘤大于5 cm的切缘正常组织,男性10例,女性10例,年龄22-82岁,中位数65岁。腺瘤组,男性12例,女性7例,年龄30-80岁,中位数50岁。结直肠腺癌组,男性21例,女性24例,年龄22-82岁,中位数66.5岁。所有入选病例术前均未做过放、化疗。所有标本重新切片,HE染色形态学符合结直肠腺瘤与腺癌的特点。
1.2 实验方法
采用免疫组织化学EnVision两步法,鼠抗人GSK-3β多克隆抗体试剂购自Santa cruz biotechnology,Inc,鼠抗人CD44v6单克隆抗体试剂购自北京中杉金桥生物科技有限公司,DAB显色试剂购自福州迈新生物技术有限公司,用已知阳性的切片作阳性对照,PBS液代替一抗作为阴性对照,实验步骤按试剂说明书进行。
1.3 免疫组化判定标准
GSK-3β以细胞胞质出现棕黄色颗粒为阳性,CD44v6阳性表达定位于胞膜。免疫组化判读:随机选择10个高倍镜(400倍)视野,每个视野计数100个细胞,以阳性细胞比率(无着色为0分,<1/3为1分,1/3-2/3为2分,>2/3为3分)与染色强度(无着色、黄色、棕黄和棕褐色分别为0,1,2,3分)的乘积综合判断,0-4分为阴性(-),5-7分为阳性(+),8-10分为强阳性(++)。
1.4 统计学分析
所有资料均采用SPSS11.5统计软件包进行分析,组间比较及各指标临床病理参数的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 GSK-3β在各组织中的表达情况
正常结直肠黏膜中GSK-3β表达阳性率5.0%(1/20),腺瘤中 GSK-3β表达阳性率42.1%(8/19),CRC中GSK-3β表达阳性率77.8%(35/45)。CRC组GSK-3β表达显著高于腺瘤组和正常黏膜组,差异有显著性(P <0.05,见表1)。
CRC组GSK-3β表达与Dukes分期、分化程度、有无淋巴结转移均无关(P>0.05,见表2,图1)。
2.2 CD44v6在各组织中的表达情况
CD44v6在正常黏膜及腺瘤组织中均不表达,阳性率为0。在CRC中阳性率为55.6%(25/45,见图2)。CRC组CD44v6的表达显著高于腺瘤组和正常黏膜组,差异具有统计学意义(P<0.05,见表1)。
在CRC组中,CD44v6的表达与Dukes分期、淋巴结转移相关(P<0.05),而与分化程度无关(P>0.05,见表2,图2)。

表1 GSK-3β和CD44v6在结直肠正常黏膜、腺瘤及CRC中的表达 (例)Table 1 The expression of GSK-3β and CD44v6 protein in the normal intestinal mucosa,colorectal adenomas and colorectal carcinoma (cases)
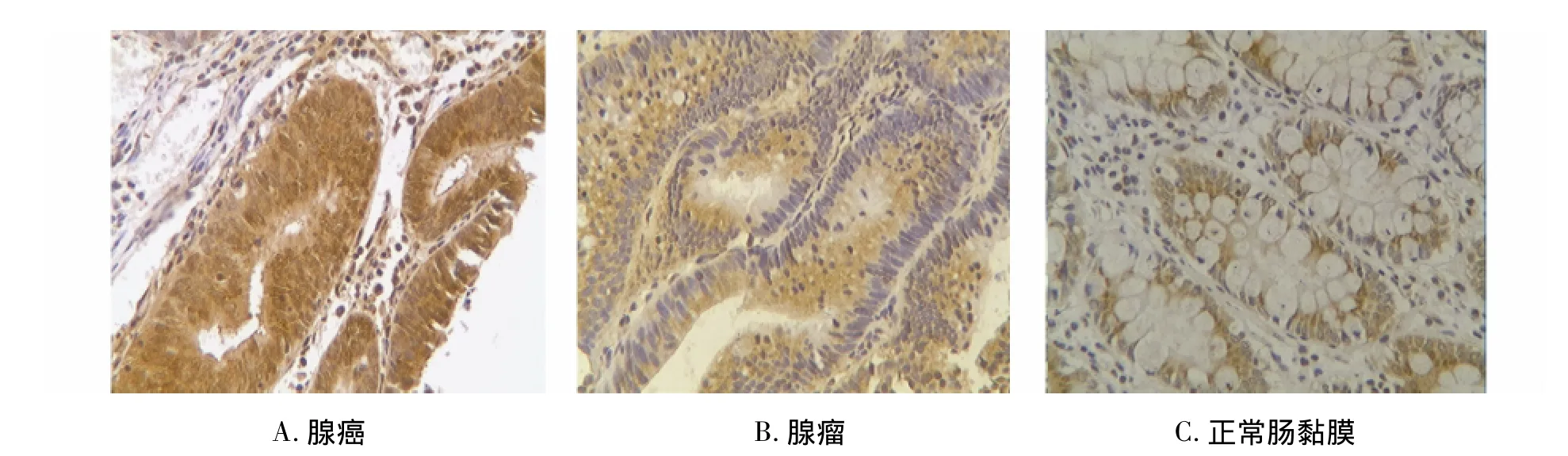
图1 GSK-3β在结直肠腺癌、腺瘤及正常肠黏膜的表达 (EnVision,×200)Figure 1 GSK-3β protein expression in the colorectal carcinoma,colorectal adenomas and normal intestinal mucosa(EnVision method,×200)

表2 GSK-3β和CD44v6在CRC中的表达与临床病理参数的关系Table 2 Relationship of GSK-3β and CD44v6 protein expression with clinicopathological characteristics in colorectal carcinoma

图2 CD44v6在结直肠腺癌、腺瘤及正常肠黏膜的表达 (EnVision,×200)Figure 2 CD44v6 protein expression in colorectal carcinoma,colorectal adenomas and normal intestinal mucosa(EnVision method,×200)
2.3 GSK-3β和CD44v6在CRC中表达的相关性
GSK-3β与CD44v6在CRC中表达共同阳性21例,共同阴性6例,经Spearman秩相关分析二者表达无相关性(r=0.167,P >0.05,见表 3)。
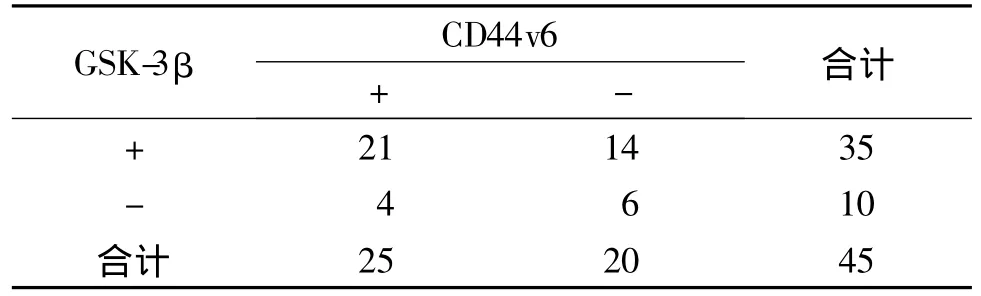
表3 CD44v6和GSK-3β表达在CRC中的相关性分析Table 3 Correlation analysis of GSK-3β and CD44v6 protein expression in colorectal carcinoma
3 讨论
CRC是全球人类主要的恶性肿瘤之一,严重威胁着人类的健康。目前认为CRC发生的机制有四种:经腺瘤癌变通路,锯齿状病变通路,溃疡性结肠炎相关的大肠癌通路及幼年性息肉病-癌途径。其中经腺瘤癌变途径的散发性CRC多认为与Wnt信号通路异常激活有关。
糖原合成酶激酶-3β(GSK-3β)是Wnt信号通路中重要的负向调节因子。GSK-3β是一种多功能的丝氨酸/苏氨酸蛋白激酶,人类多种疾病如糖尿病、肿瘤、神经退行性疾病、情感障碍和炎症等疾病的发生都与GSK-3β活性调节异常有关,在许多肿瘤组织中呈高表达[3-5]。GSK-3β作为Wnt信号通路中 APC-β-catenin-GSK-3β-Axin多聚蛋白复合体的重要一份子,是Wnt信号通路的负向调节因素,可磷酸化β-catenin的丝氨酸和苏氨酸位点,促使βcatenin的降解;亦可经Axin磷酸化APC,磷酸化的APC会增加其与β-catenin的结合,继而降解β-catenin,从而使Wnt信号通路保持沉默。GSK-3β也可直接调节β-catenin目的基因cyclin D1的降解,影响细胞的增殖[6]。在我们研究的45例 CRC中,GSK-3β在三组病例中的表达,无论是阳性病例数还是强阳性病例数都是正常黏膜→腺瘤→癌显著增高,意味着GSK-3β参与正常黏膜→瘤变→癌变通路,参与了CRC的发生,影响细胞的增殖和分化。在食管癌中,GSK-3β在组织中的表达明显高于正常食管上皮及非典型增生病变,但与临床病理参数如肿瘤分级、浸润深度及淋巴结转移均无关[7],但在子宫内膜癌中,GSK-3β在癌组织中的表达明显高于正常内膜组织,且与临床病理参数肿瘤分级、分期,肌层浸润程度及淋巴结转移相关,其过表达与子宫内膜癌的发生发展及转移密切相关[8]。
我们的研究显示,GSK-3β在CRC中表达与临床病理参数的Dukes分期、分化程度、淋巴结有无转移均不相关,表明GSK-3β在参与肿瘤细胞的增殖方面有一定的作用,但与肿瘤的浸润转移无明显相关性,即与肿瘤的恶性进展可能无多大关系,对评价患者的预后意义较小。
Wnt信号通路的过度激活常引起肿瘤侵袭转移能力的增强,黏附分子CD44作为Wnt信号通路上突出的靶基因,其过度表达是影响肿瘤转移的一个重要机制[9]。CD44是目前发现的五类细胞黏附分子之一(整合素、免疫球蛋白超基因家族、选择素、钙黏附素和CD44),CD44基因的表达产物是一种细胞表面的跨膜糖蛋白,能与多种配体分子结合,参与细胞与细胞、细胞与基质之间特异性粘连。
CD44基因的外显子按表达方式分为两种类型:标准构型CD44s和变异型CD44v。CD44v6为CD44v亚型之一,在肺癌、乳腺癌、膀胱癌、肝癌、宫颈癌、肾癌和非霍奇金淋巴瘤等多种肿瘤组织中均有显著高表达,并与恶性肿瘤进展程度、转移及预后密切相关[10]。在胃癌中的研究发现,CD44v6在组织中呈显著过表达,且与肿瘤的部位、浸润深度、淋巴结转移及TNM分期均有关,并且是胃癌预后的重要标记物[11]。在乳腺癌中,CD44v6同样呈高表达,并且与肿瘤大小、淋巴结转移及TNM分期有关[12]。本研究通过检测不同结直肠组织中CD44v6的蛋白表达情况,发现在正常黏膜和结直肠腺瘤中其表达缺失,而在CRC组织中显著高表达,阳性率为55.6%,提示CD44v6可能在一定程度上参与了CRC的进程。Jurrit等[13]研究发现 C57BL/6J-CD44-/-APCMin/+小鼠肠腺瘤的形成较C57BL/6J-CD44+/+APCMin/+小鼠减少50%,暗示CD44参与了肠腺瘤的启动。本实验 CD44v6在腺瘤组织中表达缺失,提示CD44v6对人结直肠腺瘤的发生并无直接影响,可能是CD44的其他亚型参与该过程。本研究还发现CD44v6在CRC中的表达与肿瘤的大小及肿瘤细胞的分化程度不相关,而与淋巴结转移有关。23例有淋巴结转移的病例,17例检测到CD44v6阳性表达,阳性率高于无淋巴结转移的病例,由此可见,CD44v6的表达与肿瘤的转移相关联。Amirghofran等[14]研究表明,有淋巴结转移的 CRC患者血清CD44v6水平显著增高,并与肿瘤组织中的高表达呈正相关,表明CD44v6在CRC的浸润转移过程中发挥着重要作用,做为CRC预后检测的肿瘤标志物尚需更多实验来证实。
Wnt信号通路的持续异常激活,一方面导致GSK-3β的功能失活引起异常表达,最终引起细胞的增殖,CRC的形成;另一方面,通过激活Wnt信号特定靶基因CD44等的转录,调控细胞的迁移,而CD44v6 直接参与肿瘤的浸润转移过程[15,16]。经Spearman秩相关分析,GSK-3β和CD44v6在CRC中的表达并无显著相关性,提示二者可能作为Wnt通路上两个独立的调控因子分别参与CRC的发生发展。
由此可见,GSK-3β在正常黏膜、腺瘤及CRC中均有表达,并呈阶梯式增高趋势,但其表达与CRC各临床病理参数无关,提示其参与了结直肠肿瘤的发生,而与CRC的转移进展无关。CD44v6在正常黏膜及腺瘤中不表达,在CRC组织中呈高表达,并与淋巴结转移密切相关,意味着CD44v6并不参与结直肠肿瘤的发生,而与CRC的转移进展有关。当然,由于本研究例数的限制,可能对实验结果造成误差,目前还在收集病例及新鲜标本做进一步的研究,希望能对二者在结直肠癌中的表达进行更深入的研究,为结直肠癌的预后及靶向治疗提供一定的依据。
[1]Ford CE,Henry C,Llamosas E,et al.Wnt signaling in gynaecological cancers:A future target for personalised medicine[J].Gynecol Oncol,2015:Epub ahead of print.
[2]Song L,Li Y,He B,Development of small molecules targeting the Wnt signaling pathway in cancer stem cells for the treatment of colorectal cancer[J].Clin Colorectal Cancer,2015,14(3):133-145.
[3]Amar S,Belmaker RH,Agam G.The possible involvement of glycogen synthase kinase-3(GSK-3β)in diabetes,cancer and central nervous system diseases[J].Curr Pharm Des,2011,17(22):2264-2277.
[4]Deng H,Zhang N,Wang Y,et al.S632A3,a new glutarimide antibiotic,suppresses lipopolysaccharide-induced pro-inflammatory responses via inhibiting the activation of glycogen synthase kinase 3β[J].Exp Cell Res,2012,318(20):2592-2603.
[5]Yoshino Y,Ishioka C.Inhibition of glycogen synthase kinase-3 beta induces apoptosis and mitotic catastrophe by disrupting centrosome regulation in cancer cells[J].Sci Rep,2015,5:13249.
[6]Tsuchiya K,Nakamura T,Okamoto R,et al.Reciprocal targeting of Hath1 and beta-catenin by Wnt glycogen synthase kinase 3beta in human colon cancer[J].Gastroenterology,2007,132(1):208-220.
[7]林锐,王伟.GSK313和E-cadherin在食管鳞癌中的表达及其意义[J].安徽医科大学学报,2013,48(4):387-389.
[8]张智慧.P-GSK3β和β-catenin蛋白在子宫内膜癌中的表达及临床意义[J].河北医药,2012,34(14):2091-2093.
[9]Schmitt M,Metzger M,Gradl D,et al.CD44 functions in Wnt signaling by regulating LRP6 localization and activation[J].Cell Death Differ,2015,22(4):677-689.
[10]Kuhn S1,Koch M,Nübel T,et al.A complex of epCAM,claudin-7,CD44 variant isoforms,and tetraspanins promotes colorectal cancer progression[J].Mol Cancer Res,2007,5(6):553-567.
[11]Xie JW,Chen PC,Zheng CH,et al.Evaluation of the prognostic value and functional roles of CD44v6 in gastric cancer[J].J Cancer Res Clin Oncol,2015,141(10):1809-1817.
[12]Wu XJ,Li XD,Zhang H,et al.Clinical significance of CD44s,CD44v3 and CD44v6 in breast cancer[J].J Int Med Res,2015,43(2):173-179.
[13]Zeilstra J,Joosten SP,Dokter M,et al.Deletion of the WNT target and cancer stem cell mar-ker CD44 in Apc(Min/+)mice attenuates intestinal tumorigenesis[J].Cancer Res,2008,68(10):3655-3661.
[14]Amirghofran Z,Jalali SA,Hosseini SV,et al.Evaluation of CD44 and CD44v6 in colorectal carcinoma patients:soluble forms in relation to tumor tissue expression and metastasis[J].J Gastrointest Cancer,2008,39(1-4):73-78.
[15]Li J,Karki A,Hodges KB,et al.Cotargeting Polo-Like Kinase 1 and the Wnt/β-Catenin Signaling Pathway in Castration-Resistant Prostate Cancer[J].Mol Cell Biol,2015,35(24):4185-4198.
[16]Orian-Rousseau V.CD44 Acts as a signaling platform controlling tumor progression and metastasis[J].Front Immunol,2015,6:154.

