水杨酸对盐胁迫下百日草种子萌发及幼苗生理特性的影响
黄玉梅,张杨雪,刘庆林,刘盼,黄胜岚
(四川农业大学风景园林学院,四川 成都611130)
土壤盐渍化是制约植物生长发育的重要逆境因素之一[1-6]。据联合国教科文组织(UNESCO)和粮农组织(FAO)不完全统计,世界盐碱地面积达9.5×108hm2,其中,我国约为1.0×108hm2,占我国可耕地面积1/4,占世界盐碱地面积1/10,并且呈不断增长的趋势,严重威胁着我国农业生产的可持续发展[7]。
水杨酸(salicylic acid,SA)是一种广泛存在于植物体内的小分子酚类物质,又是一种内源性激素,参与调节植物的许多生理过程[8]。大量研究表明,SA能够诱导植物在非生物逆境下产生病程相关蛋白(pathosgenetisisrelated proteins,PR-蛋白),增加渗透调节物质,提高酶活性[9],从而增强植物对逆境的抗性[10-12]。目前,关于添加SA 提高植物抗盐性的研究多见于小麦(Triticumaestivum)[13]、水稻(Oryzasativa)[14]、棉花(Gossypiumhirsutum)[15]等农作物[16-17]以及杨树(Populusdelotides×P.euramericana)[18]、白刺(Nitrariatangutorum)[19]、沙冬青(Ammopiptanthusmongolicus)[20]等木本植物,草本花卉较为少见。
百日草(Zinniaelegans)为菊科(Compositae)百日草属(Zinnia)一、二年生草花。花大色艳,可用于花坛、花境及盆花、切花的生产,在我国南北各地广为栽培。随着土壤盐渍化日益严重,百日草生长受到不同程度的影响,但迄今为止,百日草的研究主要集中于栽培技术、遗传育种以及分子生理[21-24]等方面,对盐胁迫下百日草的生理特性研究较少。因此,本研究以百日草种子和幼苗为试材,分析不同浓度外源SA处理后,种子萌发、幼苗生长及生理生化等方面的变化,探讨SA对盐胁迫下百日草的作用机制,旨在为缓解百日草盐害提供一定的理论和技术支撑。
1 材料与方法
1.1 试验材料
试验于2013年4-9月进行,供试百日草品种为“芳菲1号”,种子由四川农业大学花卉实验室提供。SA和NaCl,分析纯,含量≥99.5%,规格AR级,购于北京化学试剂公司。
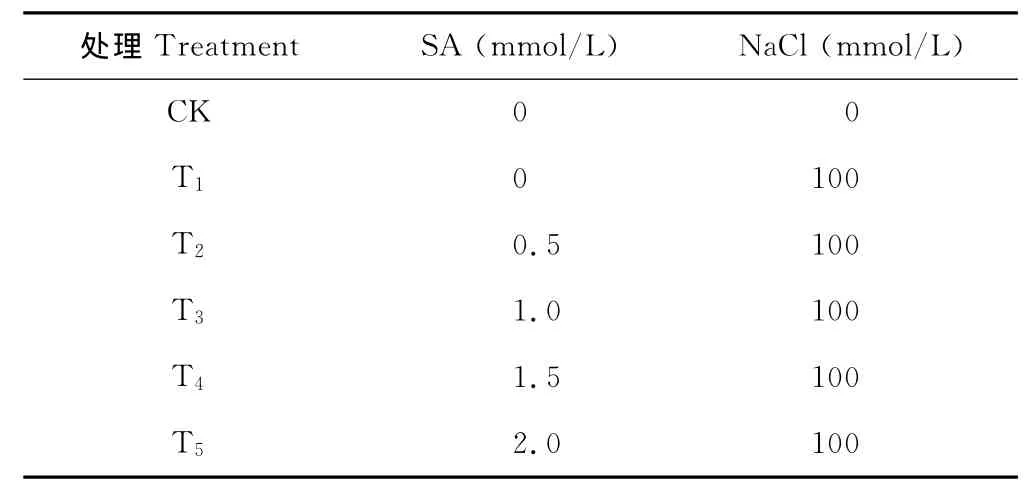
表1 各处理浓度Table 1 The concentration of treatments
1.2 试验方法
1.2.1 种子萌发试验 选取籽粒饱满的百日草“芳菲1号”种子,用0.1%HgCl2溶液消毒10min,蒸馏水漂洗3~4次。在预备试验基础上,选取100mmol/L NaCl作为本试验的盐处理浓度,水杨酸浓度梯度分别设置为0,0.5,1.0,1.5和2.0mmol/L(T1、T2、T3、T4、T5),其中T1为盐胁迫组,并用蒸馏水作为对照(CK),见表1。将消毒后的种子用不同浓度的SA浸种24h,CK和T1用等量的蒸馏水浸种。将浸种后的种子每50粒整齐置入铺有双层滤纸的培养皿中,沿着培养皿壁缓缓加入100mmol/L NaCl溶液,CK加入等量蒸馏水,加盖。置于温度为20℃,相对湿度为80%的光照培养箱中培养,8h光照,光照强度为500μmol/(m2·s),16h黑暗。每个处理重复3次,从发芽次日开始每天观察和统计发芽种子数(以胚根伸出种皮作为发芽标准),并始终保持滤纸湿润。连续记录7d,测定并计算种子萌发相关指标。
1.2.2 百日草幼苗生长试验 选取健康、饱满的种子,用0.1%HgCl2溶液消毒10min,蒸馏水漂洗3~4次,播种于营养钵中,每盆播种2粒种子,待种子发芽后选长势一致的植株定苗1株,每个处理播种50盆,基质为菜园土∶堆肥∶河沙=3∶2∶1,播种前充分灌溉至基质含水量达80%左右。将营养钵置于温度为20℃,相对湿度为80%的光照培养箱中培养,8h光照,光照强度为500μmol/(m2·s),16h黑暗,发芽后光周期设为14h光照,10h黑暗。试验共设6个处理(表1):以蒸馏水作为对照(CK),SA处理浓度分别设置为0,0.5,1.0,1.5和2.0mmol/L(T1、T2、T3、T4、T5)。待两片真叶展平后,先用注射器在其根颈部进行SA 注根初始诱导,每株20 mL,2d后用喷雾器喷施SA强化诱导[8],每株60mL,CK和T1用等量蒸馏水代替。强化3d后将100mmol/L NaCl溶液用注射器缓慢注入,每株40mL,CK加入等量蒸馏水。完成处理后第0,10,20,30天取生长状况一致的叶片测定其相关生理指标,并在第12天完成其相关形态指标的测量。
1.3 指标测定
1.3.1 种子萌发指标 参照王慧等[25]的方法测定百日草种子萌发相关指标。第3天统计发芽势,第7天统计发芽率。发芽势=(规定时间内供试种子的发芽数/供试种子数)×100%;发芽率(GP)=(供试种子发芽数/供试种子数)×100%;发芽指数(GI)=∑Gt/Dt;活力指数(VI)=GI×S。式中,Gt为在t日的发芽数;Dt为发芽天数;S为萌发第7天幼苗的长度。
1.3.2 幼苗形态指标 胁迫12d时,测定幼苗生长指标。株高、茎粗采用常规法,卷尺测量株高,游标卡尺测量茎粗。根冠比=根干重/地上部干重,干重用烘干法测得,先在烘箱中105℃下烘15min,再于80℃下烘至恒重。
1.3.3 生理生化指标 处理后第0,10,20,30天取生长状况一致的叶片测定各生理生化指标,其中,叶绿素含量采用丙酮乙醇混合液法[26]测定、脯氨酸(proline,Pro)含量测定采用酸性茚三酮显色法[27]、可溶性糖含量测定采用蒽酮比色法[28],可溶性蛋白含量测定采用考马斯亮蓝(G-250)染色法[29];丙二醛(malondialhyde,MDA)含量测定采用硫代巴比妥酸法[30]。超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑(NBT)法[29];过氧化物酶(peroxide,POD)活性测定采用愈创木酚法[31]。
1.4 数据处理
各处理每次测定重复3次,数据为3次测定的平均值。用Excel 2007软件处理数据和绘图,SPSS 19.0统计软件进行方差分析。
2 结果与分析
2.1 外源SA对盐胁迫下百日草种子萌发的影响
盐胁迫下,百日草种子萌发的相关指标均较对照组CK显著降低(P<0.05),但随着SA浸种浓度的增加各指标均呈现先升后降的趋势(表2)。其中,T2(0.5mmol/L)、T3(1.0mmol/L)、T4(1.5mmol/L)处理对盐胁迫下百日草种子萌发有显著促进作用,尤以T3效果最佳,其发芽势、发芽率、发芽指数及活力指数分别比T1高42.5%,26.5%,50.0%,79.8%;T2、T4次之。T5(2.0mmol/L)与 T1无显著差异(P>0.05)。发芽势可衡量种子发芽速度和整齐度;发芽率反映种子发芽能力;发芽指数一定程度上可反映发芽速度,而种子活力指数可综合体现种子质量。试验结果表明,SA浸种可有效缓解盐胁迫对百日草种子萌发的抑制作用,且SA浓度为1.0mmol/L效果最显著。
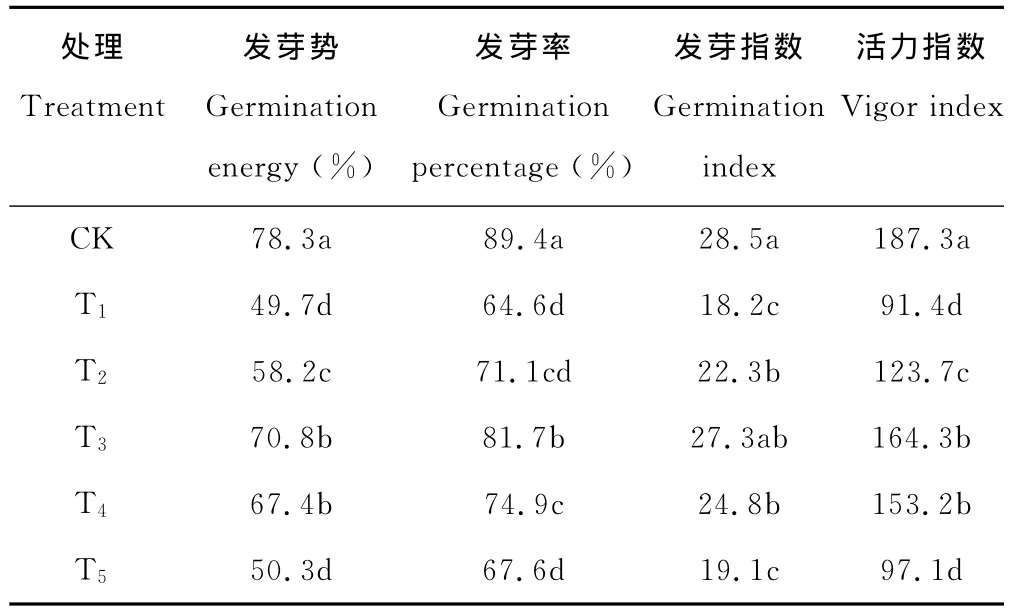
表2 SA对盐胁迫下百日草种子萌发的影响Table 2 Effects of salicylic acid on seed germination of Zinniaunder salt stress
2.2 外源SA对盐胁迫下百日草幼苗形态及叶绿素含量的影响
盐胁迫下,百日草幼苗生长受到显著抑制(表3)。T2~T4处理显著提高了幼苗株高、茎粗、根冠比(P<0.05),T5与T1无显著差异(P>0.05)。T2、T3、T4的植株高度较 T1依次升高了10.4%,14.5%,10.2%;茎粗依次增加了6.8%,11.0%,6.1%;根冠比依次增加了6.7%,15.3%,15.0%。综合3个指标,1.0mmol/L的SA处理对百日草盐胁迫下的幼苗生长缓解效果最好。
盐胁迫下,叶绿素a、叶绿素b、叶绿素a+b的含量比CK显著下降(P<0.05)(表3)。叶片叶绿素含量是反映植物光合能力的重要指标。T2~T4处理显著提高盐胁迫时叶绿素含量,其中,T3处理叶绿素a、叶绿素b、叶绿素a+b的含量增加最显著,对盐胁迫缓解效果最好,较T1依次增加17.6%,15.4%,17.6%。T2和T4处理对盐胁迫的缓解作用减弱,而T5处理叶绿素含量与盐胁迫组差异不显著(P>0.05),表明该浓度SA处理可能对百日草盐害缓解作用不明显。
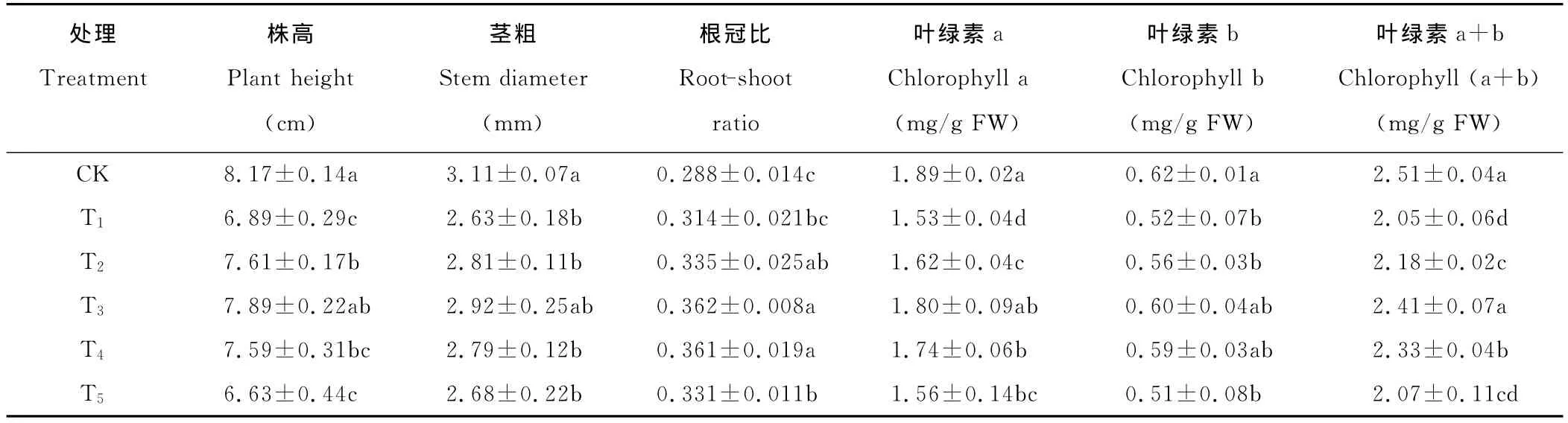
表3 SA对盐胁迫下百日草幼苗生长及叶绿素含量的影响Table 3 Effects of salicylic acid on growth and chlorophyll contents of Zinniaseedlings under salt stress
2.3 外源SA对盐胁迫下百日草幼苗MDA含量的影响
植物在逆境胁迫下,加强了膜脂过氧化作用,最终导致细胞膜系统损伤,MDA作为膜脂过氧化的产物,其含量反映膜损伤程度[2]。随着处理时间增加,T1与T2处理下百日草幼苗的MDA含量出现先升后降的变化趋势;T3和T4呈现先降后升的趋势;T5则一直缓慢升高(图1)。10d时T3下降到最低值,较T1低45.9%。T2较T3和T4下降缓慢。20d时T1升高到最大值,高出CK 46.8%,T4则下降到最小值,比T1低58.8%。30d时,T5与T1无显著差异(P>0.05)。表明,低浓度的SA处理随时间增加会表现出一定的缓解效应,浓度为1.0和1.5mmol/L的SA处理缓解效果最好,而SA浓度为2.0mmol/L时反而表现出一定的胁迫效应。
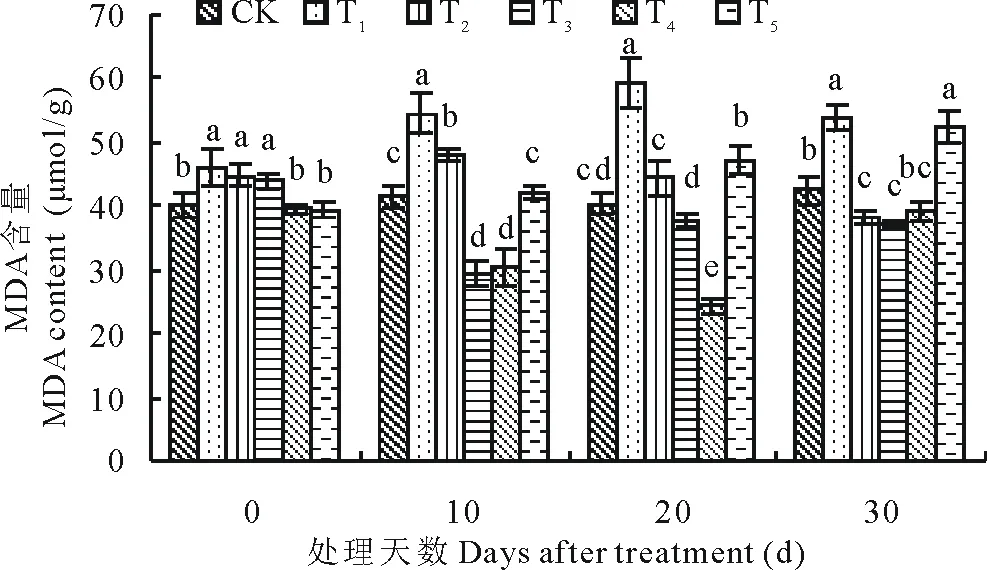
图1 SA对盐胁迫下百日草幼苗叶片MDA含量的影响Fig.1 Effects of exogenous SA on MDA content in the seeding leaves of Zinniaunder salt stress
2.4 外源SA对盐胁迫下百日草幼苗叶片抗氧化酶活性的影响
盐胁迫时,抗氧化酶系统的重要组成SOD和POD可有效清除自由基,从而避免植物因自由基积累造成的氧化损伤[32]。本研究中,SA对盐胁迫下百日草幼苗叶片SOD和POD活性存在显著影响。随处理时间增加,T1~T5的SOD和POD活性都大致表现出先升后降的变化趋势(图2)。处理10d时,仅T3的SOD活性显著升高(P<0.05),而T2~T5的POD活性均显著升高(P<0.05)。20d时,T1的SOD和POD活性均达最大值,分别比CK高27.9%和34.6%;此时,T2~T4的SOD活性上升最快,并达最大值,分别比T1高55.3%,77.8%和56.8%,比CK高98.6%,127.5%和100.6%;同时段,T2~T4的POD活性也达最大值,分别比T1高48.2%,53.3%和44.8%,比CK高99.4%,106.3%和94.9%。30d时,T5与T1的SOD和POD活性差异不显著(P>0.05)。结果表明,植物在盐胁迫初期,自身也会提高其SOD、POD活性以适应胁迫;适当浓度的SA处理可缓解盐胁迫的伤害,提高植物SOD及POD活性,且SA浓度为1.0mmol/L时缓解效果最佳;处理中,SOD和POD活性变化不同步,存在一定差异。
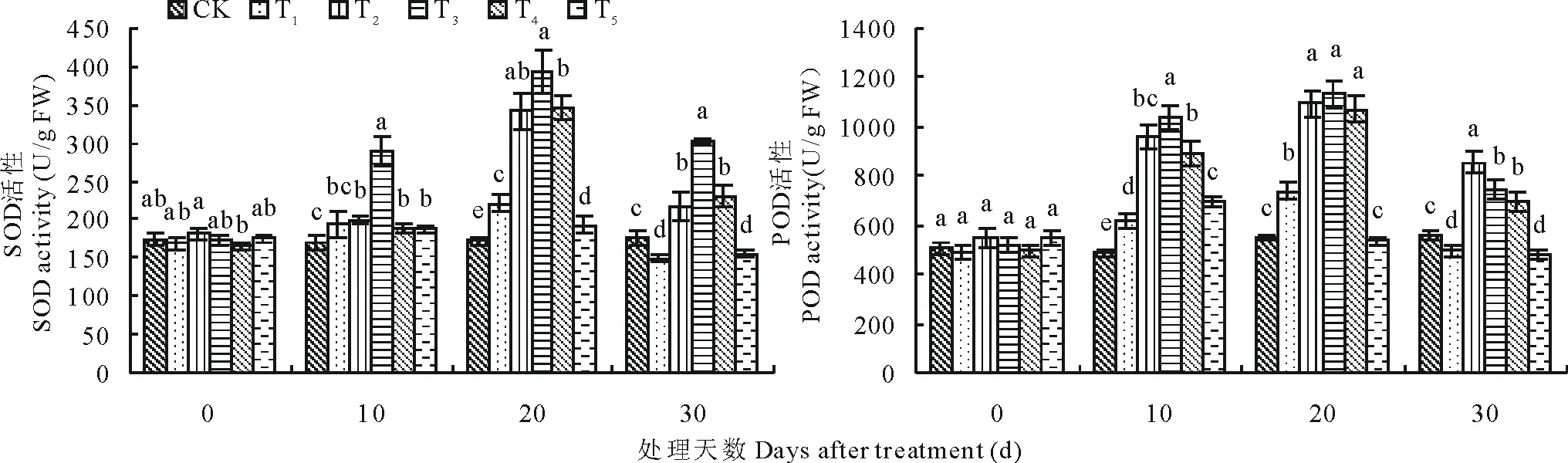
图2 SA对盐胁迫下百日草幼苗叶片SOD和POD活性的影响Fig.2 Effects of exogenous SA on the activities of SOD and POD in the seeding leaves of Zinniaunder salt stress
2.5 外源SA对盐胁迫下百日草幼苗叶片脯氨酸、可溶性糖、可溶性蛋白含量的影响
脯氨酸和可溶性糖是很多植物的主要渗透调节物质,可溶性蛋白是反映植物体内代谢强度的一个重要指标[33]。随处理时间增加,T1的脯氨酸、可溶性糖及可溶性蛋白含量均出现先升后降的趋势,T2~T5也有不同幅度的升高,且与对照差异显著(P<0.05)(图3)。
20d时,T1~T5脯氨酸含量均达最大值,分别比CK 高 出 33.5%,58.5%,108.5%,94.2% 和68.2%,T2~T5分别比 T1高出18.7%,56.2%,45.4%,26.0%,T3、T4显著高于其余处理(P<0.05);30d时,T3~T5之间无显著差异(P>0.05),而T1显著低于CK(P<0.05)。随处理时间增加,T2~T4可溶性糖含量持续升高,10d时,T1达最大值,比CK高26.3%;30d时T3和T4达最大值,且两者之间无显著差异(P>0.05),分别比T1高出1.93和2.11倍,比CK 高出1.34和1.51倍。20d时,T1~T5可溶性蛋白含量均达最大值,分别比CK高出44.2%,60.1%,72.1%,54.0%和45.6%,T1、T4、T5三者之间无显著差异(P>0.05),T2、T3分别比T1高出11.0%和19.3%。
结果表明,SA处理可通过调节脯氨酸、可溶性糖及可溶性蛋白含量来缓解盐害,但作用幅度存在一定差异。综合3个指标,SA浓度为1.0和1.5mmol/L时作用效果最为显著,而0.5和2.0mmol/L作用效果减弱。
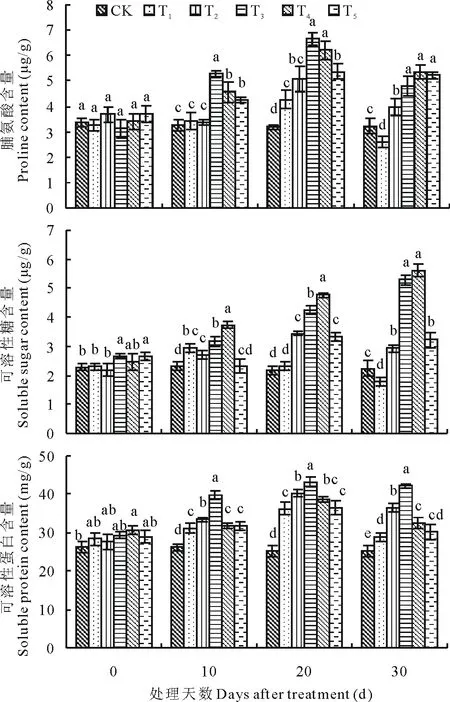
图3 SA处理对盐胁迫下百日草幼苗叶脯氨酸、可溶性糖、可溶性蛋白含量的影响Fig.3 Effects of exogenous SA on the contents of proline,soluble sugar and soluble protein in the seeding leaves of Zinniaunder salt stress
3 讨论
大量研究表明,盐胁迫对植物光合、蛋白合成及能量、脂类代谢等重要生命过程均产生影响[34]。本试验中,100mmol/L的NaCl处理使百日草种子萌发及幼苗生长受到严重抑制。SA是一种植物内源激素,作为信号分子对植物信号传导和抗逆反应起重要作用[12,35]。添加适当浓度的SA能显著促进百日草种子萌发、幼苗生长,并提高叶绿素含量、抗氧化酶活性及渗透调节物质含量,且以1.0mmol/L缓解效果最佳,2.0mmol/L对盐胁迫下百日草保护作用最弱或有时反而表现为抑制作用。
植物能否在盐碱地上生长取决于其在盐胁迫条件下能否萌发成苗。盐胁迫使种子发芽势、发芽率、发芽指数和活力指数均降低[8,32,36]。盐胁迫可通过渗透胁迫造成植物种子吸水进程减缓以及降低种子储藏物质的分解与转化、破坏膜结构来抑制种子的萌发[32]。而适当浓度的SA能增强植物的渗透调节能力,提高组织含水量从而促进盐胁迫下种子的萌发[37]。本研究中,百日草种子在盐胁迫下发芽势、发芽率、发芽指数和活力指数均显著降低;较低浓度(0.5~1.5mmol/L)SA处理能显著提高盐胁迫下百日草种子发芽势、发芽率、发芽指数和活力指数,且以1.0mmol/L缓解效果最佳;较高浓度(2.0mmol/L)SA则基本不表现促进作用。与王玉萍等[8]对花椰菜(Brassicaoleraceavar.botrytis)的研究结果基本一致,但与孙丽娜等[26]对黄瓜(Cucumissativus)和朱伟等[15]对棉花的结论有一定差异,主要表现在SA最佳浓度有所不同,这可能是由于不同的植物材料对SA的浓度效应有不同的响应机制。
叶绿素是植物主要的光合色素,对光能的吸收、传递和转化发挥着重要作用[38]。本试验中,100mmol/L的盐胁迫使百日草幼苗叶绿素含量显著降低,光合反应受阻,生长迟缓。0.5~1.5mmol/L的SA处理明显提高了盐胁迫下百日草幼苗的叶绿素含量、株高、茎粗及根冠比。表明适当浓度SA处理能够促进百日草幼苗叶绿素的生物合成,保护植物组织的光合作用[39-40],从而减轻盐胁迫的毒害,维持正常生长发育。
盐胁迫对细胞的膜脂和膜蛋白产生直接影响,使膜脂过氧化,导致膜的完整性被破坏[41]。MDA是膜脂过氧化产物之一,其含量高低反映细胞膜脂过氧化程度[8,42]。SOD和POD是植物体内2种重要的抗氧化酶,在逆境胁迫中清除过量的活性氧,缓解膜脂过氧化伤害,维持了细胞质膜的完整性和稳定性,从而在一定程度上提高了植物对逆境的适应能力[32]。本研究中,百日草幼苗在100mmol/L盐胁迫下,MDA含量及SOD、POD活性均有所提高,可能是植物在逆境中的应激反应;低浓度SA处理显著抑制了MDA积累,且以1.0mmol/L效果最佳,与辣椒(Capsicumannuum)[43]、苜蓿(Medicagosativa)[44]等作物的研究结果大致相似。
盐胁迫下,外界渗透势降低,为避免细胞大量失水,植物体内会产生渗透调节物质,以保证植物正常的水分供应[32]。脯氨酸和可溶性糖是2种重要的渗透调节物质,使水分的跨膜运输朝着有利于植物生长的方向发展。植物内的可溶性蛋白大多是参与代谢的酶类,其含量高低反映植物代谢强度[41],同时,可溶性蛋白具较强的亲水性,可提高细胞保水性能,有效防止其脱水[33]。本研究中,低浓度SA处理后,百日草幼苗体内脯氨酸、可溶性糖和可溶性蛋白含量较盐胁迫组明显升高,表明SA不仅能通过渗透调节缓解盐胁迫对百日草带来的伤害,还能通过提高盐胁迫下百日草幼苗的代谢活力,增强百日草对盐胁迫的抵抗力。
综上所述,SA处理有效减轻了盐胁迫对百日草种子萌发的危害,并通过促进百日草叶片叶绿素合成,保护其光合作用,维持了植物的正常生长;同时,还通过提高SOD、POD活性及脯氨酸、可溶性糖和可溶性蛋白的含量,增强了百日草幼苗的抗氧化及抗渗透胁迫能力,从而一定程度上缓解了盐胁迫带来的伤害;SA处理存在一定的浓度效应,以1.0mmol/L缓解百日草盐胁迫伤害效果最好。因此,盐碱地区种植百日草,可用1.0mmol/L的SA预先浸泡百日草种子,待其长出幼苗后,再以同样浓度SA喷施叶面,能显著降低盐毒害,促进百日草幼苗生长。
[1]Yang S H,Ji J,Wang G,etal.Effects of salt stress on plants.Molecular Plant Breeding,2006,4(3):139-142.
[2]Li Y,Zhang Y P,Sun M,etal.Research advance in the effects of salt stress on plant and the mechanism of plant resistance.Chinese Agricultural Science Bulletin,2008,24(1):258-265.
[3]Zhang F Y,Chen C Y,Hu Z H,etal.Effect of exogenous salicylic acid on seed germination and seedling physiological characteristics of kidney bean(PhaseolusvulgarisL.)under salt stress.Journal of Northeast Agricultural University,2013,44(10):39-43.
[4]Tester M,Davenport R.Na+tolerance and Na+transport in higher plants.Annals of Botany,2003,91(5):503-527.
[5]Mittler R.Oxidative stress,antioxidants and stress tolerance.Trends in Plant Science,2002,9:405-410.
[6]Zhang Z G,Shang M Q.Regulation of salicylic acid and chitosan on photosynthetic parameters of cucumber leaves under salt stress.Acta Agriculturae Boreali-occidentalis Sinica,2010,19(3):174-178.
[7]Flowers T J.Salinisation and borticultural production.Scientia Horticulturae,1999,78:1-4.
[8]Wang Y P,Dong W,Zhang X,etal.Effects of salicylic acid on seed germination and physiological characters of cauliflower seedling under stress.Acta Prataculturae Sinica,2012,21(1):213-219.
[9]Yin L L,Hou X J.The recent advances of salicylic acid as signal molecules of resistance in plant.Chinese Agricultural Science Bulletin,2007,23(1):338-342.
[10]A’gnes S,Jola’n C,Katalin G,etal.Salicylic acid improves ac-climation to salt stress by stimulating abscisic aldehyde oxidase activity and abscisic acid accumulation,and increases Na+content in leaves without toxicity symptoms inSolanumlycopersicumL.Journal of Plant Physiology,2009,166(9):914-925.
[11]Yu S W,Tang Z C.Plant Physiology and Molecular Biology[M].Beijing:Science Press,1998.
[12]Meng X J,Di K,Ding G H.Progress of study on the physiological role of salicylic acid in plant.Chinese Agricultural Science Bulletin,2010,26(15):207-214.
[13]Zhang S G,Gao J Y,Song J Z.Mitigative effects of salicylic acid and aspirin on salt stress-induced injuries in wheat(TriticumaestivumL.)during the stage of seedling growth.Acta Botanic Boreali-Occidentalia Sinica,1998,18(4):549-554.
[14]Ma J K,Yuan Y Z,Ou J Q,etal.Relieving effect of exogenous salicylic acid on rice(OryzasativaL.)seedling roots under NaCl stress.Journal of Wuhan University,2006,52(4):471-474.
[15]Zhu W,Yuan C,Ma Z B,etal.Effect of exogenous salicylic acid on seed germination and seedling growth of cotton under salt stress.Acta Agriculturae Jiangxi,2009,21(10):17-19.
[16]Zhang A H,Zhu S L.Effect of exogenous salicylic acid on growth and antioxidant enzyme activities of loofah seedlings under salt stress.Acta Agriculturae Jiangxi,2013,25(10):27-19.
[17]Zhang L Q.The effects of SA on the physiological index of tomato seedlings.Northern Horticulture,2011,(21):36-38.
[18]Chen Y,Xu C P,Wang N Y,etal.Effect of salicylic acid on oxidation resistance of‘Nanlin 895’poplar plantletsinvitrounder salt stress.Journal of Nanjing Forestry University(Natural Science Edition),2012,36(6):17-22.
[19]Zhang Y Y,Liu W,Xuan Y N,etal.Effect of salicylic acid mitigating under salt stress on active oxygen metabolism and membrane stability inNitratiatangutorum.Journal of Northeast Forestry University,2013,41(12):56-59.
[20]Li J N,Liu Q,Li S.Effect of salicylic acid on antioxidant enzyme activities and photochemical efficiency ofAmmopiptanthus mongolicusseedlings under salt stress.Journal of South China Agricultural University,2010,31(1):42-46.
[21]Ye Y S,Zhang J W,Qi Y C,etal.Studies on stigma receptivity and pollen viability ofZinniaelegans.Scientia Agricultura Sinica,2007,40(10):2376-2381.
[22]Li J,Wang T,Zhang X X.Short communication about male sterile hybridization breeding inZinniaelegans.Chinese Agricultural Science Bulletin,2011,27(10):133-138.
[23]Ye Y S,Chen T H,Hu Q S,etal.Production and their cytological observations of the male sterile lines ofZinniaelegans.Scientia Agricultura Sinica,2008,41(5):1436-1443.
[24]Zhang Z L,Wang J G,Sheng Y,etal.Gene expression difference between chitinase gene induced byStreptomycesgongzhulingensis769andAlternariazinniaeinZinniaelegans.China Plant Protection,2013,33(9):5-9.
[25]Wang H,Xu S,Chen W,etal.Response of two turfgrass species seed germination and seedling growth to phenanthrene stress.Chinese Journal of Ecology,2011,30(8):1627-1631.
[26]Sun L L,Qu M,Ren G T,etal.Effect of salicylic acid on salt stress on cucumber seed germination and seedling growth.Journal of Northeast Agricultural University,2006,37(4):449-453.
[27]Wang X K.Principle and Technology of Plant Physiological Biochemical Experiment[M].Beijing:Higher Education Press,2000.
[28]Hao Z B,Cang J,Xu Z.Plant Physiology Experiment[M].Harbin:Harbin Institute of Technology Press,2004.
[29]Xiong Q E.Experimental Course of Plant Physiology[M].Chengdu:Science and Technology Press,2003.
[30]Lu W J.Experimental Course of Plant Physiology[M].Beijing:China Forestry Publishing House,2012.
[31]Chen J X,Wang X F.Experimental Guidance of Plant Physiology[M].Guangzhou:South China University of Technology Press,2002.
[32]Wang D M,Jia A,Cui J Z.Advances in research on effects of salt stress on plant and adaptive mechanism of the plant to salinity.Chinese Agricultural Science Bulletin,2009,25(4):124-128.
[33]Wang F,Chang P P,Chen Y P,etal.Effect of exogenous nitric oxide on seedling growth and physiological characteristics of maize seedlings under cadmium stress.Acta Prataculturae Sinica,2013,22(2):178-186.
[34]Yang S H,Ji J,Wang G.Effects of salt stress on plants and the mechanism of salt tolerance.World Science Technology R&D,2006,28(4):70-76.
[35]Chen Z,Silva H,Klessig D F.Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid.Science,1993,262:1883-1886.
[36]Meng Y X,Wang S H,Wang J C,etal.Influence of CoCl2on the growth and seedling physiological indexes ofHordeum vulgareunder NaCl stress.Acta Prataculturae Sinica,2014,23(3):160-166.
[37]Zhang S G,Gao J Y,Song J Z.Mitigative effects of salicylic acid and aspirin on salt stress-induced injuries in wheat(TriticumaestivumL.).Acta Phytophysiological Sinica,1999,25(2):159-164.
[38]Huang Z R,Long X H,Liu Z P,etal.Effects of KNO3on the growth and photosynthetic capacity of two varieties ofHelianthustuberosusseedlings under NaCl stress.Acta Prataculturae Sinica,2011,20(1):82-88.
[39]Zhao W F,Yang Y Z,Yang W X,etal.Salicylic acid and the resistance of plant.Acta Agriculturae Shanghai,2007,23(2):108-113.
[40]Wang L H,Liang S R,Lv S M,etal.Relationship of exogenous salicylic acid and abiotic stress resistance and its mechanism of action.Journal of Henan Agricultural Sciences,2010,8:160-164.
[41]Moran J F,Becana M,Iturbe-Ormaetxe I,etal.Drought induces oxidative stress in pea plants.Planta,1994,94:346-352.
[42]Zhao X J,Han Y N,Cai L.Advances in research on physiological and biochemical effects of NaCl stress on plant.Hubei Agricultural Sciences,2011,50(19):3897-3899.
[43]Zeng C L,Chen C Y.Physiological effect of exogenous salicylic acid on decreasing salt damage to pepper seedlings.Journal of Northeast Agricultural University,2010,41(11):32-36.
[44]Zhou W E,Shi S L,Kou J T.Exogenous salicylic acid on alleviating salt stress in alfalfa seedlings.Acta Prataculturae Sinica,2012,21(3):171-176.
参考文献:
[1]杨少辉,季静,王罡,等.盐胁迫对植物影响的研究进展.分子植物育种,2006,4(3):139-142.
[2]李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展.中国农学通报,2008,24(1):258-265.
[3]张凤银,陈禅友,胡志辉,等.外源水杨酸对盐胁迫下菜豆种子萌发和幼苗生理特性的影响.东北农业大学学报,2013,44(10):39-43.
[6]张志刚,尚茂庆.水杨酸、壳聚糖对盐胁迫下黄瓜叶片光合参数的调节作用.西北农业学报,2010,19(3):174-178.
[8]王玉萍,董雯,张鑫,等.水杨酸对盐胁迫下花椰菜种子的萌发及幼苗生理特性的影响.草业学报,2012,21(1):213-219.
[9]尹玲莉,侯晓杰.植物抗性信号分子——水杨酸研究进展.中国农学通报,2007,23(1):338-342.
[11]余叔文,汤章城.植物生理与分子生物学[M].北京:科学出版社,1998.
[12]孟雪娇,邸昆,丁国华.水杨酸在植物体内的生理作用研究进展.中国农学通报,2010,26(15):207-214.
[13]张士功,高吉寅,宋景芝.水杨酸和阿斯匹林对小麦幼苗生长过程中盐害的缓解作用.西北植物学报,1998,18(4):549-554.
[14]马敬坤,袁永泽,欧吉权,等.外源水杨酸对水稻(OryzasativaL.)幼苗根的NaCl胁迫缓解效应.武汉大学学报,2006,52(4):471-474.
[15]朱伟,袁超,马宗斌,等.水杨酸对盐胁迫下棉花种子萌发和幼苗生长的影响.江西农业学报,2009,21(10):17-19.
[16]张爱慧,朱士龙.外源水杨酸对盐胁迫下丝瓜幼苗生长和抗氧化酶活性的影响.江西农业学报,2013,25(10):27-19.
[17]张林青.水杨酸对盐胁迫下番茄幼苗生理指标的影响.北方园艺,2011,(21):36-38.
[18]陈颖,徐彩平,汪南阳,等.盐胁迫下水杨酸对南林895杨组培苗抗氧化系统的影响.南京林业大学学报(自然科学版),2012,36(6):17-22.
[19]张艳艳,刘威,宣亚楠,等.水杨酸对盐胁迫下唐古特白刺活性氧代谢和细胞膜透性抑制的缓解效应.东北林业大学学报,2013,41(12):56-59.
[20]李靖男,刘强,李升.水杨酸对盐胁迫下沙冬青幼苗抗氧化酶活性及PSII光化学效率的影响.华南农业大学学报,2010,31(1):42-46.
[21]叶要姝,张俊卫,齐迎春,等.百日草柱头可授性和花粉生活力的研究.中国农业科学,2007,40(10):2376-2381.
[22]李俊,王涛,张西西.百日草雄性不育杂交育种初探.中国农学通报,2011,27(10):133-138.
[23]叶要姝,陈天花,胡秋实,等.百日草雄性不育系的获得及细胞学观察.中国农业科学,2008,41(5):1436-1443.
[24]张振鲁,王金刚,盛岩,等.链霉菌769与百日草黑斑病病菌诱导百日草几丁质酶基因的表达差异.中国植保导刊,2013,33(9):5-9.
[25]王慧,徐胜,陈玮,等.土壤菲污染对两种草坪草种子萌发及其幼苗生长的影响.生态学杂志,2011,30(8):1627-1631.
[26]孙丽娜,曲敏,任广涛,等.水杨酸对盐胁迫下黄瓜种子萌发和幼苗生长发育的影响.东北农业大学学报,2006,37(4):449-453.
[27]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[28]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[29]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社,2003.
[30]路文静.植物生理学实验教程[M].北京:中国林业出版社,2012.
[31]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[32]王东明,贾嫒,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展.中国农学通报,2009,25(4):124-128.
[33]王芳,常盼盼,陈永平,等.外源NO对镉胁迫下玉米幼苗生长和生理特性的影响.草业学报,2013,22(2):178-186.
[34]杨少辉,季静,王罡.盐胁迫对植物的影响及植物的抗盐机理.世界科技研究与发展,2006,28(4):70-76.
[36]孟亚雄,王世红,汪军成,等.CoCl2对NaCl胁迫下大麦生长及幼苗生理指标的影响.草业学报,2014,23(3):160-166.
[37]张士功,高吉寅,宋景芝.水杨酸和阿斯匹林对小麦盐害的缓解作用.植物生理学报,1999,25(2):159-164.
[38]黄增荣,隆小华,刘兆普,等.KNO3对NaCl胁迫下两菊芋品种幼苗生长及光合能力的影响.草业学报,2011,20(1):82-88.
[39]赵维峰,杨玉芝,杨文秀,等.水杨酸与植物的抗性.上海农业学报,2007,23(2):108-113.
[40]王林华,梁书荣,吕淑敏,等.外源水杨酸与植物非生物胁迫抗性的关系及其作用机制.河南农业科学,2010,8:160-164.
[42]赵秀娟,韩雅楠,蔡禄.盐胁迫对植物生理生化特性的影响.湖北农业科学,2011,50(19):3897-3899.
[43]曾长立,陈禅友.外源水杨酸降低辣椒幼苗盐害的生理效应.东北农业大学学报,2010,41(11):32-36.
[44]周万恩,师尚礼,寇江涛.外源水杨酸对苜蓿幼苗盐胁迫的缓解效应.草业学报,2012,21(3):171-176.

