可生物降解镁合金血管支架管坯的材料制备及成形研究进展
汪力骁,方刚
(清华大学机械工程系,北京 100084)
近年来,心血管疾病已经成为人类健康的头号杀手,预计到2030年死于心血管疾病的人数将增加至2330万[1]。其中,绝大部分的心血管疾病包括冠心病、脑血管疾病等,起因主要是由于血管内部脂肪堆积引起的堵塞,导致血液不能及时流入心脏或大脑,威胁人体的生命安全。血管支架通过膨胀作用支撑起堵塞的血管,产生的塑性变形使得其能够保持血管的通畅,效果显著且安全副作用小,是心血管疾病治疗的第一选择[2]。
由于血管支架需要植入体内,在复杂的体液环境中服役,因此其材料选择至关重要。目前应用的血管支架材料有高分子材料和金属材料两种,其中金属材料包括Ni-Ti合金,316L(SS316L)医用不锈钢以及Co-Cr合金等[3]。这些传统的医用金属材料强度高、机械性能好,且研究表明不锈钢等释放的Fe离子能够有效抑制血管再狭窄的发生[4]。不过,这些合金的耐腐蚀性能优良,不易在体液环境中降解,会永久留在人体内。血管支架永久植入人体内不仅增加产生并发炎症及血栓的几率[5—6],而且一旦发生血管再狭窄(比例为25% ~40%[7]),进一步治疗将非常困难。此外,对于有着先天性心血管疾病的儿童来说,他们的身体随着年龄的增长不断发育,体内器官也随之变化,固定尺寸的传统血管支架显然不能满足长期服役要求[8]。
对于可降解的镁合金血管支架来说,其兼具高分子材料的可降解性以及金属材料的强度。在有限的服役期内血管支架通过塑性变形支撑被堵塞的血管,保障血液的正常流动,在病变血管组织形成新的血管壁之后,植入的镁合金支架通过体液的腐蚀作用逐渐均匀降解,最后完全降解并被人体吸收,大大降低了在植入处发生血栓及并发炎症等病变的可能性。一方面,镁是人体所需的重要元素之一,对人体内蛋白质合成及肌肉的收缩有重要影响[9];另一方面,人体能够通过肾脏对血浆中的镁元素含量进行及时调节,通过尿液等排出多余的镁离子[10],因此支架的降解对人体的毒性很低。此外,镁合金质轻且拥有高的比强度和比刚度,弹性模量约为45 GPa,不到钛合金弹性模量的1/2,在植入过程中产生的应力遮挡较小[11—12]。
自2000年以来,镁合金血管支架已经在动物[13—15]以及人体内[16—18]成功进行过多次植入试验。Heublein[15]在家猪冠状动脉内植入的AE21镁合金支架经过56 d后机械性能完整消失;Waksman[14]使用WE43镁合金血管支架在家猪及小种猪的冠状动脉中进行了植入试验,支架最长服役时间达到了3个月且未出现中毒情况。在动物身上的试验表明镁合金血管支架的应用有着良好的前景。
镁合金血管支架的制造过程主要包括微细管坯的制造以及管网状支架的切割及化学抛光,常见的细分步骤如图1所示。由于镁属于密排六方结构,在室温下只有有限的基面滑移系开启,较低的塑性使得镁合金加工成血管支架所需的微细管十分困难。除了微细管材加工的困难外,镁合金支架在人体血液环境中过快的腐蚀速率也阻碍着其大规模的临床应用。在实际应用中,为保证血管在植入血管支架期间能够自行修复,需保证血管支架能够保持完整机械性能达6~12个月[3],然而目前大部分实验用镁合金血管支架在植入后3个月内完全降解,无法达到标准。另外一个棘手的问题是腐蚀的不均匀性。优良的可降解血管支架要求在血液中逐渐均匀地降解,使得其机械性能保持相对完整,而局部过快的腐蚀则会使该处成为支架的薄弱点,最先失效使得支架的服役时间大幅减少。文中针对镁合金血管支架在临床应用中的主要问题,就其微细管坯的制造工艺以及控制镁合金腐蚀速率方面的研究现状及进展进行讨论,对镁合金血管支架的应用未来进行展望。
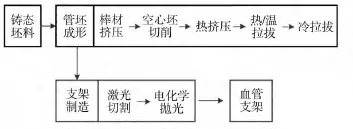
图1 镁合金血管支架的制造步骤Fig.1 Schematic fabrication procedures of the magnesium alloys'vascular stents
1 镁合金微细管材加工进展
镁合金血管支架通过对极细小的微细管进行激光切割,得到管网状结构,以利于其弯曲和膨胀变形。在实际应用中,这些镁合金微细管材不仅需要满足一定的机械性能要求,而且在尺寸上需要达到直径在2.5~4.0 mm,壁厚在0.1~0.2 mm之间[19—20]。由于镁合金室温塑性很低,传统的加工方法一般是通过在再结晶温度之上对镁合金进行热挤压,得到尺寸较小的微细管,然后再通过室温下拉拔的方式进一步缩小管坯的尺寸,并改善热挤压得到的微细管壁厚的不均匀性[21]。为了克服镁合金塑性差的缺陷,加工得到如此细小的镁合金管材,相关的研究者通过超大塑性变形(Severe Plastic deformation)、材料特殊处理、改进工艺参数[22]、提出新型加工工艺等方法,做了许多有益的尝试,部分研究进展见表1。这些尝试根据解决问题的目的不同,主要可以分为“材料改性”及“尺寸优化”两大类,其中“材料改性”主要是通过工艺的探索改善最终管材的力学性能,而“尺寸优化”则是指通过加工工艺的优化,使得管材更细更薄,符合实际使用的标准。
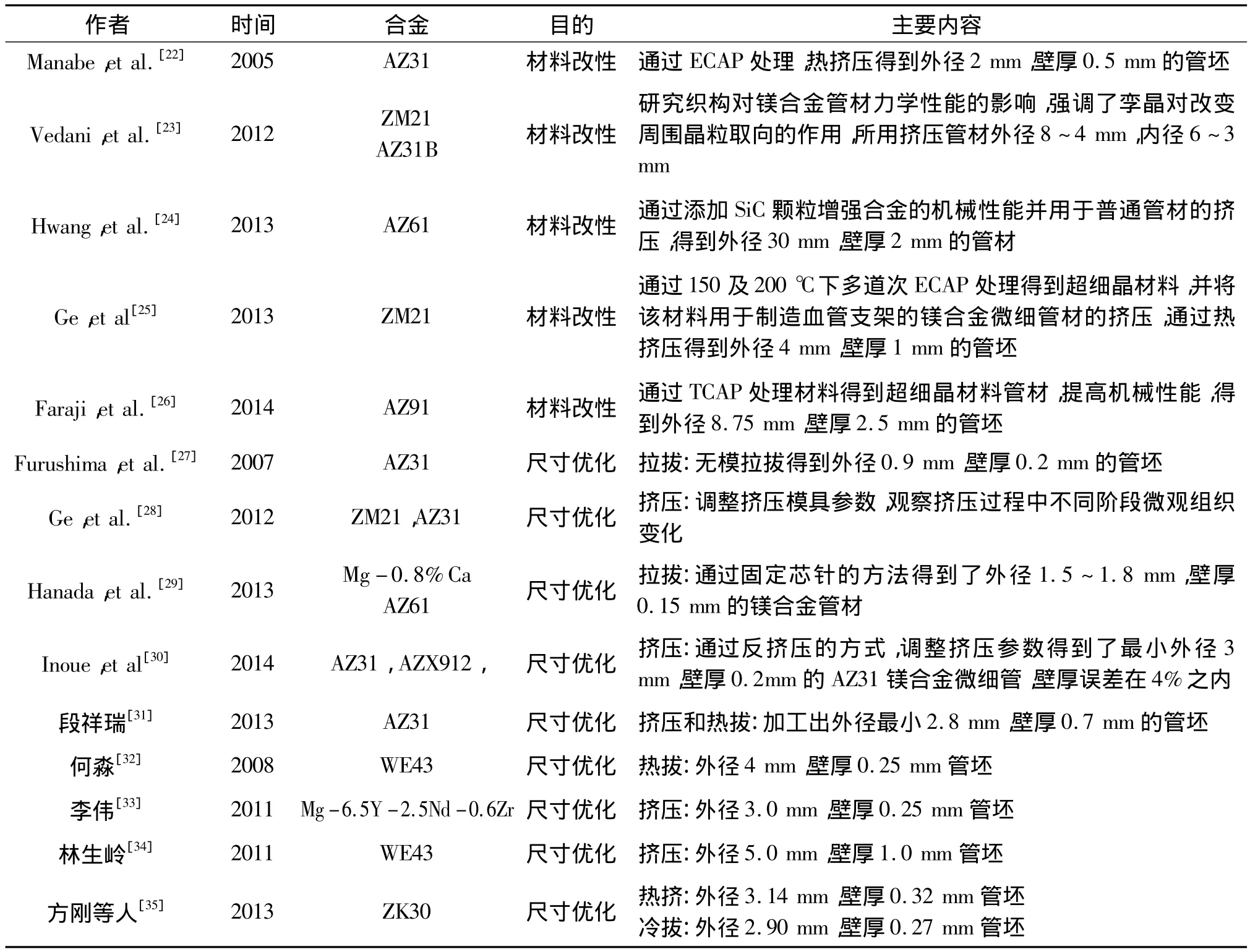
表1 近年来镁合金微细管材加工的研究进展Table 1 Collection of recent researches about microtube fabrication of magnesium alloys
1.1 材料改性
“材料改性”主要是通过塑性成形细化镁合金坯料的晶粒,提高其塑性成形能力,甚至达到超塑性,从而使得最终加工得到的管材力学性能得到优化,满足血管支架的使用标准。同时,根据Hall-Petch准则,细小的晶粒还能够提高镁合金的强度及刚度。
为了减小镁合金组织的晶粒,改善材料的性质,一些研究尝试通过超大塑性变形得到超细晶(ultrafine-grained,UFG)用于管材制造,取得了一些效果。超大塑性变形不仅能够提高材料的屈服强度,其致密的晶粒结构还能降低材料的腐蚀速率[36]。Ge等人[25]利用多道次高温等径角挤压(Equal Channel Angular Pressing,ECAP)的方法,在200℃及150℃的加工温度下,使得粗大的铸态ZM21镁合金组织通过大塑性变形的方式,变为了平均晶粒大小仅为0.52 μm的超细晶组织(在150℃下经过八道次等径角挤压),如图2a[25]。经过等径角挤压过后,材料的屈服强度由铸态的180 MPa提高到340 MPa。用该超细晶合金在150℃下挤压得到的细管材的晶粒尺寸保持在亚微米级别,且硬度从50 HV提高到了74.8 HV,有大幅提升。日本的Faraji等人[26]通过在200℃下进行多道次的沿径角管材挤压(Tubular Channel Angular Pressing,TCAP)的方法对初始铸态AZ91镁合金管坯进行热挤压,得到了平均晶粒尺寸仅为约500 nm的超细晶镁合金管,并且其管材的硬度也得到了50%左右的提升。不过通过剧烈塑性变形得到的超细晶坯料组织在经过高温挤压之后,细小的晶粒长大也十分明显,因此相对来说,直接对管材进行剧烈塑性变形的沿径角管材挤压加工方法更适合于优化管材微观组织,细化晶粒度从而改善其力学性能,如图2b[26]。从改善材料性能的角度,Hwang等人[24]通过在AZ61合金中添加SiC颗粒,研究其力学性能的变化,验证了通过添加SiC颗粒来增强合金性能用于管材挤压的可行性,其最终挤压得到的管材的平均晶粒尺寸在4 μm 左右。Grogan 等人[37]及 Vedani等人[23]的研究指出,镁合金材料的织构对最后的血管支架的力学性能同样有着十分重要的影响。从以上的研究可以看出,血管支架的微细管坯加工历史对其支架的使用性能具有重要的影响。
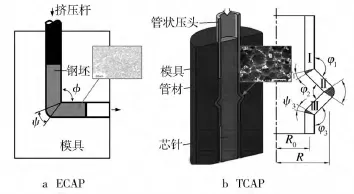
图2 提高镁合金的塑性及力学性能的超大塑性变形的示意图及晶粒形貌Fig.2 Schematic of severe deformation methods and their corresponding microstructures
1.2 尺寸优化
“尺寸优化”是通过对镁合金塑性加工过程中的具体工艺进行改进,使得其在塑性变形时的变形抗力能够尽可能小,从而制造尺寸更小的微细管材。局部的加热变形及优化,现有加工方式均可达到要求。
对于传统的热挤压及室温拉拔的加工工序,研究主要集中在单一细节的改善上。Hanada[38]等人研究了不同润滑剂包括机油、石墨粉、矿物油、二硫化钼以及水基润滑剂等对镁合金管材室温拉拔的影响,结果表明机油及石墨粉的润滑效果最好,可以有效降低拉拔力且得到的拉拔管材的表面粗糙度仅有0.24 μm。他们通过比较不同拉拔速率下的实验结果,得到了增大拉拔速度能够增加管材截面积的减小率的结论。方刚等人[35]采用浮动芯针拉拔的方法,通过多道次室温拉拔成功加工得到了外径为2.9 mm,壁厚为0.27 mm的镁合金ZK30管材。
微细管材的制造不仅对于模具精度的要求较高,其尺寸细小的薄壁还增加了拉拔过程中拉裂的可能性。针对微细管材难以加工的问题,日本的Furushima[27]采用了无模拉拔的加工方式实现了镁合金和锌合金微细管的成形。其具体的原理及加工示意图如图3所示[27,38],通过在管材局部感应加热的方式改变材料的流动应力,并在管材两端施加载荷,使得局部流动应力减小的区域出现颈缩,然后沿着管材轴向移动加热源,调整拉拔速度与加热源移动的速度,使得管材尺寸的减小均匀扩散到整个微细管中。经过3个道次的无模拉拔,最终加工得到了内外径分别仅有0.5 mm及0.9 mm的AZ31镁合金的极细管。其加工的理论依据为高温下合金的流动应力远低于低温下的流动应力,在变形时首先在高温部分发生局部颈缩实现尺寸的减小。无模拉拔的方法使得AZ31镁合金管材的尺寸达到了微米量级,这对于拉拔的初始几个道次大幅减小外径非常有效。

图3 无模拉拔的实验装置示意图Fig.3 Schematic of dieless drawing process
目前大多数实验研究中的镁合金微细管材成形尺寸还没有达到血管支架的要求,尤其是壁厚及其均匀性、管材的平直度等,都是今后研究中需要重点突破的地方。为了同时满足材料性能(微观组织)及管材尺寸两方面的要求,在实际的生产加工中,往往需要同时从2种解决思路考虑,在改善材料性能的同时采用成形能力更好的加工方式,得到细小的微细管坯。
2 镁合金血管支架腐蚀行为的研究进展
镁合金血管支架无法大规模临床应用的另一个主要难点就是其腐蚀速率的不可控性。镁合金过快的降解会使支架自行发生坍塌,不仅不能起到支撑血管的作用,还会堵塞血管,造成严重的后果[39]。如图4所示为镁及其合金在模拟体液中腐蚀速率的曲线,镁合金在腐蚀过程中产生的氢气还会阻碍血管壁的生长,影响支架的使用性能。如何提高作为生物可降解材料的镁合金的耐腐蚀性,使其降解速率可控并达到血管支架服役的标准,一直是研究者们关注的热点问题。
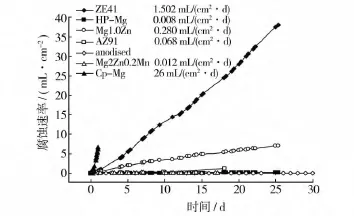
图4 镁合金在模拟体液中的腐蚀速率[11]Fig.4 Hydrogen evolution and their average rates of various magnesium alloy specimens
常见的提高合金耐腐蚀性的途径主要有:添加合金元素;表面改性。添加合金元素是为了延缓合金在血液环境中的腐蚀速率。Song[11]研究了一系列含有Ca,Zn,Mn等元素的添加镁合金对于其腐蚀行为的影响,得出了只有Ca,Zn,Mn以及少量的稀土元素既能抑制镁合金的腐蚀,又对人体无较大的毒副作用。稀土元素(例如Y,Nd等)的添加对镁合金耐腐蚀性能的提升也得到了很多研究的验证[39—41]。
进行支架表面改性则是为了延缓腐蚀的发生,保护基体合金。常见的表面改性方法有碱热处理[42—43]、酸化处理[44]、微弧氧化处理[45—36]、阳极氧化处理[11]、激光喷丸处理[47]、激光熔覆[48]、脉冲电解沉积处理[49]、物理气相沉积处理[50]、离子植入处理[51]以及聚合物表面涂层[52—54],各研究对应的处理方法及取得的效果如表2所示。其中尤以可降解的聚合物涂层涂覆处理最优[55]。Wang等人[53]在MgZnMn镁合金表层涂覆了一层可降解的聚合物涂层PTMC,并进行体内及体外的腐蚀实验。结果表明,PTMC涂层能够很好保护镁合金基底,且该涂层的降解模式为分层均匀降解,延长涂层保护的时间,并且涂层的腐蚀产物对基体镁合金的腐蚀也有着抑制作用。
另外,支架的具体网状结构对其腐蚀效果也有着重要的影响。血管支架的腐蚀行为往往在应力集中的地方最为严重,因此优化血管支架的网状结构,在其发生塑性变形并撑开血管壁时尽量减小连接处的应力值也十分重要。由于要研究血管支架在受到塑性变形时的受力状态,许多学者通过运用有限元方法分析血管支架的腐蚀行为,并对此作出优化。
Wu等人[56]通过引入材料连续损伤模型(Continue Damage Model),结合材料的本构模型以及支架的几何模型,模拟了3种不同网状支架设计的血管支架的展开过程及腐蚀过程,比较了3种支架在展开时的应力状态以及服役时间的长短。结果表明,并非血管支架材料越多,支架服役状况就更良好,这与支架的实际设计形式密切相关。他们用2种不同结构的血管支架进行腐蚀实验,得到了与数值模拟相符的结果,表明数值模拟方法是一种简单有效的验证支架设计合理与否的方法。Grogan等人[37]通过结合有限元方法和晶体塑性方法,研究了在血管支架膨胀过程中壁厚尺度上的晶粒数目以及镁合金的织构对于支架失效可能性以及承载能力的影响。模拟结果表明,血管支架壁厚尺度上的晶粒数目对于支架性能的影响不大,而在镁合金微细管挤压过程中引入的织构对其塑性行为有着很大的影响。Grogan[57]还建立了一个3D的纯镁血管支架的物理腐蚀模型,假设其腐蚀速率与周围溶液中的Mg+的浓度相关,通过Abaqus软件的迭代算法计算了支架的质量损失速率。虽然该模型有许多简化,无法预测支架在连接处的断裂,但其从物理模型的角度,为镁合金支架的腐蚀行为的研究提供了一个新鲜的视角。
Schiavone[58]等人建立了不同样式的血管支架模型,并计算得到不同样式的支架在膨胀过程中的受力情况以及对血管管壁的影响。结果表明,血管支架单元的设计对其实际作用效果有着非常重要的影响,在相同的外部压力下,开放式的支架单元设计有着更大的膨胀直径,但同时其腐蚀后的收缩率也更大,最容易产生腐蚀的支架部位是各单元结构的连接处。
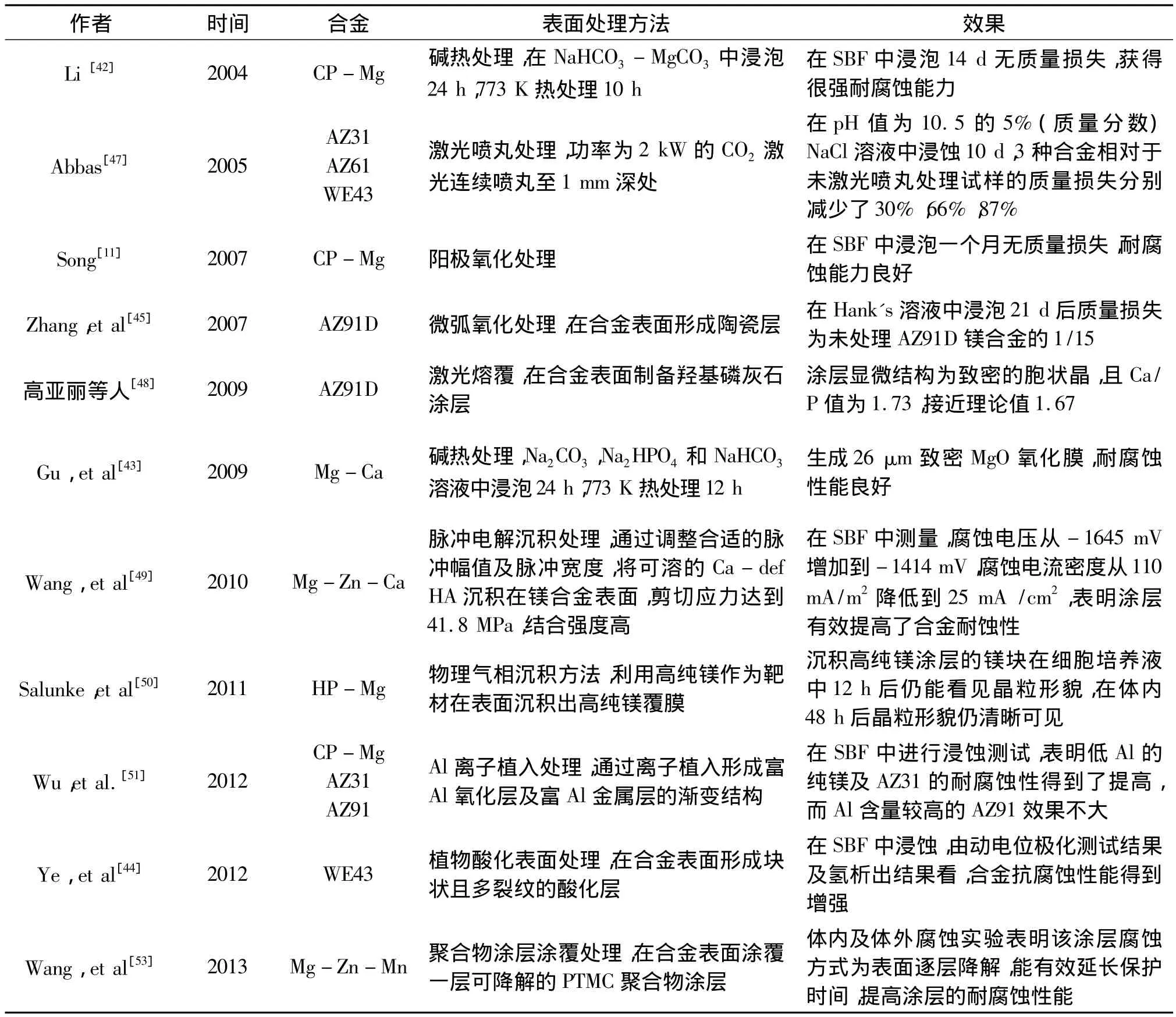
表2 近期镁合金血管支架表面处理研究进展Table 2 Recent studies on surface modification of magnesium alloys vascular stents
3 结论
可降解镁合金血管支架由于其可降解的特点,在人体内服役一定时间之后被降解吸收,降低了再狭窄及并发炎症的可能性,并对患有先天性心血管疾病的儿童的治疗有重要意义,因此,可降解的生物镁合金血管支架有着广阔的应用前景;但镁合金室温下较差的成形性能以及在体液环境中过快的降解速率限制了其应用,成为了研究重点。总结了近年来在镁合金血管支架应用方面的主要进展,主要结论包括以下几个方面。
1)镁合金微细管材加工主要包括材料改性(细化晶粒)以及加工工艺的优化。其中通过超大塑性变形的方法使镁合金获得超细晶组织,从而提高塑性以及力学性能得到了广泛关注;通过挤压和拉拔相结合的方法能够成形出外径3.0 mm,壁厚0.25 mm的微细管材,为镁合金微细管的进一步精细加工提供了基础。
2)镁合金血管支架耐腐蚀性能的提高主要依靠合金元素的添加以及表面改性处理。在镁合金血管支架表面涂覆可降解聚合物涂层的方法,不仅符合可降解的特点,还可以根据基底合金的不同调节覆盖涂层的成分,控制腐蚀速率。
3)数值模拟尤其是有限元方法,作为一个简便而高效的分析手段,可以用来模拟所设计的血管支架膨胀过程中的支架受力情况、管坯成形过程以及血管支架及其涂层的腐蚀行为等,提高镁合金血管支架的设计及制造效率。
[1]世卫组织媒体中心.心血管病[EB/OL].(2011-09)[2012-03-10].http://www.who.int/mediacentre/factsheets/fs317/zh/.
[2]Van BEUSEKOM H M,SERRUYS P W.Drug-Eluting Stent Endothelium[J].JACC:Cardiovascular Interventions,2010,3(1):76—77.
[3]HERMAWAN H,DUBE D,MANTOVANI D.Developments in Metallic Biodegradable Stents[J].Acta Biomaterialia,2010,6(5):1693—1697.
[4]MUELLER P P,MAY T,PERZ A,et al.Control of Smooth Muscle Cell Proliferation by Ferrous Iron[J].Biomaterials,2006,27(10):2193—2200.
[5]KIM H S,KIM Y H,LEE S W,et al.Safety and Effectiveness of Sirolimus-eluting Stent Implantation for Instent Restenosis of the Unprotected Left Main Coronary Artery[J].International Journal of Cardiology,2008,124(1):118—120.
[6]MATSUOKA H,KAWAKAMI H,OHSHITA A,et al.Bare Metal Stent Implantation for In-stent Restenosis with A Drug-eluting Stent[J].Journal of Cardiology,2010,55(1):135—138.
[7]李涛,吕志前.生物可降解支架研究进展[J].解剖科学进展,2008,14(4):436—440.
LI Tao,LYU Zhi-qian.Advance of Biodegradable Stent[J].Progress of Anatomical Sciences,2008,14(4):436—440.
[8]HEHRLEIN C.Promises of Biodegradable Stents[J].Catheterization and Cardiovascular Interventions,2007,69(5):739.
[9]郑玉峰,刘彬,顾雪楠.可生物降解性医用金属材料的研究进展[J].材料导报,2009,23(1):1—6.
ZHENG Yu-feng,LIU Bin,GU Xue-nan.Research Progress in Biodegradable Metallic Materials for Medical Application[J].Materials Review,2009,23(1):1—6.
[10]袁广银,章晓波,牛佳林,等.新型可降解生物医用镁合金JDBM的研究进展[J].中国有色金属学报,2011,21(10):2476—2488.
YUAN Guang-yin,ZHANG Xiao-bo,NIU Jia-lin,et al.Research Progress of New Type of Degradable Biomedical Magnesium Alloys JDBM[J].The Chinese Journal of Nonferrous Metals,2011,21(10):2476—2488.
[11]SONG G.Control of Biodegradation of Biocompatible Magnesium Alloys[J].Corrosion Science,2007,49(4):1696—1701.
[12]郑玉峰,顾雪楠,李楠,等.生物可降解镁合金的发展现状与展望[J].中国材料进展,2011,30(4):30—43.
ZHENG Yu-feng,GU Xue-nan,LI Nan.Development and Prospects of Biodegradable Magnesium Alloys[J].Materils China,2011,30(4):30—43.
[13]WAKSMAN R,PAKALA R,OKABE T,et al.Efficacy and Safety of Absorbable Metallic Stents with Adjunct Intracoronary Beta Radiation in Porcine Coronary Arteries[J].Journal of Interventional Cardiology,2007,20(5):367—372.
[14]WAKSMAN R,PAKALA R,KUCHULAKANTI P K,et al.Safety and Efficacy of Bioabsorbable Magnesium Alloy Stents in Porcine Coronary Arteries[J].Catheterization and Cardiovascular Interventions,2006,68(4):607—617.
[15]HEUBLEIN B,ROHDE R,KAESE V,et al.Biocorrosion of Magnesium Alloys:A New Principle in Cardiovascular Implant Technology[J].Heart,2003,89(6):651—656.
[16]PEETERS P,BOSIERS M,VERBIST J,et al.Preliminary Results after Application of Absorbable Metal Stents in Patients with Critical Limb Ischemia[J].Journal of Endovascular Therapy,2005,12(1):1—5.
[17]SCHRANZ D,ZARTNER P,MICHEL-BEHNKE I,et al.Bioabsorbable Metal Stents for Percutaneous Treatment of Critical Recoarctation of the Aorta in a Newborn[J].Catheterization and Cardiovascular Interventions,2006,67(5):671—673.
[18]ERBEL R,DI MARIO C,BARTUNEK J,et al.Temporary Scaffolding of Coronary Arteries with Bioabsorbable Magnesium Stents:a Prospective,Non-randomized Multicentre Trial[J].The Lancet,2007,369(9576):1869—1875.
[19]WERKHOVEN R,SILLEKENS W,LIESHOUT J V.Processing Aspects of Magnesium Alloy Stent Tube[J].Magnesium Technology,2011:419—424.
[20]SERRUYS P W,KUTRYK M J,ONG A T.Coronary-artery Stents[J].New England Journal of Medicine,2006,354(5):483—495.
[21]FANG G,AI W J,LEEFLANG S,et al.Multipass Cold Drawing of Magnesium Alloy Minitubes for Biodegradable Vascular Stents[J].Materials Science and Engineering:C,2013:3481—3488.
[22]MANABE K,SHIMIZU T,FURUSHIMA T.An Analysis of Temperature Distribution Processing and Deformation Characterization of Narrow Tubes[C].Proceedings of the 2005 Japanese Spring Conference for the Technology of Plasticity.Sanjyo,Japan,2005:39—40.
[23]VEDANI M,GE Q,WU W,et al.Texture Effects on Design of Mg Biodegradable Stents[J].International Journal of Material Forming,2012,7(1):31—38.
[24]HWANG Y M,HUANG S J,HUANG Y S.Study of Seamless Tube Extrusion of SiCp-reinforced AZ61 Magnesium Alloy Composites[J].The International Journal of Advanced Manufacturing Technology,2013,68(5-8):1361—1370.
[25]GE Q,DELLASEGA D,DEMIR A G,et al.The Processing of Ultrafine-grained Mg Tubes for Biodegradable Stents[J].Acta Biomaterialia,2013,9(10):8604—8610.
[26]FARAJI G,YAVARI P,AGHDAMIFAR S,et al.Mechanical and Microstructural Properties of Ultra-fine Grained AZ91 Magnesium Alloy Tubes Processed via Multi Pass Tubular Channel Angular Pressing(TCAP)[J].Journal of Materials Science & Technology,2014,30(2):134—138.
[27]FURUSHIMA T,MANABE K.Experimental and Numerical Study on Deformation Behavior in Dieless Drawing Process of Superplastic Microtubes[J].Journal of Materials Processing Technology,2007,191(1-3):59—63.
[28]GE Q,VEDANI M,VIMERCATI G.Extrusion of Magnesium Tubes for Biodegradable Stent Precursors[J].Materials and Manufacturing Processes,2012,27(2):140—146.
[29]HANADA K,MATSUZAKI K,HUANG X,et al.Fabrication of Mg Alloy Tubes for Biodegradable Stent Application[J].Materials Science Engineering:C,2013,33(8):4746—4750.
[30]INOUE M,UEDA H,HANADA K.Precise Extrusion Processing of Magnesium Alloy Small Tube for Biodegradable Stent Application[C].The 6th Symposium on Biodegradable Metal.Maratea,Italy,2014:Met-15.
[31]段祥瑞.AZ31镁合金薄壁细管塑性加工工艺及组织性能研究[D].哈尔滨:哈尔滨工业大学,2013.
[32]何淼.镁合金拉拔工艺及组织性能的研究[D].沈阳:沈阳工业大学,2008.
[33]李伟.生物可降解稀土镁合金血管支架无缝管材的制备技术及性能研究[D].重庆:重庆大学,2011.
[34]林生岭.WE43镁合金微管成形及医用力学改性研究[D].兰州:兰州理工大学,2011.
[35]方刚,闫凯民,曾攀,等.镁合金微细管热挤压-冷拉拔工艺[J].塑性工程学报,2013,20(5):11—15.
[36]ZHENG Y,GU X,WITTE F.Biodegradable Metals[J].Materials Science and Engineering:R,2014,77:1—34.
[37]GROGAN J A,LEEN S B,MCHUGH P E.Computational Micromechanics of Bioabsorbable Magnesium Stents[J].Journal of Mechanical Behavior Biomedical Materials,2014,34:93—105.
[38]FURUSHIMA T,MANABE K.Experimental Study on Multi-pass Dieless Drawing Process of Superplastic Zn-22%Al Alloy Microtubes[J].Journal of Materials Processing Technology,2007,187-188:236—240.
[39]吴远浩,周晓晨,李楠,等.可降解金属血管支架研究进展[J].中国材料进展,2012,31(9):27—34.
[40]SMOLA B,JOSKA L,BEZINA V,et al.Microstructure,Corrosion Resistance and Cytocompatibility of Mg-5Y-4Rare Earth-0.5 Zr(WE54)Alloy[J].Materials Science and Engineering:C,2012,32(4):659—664.
[41]NEUBERT V,STUL KOV I,SMOLA B,et al.Thermal Stability and Corrosion Behavior of Mg-Y-Nd and Mg-Tb-Nd Alloys[J].Materials Science and Engineering:A,2007,462(1/2):329—333.
[42]LI L,GAO J,WANG Y.Evaluation of Cyto-toxicity and Corrosion Behavior of Alkali-heat-treated Magnesium in Simulated Body Fluid[J].Surface and Coatings Technology,2004,185(1):92—98.
[43]GU X,ZHENG W,CHENG Y,et al.A Study on Alkaline Heat Treated Mg-Ca Alloy for the Control of the Biocorrosion Rate[J].Acta Biomaterialia,2009,5(7):2790—2799.
[44]YE C H,ZHENG Y F,WANG S Q,et al.In Vitro Corrosion and Biocompatibility Study of Phytic Acid Modified WE43 Magnesium Alloy[J].Applied Surface Science,2012,258(8):3420—3427.
[45]ZHANG X,ZHAO Z,WU F,et al.Corrosion and Wear Resistance of AZ91D Magnesium Alloy with and without Micro Arc Oxidation Coating in Hank's Solution[J].Journal of Materials Science,2007,42(20):8523—8528.
[46]SONG Y,DONG K,SHAN D,et al.Investigation of a Novel Self-sealing Pore Micro-arc Oxidation Film on AM60 Magnesium Alloy[J].Journal of Magnesium and Alloys,2013,1(1):82—87.
[47]ABBAS G,LIU Z,SKELDON P.Corrosion Behavior of Laser-melted Magnesium Alloys[J].Applied Surface Science,2005,247(1):347—353.
[48]高亚丽,熊党生,王存山,等.医用镁合金激光熔覆羟基磷灰石涂层初探[J].特种铸造及有色合金,2009,29(4):305—307.
[49]WANG H,GUAN S,WANG X,et al.In Vitro Degradation and Mechanical Integrity of Mg-Zn-Ca Alloy Coated with Ca-deficient Hydroxyapatite by the Pulse Electrode Position Process[J].Acta Biomaterialia,2010,6(5):1743—1748.
[50]SALUNKE P,SHANOV V,WITTE F.High Purity Biodegradable Magnesium Coating for Implant Application[J].Materials Science and Engineering:B,2011,176(20):1711—1717.
[51]WU G,XU R,FENG K,et al.Retardation of Surface Corrosion of Biodegradable Magnesium-based Materials by Aluminum Ion Implantation[J].Applied Surface Science,2012,258(19):7651—7765.
[52]REGAR E,SIANOS G,SERRUYS P.Stent Development and Local Drug Delivery[J].British Medical Bulletin,2001,59(1):227—248.
[53]WANG J,HE Y,MAITZ M F,et al.A Surface-eroding Poly(1,3-trimethylene Carbonate)Coating for Fully Biodegradable Magnesium-based Stent Applications:Toward Better Biofunction,Biodegradation and Biocompatibility[J].Acta Biomaterialia,2013,9(10):8678—8689.
[54]GU X,ZHENG Y,LAN Q,et al.Surface Modification of An Mg-1Ca Alloy to Slow Down Its Biocorrosion by Chitosan[J].Biomedical Materials,2009,4(4):044109.
[55]GRAY-MUNRO J E,SEGUIN C,STRONG M.Influence of Surface Modification on the In Vitro Corrosion Rate of Magnesium Alloy AZ31[J].Journal of Biomedical Materials Research Part A,2009,91(1):221—230.
[56]WU W,GASTALDI D,YANG K,et al.Finite Element Analyses for Design Evaluation of Biodegradable Magnesium Alloy Stents in Arterial Vessels[J].Materials Science and Engineering:B,2011,176(20):1733—1740.
[57]GROGAN J A,LEEN S B,MCHUGH P E.A Physical Corrosion Model for Bioabsorbable Metal Stents[J].Acta Biomaterialia,2014,10(5):2313—2322.
[58]SCHIAVONE A,ZHAO L G,ABDEL-WAHAB A A.Effects of Material,Coating,Design and Plaque Composition on Stent Deployment inside A Stenotic Artery-Finite Element Simulation[J].Materials Science Engineering:C,2014,42:479—488.

