结直肠腺瘤切除术后息肉复发及内镜监测的临床分析
高 辉,张 川,阎雪燕,袁志芳,张继舜,段卓洋
首都医科大学附属北京朝阳医院京西院区消化内科,北京100043
结直肠腺瘤(colorestal adenoma,CRA)是最常见的消化道息肉,约5% ~40%的恶变率[1],目前内镜下切除治疗是公认的有效降低结肠癌发病风险的治疗措施[2],因此临床上发现CRA 即建议患者行切除治疗,而切除治疗后定期复查结肠镜是预防CRA 复发及CRA 癌变的主要措施。本文收集在北京朝阳医院行结肠镜下息肉切除术,且复查结肠镜的患者资料,以探讨CRA 患者切除术后复发的情况。
1 方法
1 一般资料 收录2005 年5 月-2012 年5 月在北京朝阳医院消化内科完成结肠镜下息肉切除术的患者(第一次门诊行肠镜检查发现息肉并取病理,3 个月内住院行肠镜下息肉摘除术,同时排除漏诊息肉),并排除了结肠癌、CRA 癌变、炎症性肠病、家族性息肉病,最终选择结肠镜到达回盲末端或回盲瓣、病理组织学确诊为CRA,并且间隔一段时间后再次入院行肠镜复查的患者。符合上述标准者共143 例,男89 例,女54例,年龄30 ~80 岁,中位年龄61.2 岁。
1.2 方法 采用回顾性分析方法,将初次结肠镜检查时发现的CRA 患者按性别、年龄、息肉大小、息肉数目、息肉发生部位、病理类型等进行统计分析。CRA病理类型均于北京朝阳医院病理科确诊,包括:管状腺瘤、管状绒毛状腺瘤、绒毛状腺瘤。
1.3 统计学处理 采用SPSS 13.0 软件包进行统计学处理,应用Life table 法统计CRA 的累计复发率,应用Cox Regression 进行多因素分析,确定影响CRA 复发的重要因素,应用Kaplan-Meier 法计算复发重要因素的中位复发时间,P <0.05 为差异有统计学意义。
2 结果
2.1 复发情况 总体复发率为72%,中位复发时间为1.4 年,1 年内复发率为37%,2 年内复发率为58.70%,3 年内的复发率为65.70%,4 年内的复发率为71.30%,5 年内的复发率为72%。在第1 年复查肠镜的患者当中有80.3%出现复发息肉,第2 ~4 年为61 ~66%,第5 年为100%。
2.2 影响CRA 复发的因素 将患者性别、年龄、息肉大小、息肉数目、息肉发生部位、病理类型等均作为影响因素引入统计方程,最终发现,仅有CRA 的大小和病理类型对复发有重要影响。初检CRA 直径>1 cm 的患者较CRA 直径≤1 cm 的患者复发风险高(P=0.02),CRA病理中含有绒毛成分的患者较仅为管状腺瘤的患者复发风险高(P=0.08,见表1,图1 ~2)。
2.3 肿瘤大小及病理类型对CRA 复发时间的影响
管状腺瘤患者的中位复发时间为16.7 个月,含绒毛成分腺瘤患者的中位复发时间为7.5 个月,CRA 直径≤1 cm 患者的中位复发时间为20.1 个月,CRA 直径>1 cm 患者的中位复发时间为7.7 个月(见表2,图3 ~4)。

表1 影响CRA 复发的多因素分析Tab 1 Multiple factors analysis of recurrence of CRA

表2 肿瘤大小及病理类型对复发时间的影响分析Tab 2 Analysis of the impact of tumor size and the pathological type to recurrence time

图1 不同直径CRA 的复发风险Fig 1 The risk of recurrence of different diameters CRA
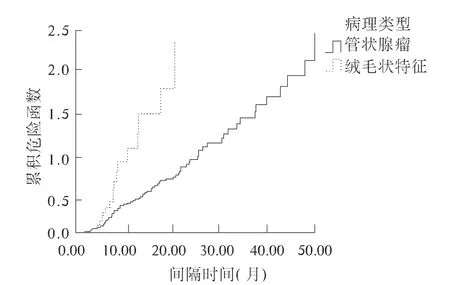
图2 不同病理类型CRA 的复发风险Fig 2 The risk for recurrence of different pathological types of CRA

图3 不同病理类型CRA 的累计复发曲线Fig 3 Cumulative recurrence curves of different pathological types of CRA

图4 不同直径CRA 的累积复发曲线Fig 4 Cumulative of different recurrence curves diarneters CRA
3 讨论
内镜下CRA 切除术可以显著降低结肠癌的发生率[2],而CRA 的特性之一就是复发,因此要求临床医生能够及时发现复发息肉,并给予内镜下切除,来进一步降低结直肠癌发生率。
本研究中总体复发率和国内外研究相似[3-5],总体复发率为72%,中位复发时间为1.4 年,3 年内的复发率为65.70%,因此,如果以发现复发息肉为目的,建议多数患者3 年左右复查一次肠镜。但本研究还发现在第1 年复查肠镜的患者当中有80.3%出现了复发息肉,而第2 ~4 年复查肠镜的患者当中有61% ~66%出现复发息肉,第5 年为100%,也就是说相当一部分复发息肉在第1 年就已经出现,在所有复发息肉中,已明确于第1 年复发的占51%,这与Gao 等[3]的研究结果类似,以此看来术后第1 年就复查肠镜似乎很有必要,但从结肠镜检查的成本效益比来看可能未必如此。
关于结肠镜随访的间期,国外学者一般推荐3 ~5年,甚至更长时间[6-7]。国内临床实践中一般主张较短的随访间期,主要原因有两个,即高估了低危腺瘤性息肉的危险以及为了减少漏诊,其实国内外均有报道,绝大部分的复发息肉并不会进展为结直肠癌[8],而高质量的结肠镜检查可以将漏诊率控制在一个尽可能低的水平。入选本研究的病例,在接受随访前实际上已经完成了两次结肠镜检查(第1 次肠镜发现息肉并取病检,第2 次肠镜行息肉切除并再次行病理检查),因此息肉漏诊的风险较小。
本研究把患者性别、年龄、CRA 大小、数目、发生部位、病理类型等均作为影响因素引入统计方程,最终发现,仅CRA 的大小和病理类型对复发有重要影响,患者性别、年龄、CRA 数目、发生部位均对复发影响较小。国外Viel 等[9-10]认为只有初检CRA 的数目是预测复发的有用指标;de Jonge 等[11]认为高级别腺瘤、CRA 数目≥3 个、直径≥1 cm、患者年龄≥60 岁是腺瘤复发的主要危险因素,男性、病理中含绒毛成分、发生在近端是次要危险因素;国内Huang 等[12]认为老年、男性、CRA 大小、数目、高级别病理类型均是复发的危险因素。本研究和这些研究相比,有相同点,也有不同点,考虑主要与研究人群特点及病例数不同有关。我们认为制定腺瘤电切术后随访方案的关键在于初检发现腺瘤的大小和病理。根据我们的分析,管状腺瘤的中位复发时间为16.7 个月,含绒毛成分腺瘤的中位复发时间为7.5 个月,CRA 直径≤1 cm 的中位复发时间为20.1 个月,CRA 直径>1 cm 的中位复发时间为7.7 个月。
综上所述,我们建议CRA 病理中含绒毛成分的或其直径>1 cm 的患者术后6 ~12 个月复查肠镜,而CRA 直径≤1 cm 的管状腺瘤患者可在术后2 年左右复查肠镜。
[1] Chen HZ. Practice of internal medicine[M]. 12th ed. Beijing:People's Health Publishing House,2005:1934.陈灏珠. 实用内科学[M]. 12 版. 北京:人民卫生出版社,2005:1934.
[2] Rosa I,Fidalgo P,Soares J,et al. Adenoma incidence decreases under the effect of polypectomy[J]. World J Gastroenterol,2012,18(11):1243-1248.
[3] Gao QY,Chen HM,Sheng JQ,et al. The first year follow-up after colorectal adenoma polypectomy is important:a multiple-center study in symptomatic hospital-based individuals in China[J]. Front Med China,2010,4(4):436-442.
[4] Ji JS,Choi KY,Lee WC,et al. Endoscopic and histopathologic predictors of recurrence of colorectal adenoma on lowering the miss rate[J].Korean J Intern Med,2009,24(3):196-202.
[5] Marti'nez ME,Baron JA,Lieberman DA,et al. A pooled analysis of advanced colorectal neoplasia diagnoses after colonoscopic polypectomy[J].Gastroenterology,2009,136(3):832-841.
[6] Brenner H,Chang-Claude J,Rickert A,et al. Risk of colorectal cancer after detection and removal of adenomas at colonoscopy:populationbased case-control study [J]. J Clin Oncol,2012,30 (24):2969-2976.
[7] Arditi C,Gonvers JJ,Burnand B,et al. Appropriateness of colonoscopy in Europe (EPAGE II). Surveillance after polypectomy and after resection of colorectal cancer [J]. Endoscopy,2009,41 (3):209-217.
[8] Nusko G,Hahn EG,Mansmann U. Characteristics of metachronous colorectal adenomas found during long-term follow-up:analysis of four subsequent generations of adenoma recurrence[J]. Scand J Gastroenterol,2009,44(6):736-744.
[9] Viel JF,Studer JM,Ottignon Y,et al. Predictors of colorectal polyp recurrence after the first polypectomy in private practice settings:a cohort study[J]. PLoS One,2012,7(12):e50990.
[10] Ji JS,Choi KY,Lee WC,et al. Endoscopic and histopathologic predictors of recurrence of colorectal adenoma on lowering the miss rate[J].Korean J Intern Med,2009,24(3):196-202.
[11] de Jonge V,Sint Nicolaas J,van Leerdam ME,et al. Systematic literature review and pooled analyses of risk factors for finding adenomas at surveillance colonoscopy [J]. Endoscopy,2011,43 (7):560-572.
[12] Huang Y,Gong W,Su B,et al. Recurrence and surveillance of colorectal adenoma after polypectomy in a southern Chinese population[J]. J Gastroenterol,2010,45(8):838-845.

