噻唑烷二酮类治疗溃疡性结肠炎疗效的荟萃分析
李曼蓉,王 跃,宋 雯,朱海杭,张旭东,张妮娜,卜 平
扬州大学临床医学院 苏北人民医院消化内科,江苏 扬州225001
溃疡性结肠炎(ulcerative colitis,UC)是一种病程迁延、非特异性、发作期与缓解期交替的炎症性肠病。近来有研究指出,UC 可能与1 型糖尿病有着共同的易感途径[1]。UC 合并胰岛素抵抗(IR)的患者与单纯的UC 患者相比,白细胞、C-反应蛋白等炎性指标显著增高[2]。噻唑烷二酮类(Thiazolidinedione,TZDs)是一类胰岛素增敏剂,如罗格列酮、吡格列酮,较多地被用于降糖治疗中。然而,近年国内外较多研究显示,TZDs作为过氧化物酶体增殖物激活受体(PPARs)的激动剂,对维持肠道内环境稳态、抗炎及免疫调节方面起到重要作用[3-5]。目前,仍缺乏多中心大样本的随机双盲对照的临床试验来证实TZDs 对UC 的临床疗效。本文旨在对国内外已发表的相关随机对照试验的数据进行荟萃分析,系统评价TZDs 对UC 的临床疗效及不良反应。
1 资料与方法
1.1 纳入与排除标准
1.1. 1 纳入标准:(1)研究设计为随机对照试验(RCT)。语言限中、英文。(2)涉及TDZs 治疗UC 疗效及安全性的文献,并提供病例组和对照组的疾病活动指标或缓解例数或组织学分级等数据或可以通过原文或摘要推算得到;(3)研究对象,UC 患者诊断符合2000 年或2007 年中华医学会炎症性肠病诊断治疗规范[6-7],或电子结肠镜确诊。(4)实验组治疗措施为口服噻唑烷二酮类药物;(5)评分标准采用Sourtherland UC 疾病活动指数(UCAI、DAI),也称Mayo 指数,衡量疾病活动性,并用完全缓解、部分缓解、有效缓解标准评价疗效(见表1);(6)病理组织学分级标准:0 级:黏膜固有层无中性粒细胞浸润;Ⅰ级:黏膜固有层少量中性粒细胞浸润(<10 个/HPF);Ⅱ级:黏膜固有层有明显中性粒细胞浸润(10 ~50 个/HPF),累及50%以上隐窝;Ⅲ级:黏膜固有层有大量中性粒细胞浸润(>50 个/HPF),伴有隐窝脓肿;Ⅳ级:黏膜固有层明显急性炎症伴溃疡形成。
1.1.2 排除标准:(1)无法获得全文且无详细摘要的文献或无法提取数据的研究;(2)重复发表文献(只选择最近发表的一篇)、会议文献、综述评论、讲座或动物实验等;(3)无对照组的文献;(4)实验设计有明显设计缺陷和偏倚太大的文献。
1.2 检索策略 检索PubMed、CNKI、WanFang Data、CBM、Google 数据库,筛选国内外噻唑烷二酮对溃疡性结肠炎疗效相关随机对照试验,并追溯参考文献和引文进行了全面的文献检索。中文检索词为“噻唑烷二酮”、“罗格列酮”、“吡格列酮”、“溃疡性结肠炎”、“随机对照试验”,英文检索词为“thiazolidinedione”、“rosiglitazone”、“Pioglitazone”、“ulcerative colitis”、“randomized controlled trial”。检索结果由2 名评价者独立评阅,若有争议或不确定时咨询第三方。检索时限截至2013 年4 月。
1.3 资料的提取 根据检索词,初筛出34 篇文献,其中英文文献20 篇。浏览摘要或全文后,剔除不符合要求的文献,选择6 篇符合要求的文章[8-13]。其纳入文献的样本量及基本特征资料见表2。
1.4 纳入文献的质量评价 采用Jadad 评分量表评价纳入研究的质量。Jadad 评分量表[14]由随机、盲法、随访三部分组成,每部分按标准不同划分,总分为0 ~5 分。总分0 ~2 分为低质量研究,3 ~5 分为高质量研究。本研究的Jadad 评分见表2。本研究纳入文献均为RCT,其中1 篇[13]为多中心、随机、双盲、安慰剂对照试验。其中5 篇[8-9,11-13]均指出实验组与对照组在性别比例、病情分期、病变部位等差异无统计学意义(P >0.05)。
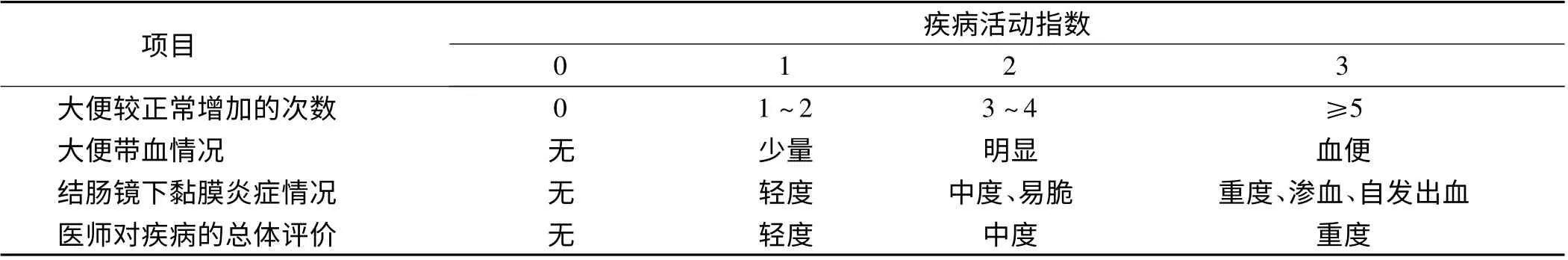
表1 Southerland UC 疾病活动指数Tab 1 Southerland DAI in UC patients
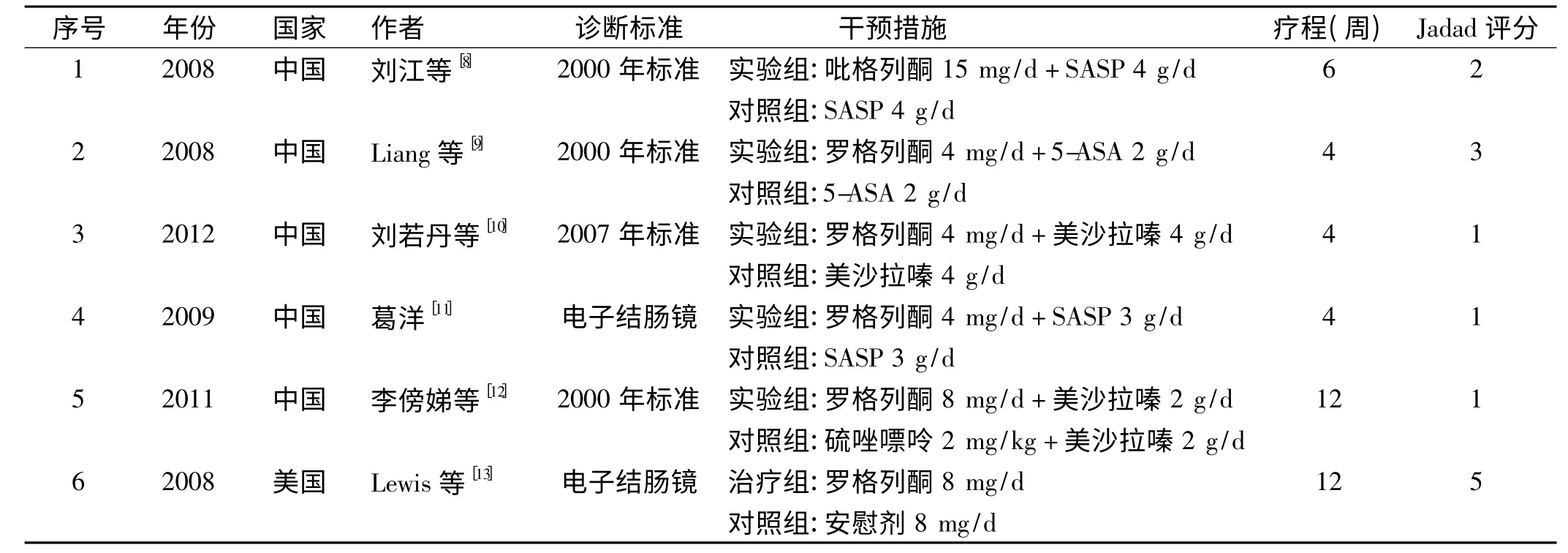
表2 纳入文献的一般资料及Jadad 评分Tab 2 Basic information and Jadad scores in the included studies
1.5 统计学处理 采用Cochrane 协作网提供的Rev-Man 4.3 统计软件进行Meta 分析。首先,对各研究间进行异质性检验,用χ2检验评估是否存在统计学异质性,I2检验评估异质性的大小,若I2>50%,说明存在统计学异质性。对于计数资料的结果测量的二分类变量采用比值比(OR),两者效应量用95%CI 表示;对于计量资料测量的二分类变量采用加权均数差(WMD),两者效应量用95%CI 表示,P <0.05 为差异有统计学意义。计算合并OR 值、WMD 及95%CI,画出森林图。由于纳入研究数目较少,故对发表性偏倚进行失安全系数估计代替倒漏斗图分析。并采用敏感性分析检验结果的稳定性。
2 结果
2.1 合并效应分析 UCAI 评分的固定效应模型综合分析显示,P =0.009,I2=73.9%,说明各研究之间存在显著的异质性,故采用随机效应模型估计TZDs 对UCAI 评分影响的合并效应,TZDs 能明显降低UC 患者的UCAI 评分(WMD = -0. 92,95% CI:-1.17 ~-0.66),P <0.00001,见图1)。有效缓解例数的固定效应模型综合分析显示,P =0.05,I2=65.6%,说明各研究之间存在显著的异质性,故采用随机效应模型估计TZDs 对有效缓解例数影响的合并效应,TZDs 能明显增加UC 患者的有效缓解例数(合并OR =12.31,95% CI:1.73 ~88.74,P =0.01,见图2)。病理组织学0 ~Ⅰ级例数的固定效应模型综合分析显示,P =0.62,I2=0%,各研究之间不存在异质性,故采用固定效应模型估计TZDs 对病理组织学0 ~Ⅰ级例数影响的合并效应,TZDs 明显增加UC 患者的组织学0 ~Ⅰ级人数(合并OR =2.71,95% CI:1.55 ~4.72,P =0.0004,见图3)。
2.2 敏感性分析 固定效应模型、随机效应模型的结果十分接近(见表3),在一定程度上反映合并结果的可靠性。
2.3 发表偏倚分析 引入失安全系数(fail-safe number,Nfs)来定量说明发表偏倚对合并结果的影响(P =0.05),计量资料按照麦劲壮[15]提出的方法计算Nfs;计数资料按照Nfs0.05=[K(Z2-1.6452)]/1.6452来计算。失安全系数越大,提示发表偏倚对结果的影响较小。本研究中UCAI 评分的Nfs0.05的失安全系数约为320,提示发表偏倚的影响较小。有效缓解例数Nfs0.05的失安全系数约为4,提示发表偏倚的影响较大。组织学0 ~Ⅰ级例数的Nfs0.05的失安全系数约为14,提示发表偏倚的影响较小。
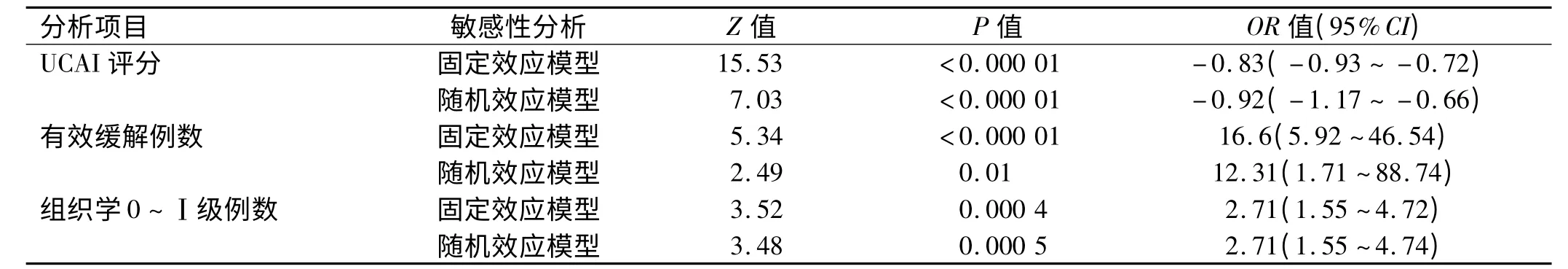
表3 敏感性分析结果Tab 3 Outcomes of sensitivity analysis
2.4 不良反应 其中文献[9-10,12]均未发现不良反应,文献[13]指出罗格列酮组与安慰剂组两组均有严重不良反应及轻度不良反应发生,其中罗格列酮组水肿发生率高于安慰剂组,差异有统计学意义(P =0.008),文献[11]中未描述不良反应。由于数据有限,故本研究中未行不良反应的Meta 分析。
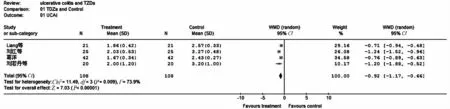
图1 TZDs 治疗UC 患者的UCAI 评分的Meta 分析(随机效应模型)Fig 1 Meta-analysis of UCAI in UC patients with TZDs treatment (randomed effect model)
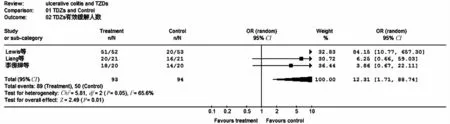
图2 TZDs 治疗UC 有效缓解例数的Meta 分析(随机效应模型)Fig 2 Meta-analysis of effective remission in UC patients with TZDs treatment (randomed effect model)
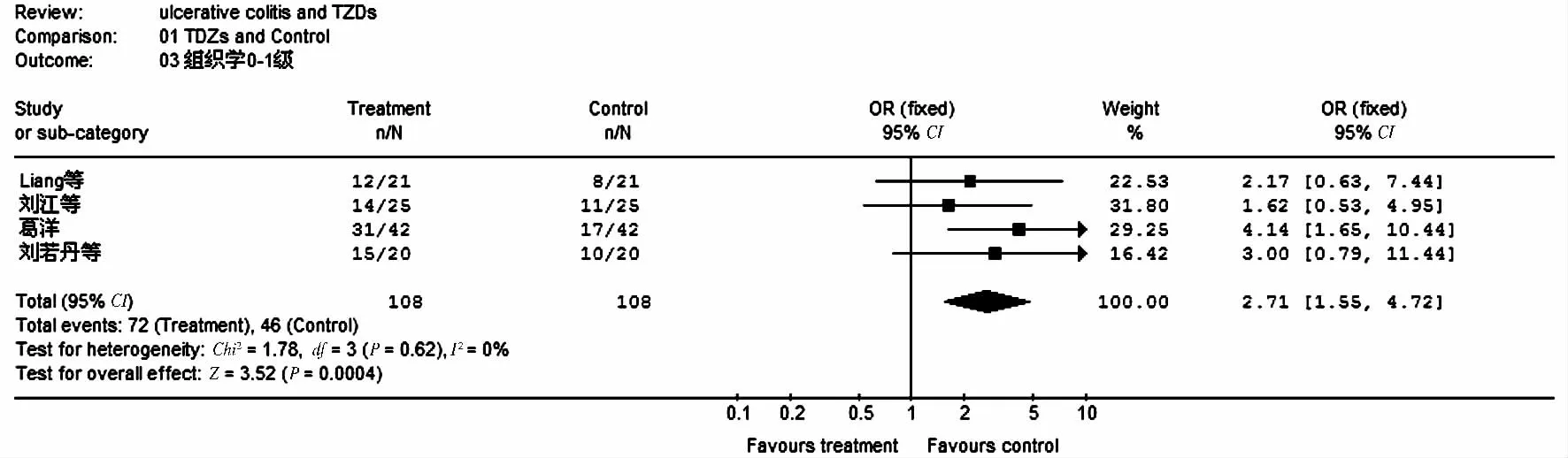
图3 TZDs 治疗UC 患者后组织学0 ~Ⅰ级例数的Meta 分析(固定效应模型)Fig 3 Meta-analysis of histological grade 0 to Ⅰin UC patients with TZDs treatment (fixed effect model)
3 讨论
UC 是一类严重影响患者生活质量、耗费大量医疗费用的疾病。近年来,UC 在我国的发病率与患病率呈逐年上升趋势。其病因与发病机制尚不明确,炎症性肠病与结直肠癌之间的联系早在1925 年就已被学者发现。UC 患者有较高的结直肠癌易感性[16]。近来研究[17]经30 年随访研究指出,UC 患者还增加了肠外肿瘤的风险。UC 病情迁延、易复发性的临床特点,导致了UC 的治疗上存在特异性低、有效性差的问题。故UC 的治疗越来越成为了国内外学者研究的热点。
本文系统评价了TZDs 治疗UC 的疗效,为TZDs用于UC 的治疗由临床试验阶段向临床应用阶段的迈进提供一个客观的证据,为UC 的临床治疗提供了一条新思路。本文Meta 分析共纳入6 篇文献,均为随机对照试验;其中仅1 篇英文文献单用罗格列酮为实验组,其余5 篇中文文献实验组均为TZDs 联合美沙拉嗪或柳氮磺吡啶或氨基水杨酸类药物。结果提示单用或加用TZDs 组患者的UCAI 评分要低于对照组,临床缓解例数要多于对照组,组织学分级,尤其是0 ~Ⅰ级改善情况要优于对照组,差异均具有统计学意义(P <0.05)。TZDs 的不良反应较小,仅1 篇英文文献中在水肿发生率方面高于对照组。
由于本研究Meta 分析纳入的文献数量不多,样本量偏小,更为合理可靠的结论还期待对大规模严谨设计的随机双盲对照试验进行前瞻性研究来进一步验证和支持。
[1] Wang K,Baldassano R,Zhang H,et al. Comparative genetic analysis of inflammatory bowel disease and type 1 diabetes implicates multiple loci with opposite effects[J]. Hum Mol Genet,2010,19(10):2059-2067.
[2] Yorulmaz E,Adali G,Yorulmaz H,et al. Metabolic syndrome frequency in inflammatory bowel diseases [J]. Saudi J Gastroenterol,2011,17(6):376-382.
[3] Pedersen G,Brynskov J. Topical rosiglitazone treatment improves ulcerative colitis by restoring peroxisome proliferator-activated receptorgamma activity[J]. Am J Gastroenterol,2010,105(7):1595-1603.
[4] Lewis JD,Lichtenstein GR,Stein RB,et al. An open-label trial of the PPAR-gamma ligand rosiglitazone for active ulcerative colitis[J]. Am J Gastroenterol,2001,96(12):3323-3328.
[5] Sánchez-Hidalgo M,Martín AR,Villegas I,et al. Rosiglitazone,an agonist of peroxisome proliferator-activated receptor gamma,reduces chronic colonic inflammation in rats[J]. Biochem Pharmacol,2005,69(12):1733-1744.
[6] Ouyang Q. Research progression of ulcerative colitis[M]. Chengdu:Sichuan Science and Technology Press,2000:66.欧阳钦主编. 溃疡性结肠炎研究进展[M].成都:四川科学技术出版社,2000:66.
[7] Cooperative Group of Inflammatory Bowel Diseases of Digestive Disease of Chinese Medical Association. Chinese consensus on standard management of inflammatory bowel diseases(2007,Jinan)[J]. Chin J Dig,2007,27(8):545-550.中华医学会消化病学分会炎症性肠病协作组. 对我国炎症性肠病诊断治疗规范的共识意见(2007 年,济南)[J]. 中华消化杂志,2007,27(8):545-550.
[8] Liu J,Li WP,Shi JM. The effect of pioglitazone combined with salicylazosulfapyridine for treatment of ulcerative colitis[J]. Clinical Medicine,2008,28(4):35-37.刘江,李伟平,施杰民.吡格列酮联合柳氮磺胺吡啶治疗溃疡性结肠炎的疗效分析[J].临床医学,2008,28(4):35-37.
[9] Liang HL,Ouyang Q. A clinical trial of combined use of rosiglitazone and 5-aminosalicylate for ulcerative colitis[J]. World J Gastroenterol,2008,14(1):114-119.
[10] Liu RD,Chen SN,Tan YG. Therapeutic effects of rosiglitazone combined with mesalamine in the treatment of ulcerative colitis [J].Shanxi Medical Journal,2012,41(2):109-110.刘若丹,陈淑娜,谭永港.罗格列酮联合美沙拉嗪治疗溃疡性结肠炎的疗效观察[J].山西医药杂志,2012,41(2):109-110.
[11] Ge Y. Clinical analysis of rosiglitazone for 42 patients with ulcerative colitis[J].Contemporary Medicine,2009,15(30):148-149.葛洋.罗格列酮治疗42 例溃疡性结肠炎的临床疗效分析[J]. 当代医学,2009,15(30):148-149.
[12] Li BD,Hong Q,Zhou SY,et al. Clinical effect of rosiglitazone in patients with refractory ulcerative colitis:analysis of 20 cases [J].Pharmacy Today,2011,21(12):760-766.李傍娣,洪茜,周桑玉,等.罗格列酮治疗20 例难治性溃疡性结肠炎的临床疗效分析[J].今日药学,2011,21(12):760-766.
[13] Lewis JD,Lichtenstein GR,Deren JJ,et al. Rosiglitazone for active ulcerative colitis:a randomized placebo-controlled trial[J]. Gastroenterology,2008,134(3):688-695.
[14] Jadad AR,Moore A,Carroll D,et al. Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J]. Control Clin Trials,1996,17(1):1-12.
[15] Mai JZ,Li H,Fang JQ,et al. Estimation of fail-safe number in Meta-analysis[J]. The Journal of Evidence-Based Medicine,2006,6(5):297-303.麦劲壮,李河,方积乾,等. Meta 分析中失安全系数的估计[J].循证医学,2006,6(5):297-303.
[16] Kappelman MD,Farkas DK,Long MD,et al. Risk of cancer in patients with inflammatory bowel diseases:a nationwide populationbased cohort study with 30 years of follow-up evaluation[J]. Clin Gastroenterol Hepatol,2014,12(2):265-273.
[17] Wohl P,Hucl T,Drastich P,et al. Epithelial markers of colorectal carcinogenesis in ulcerative colitis and primary sclerosing cholangitis[J].World J Gastroenterol,2013,19(14):2234-2241.

