还原型谷胱甘肽对正加速度暴露下急性胃黏膜损伤大鼠胃黏膜的影响
邵颖锬,李 静,陈 英,杨春敏,范 勤,唐合兰,王建昌
中国人民解放军空军总医院干部病房,北京100142
正加速度(+Gz)对飞行员的不良影响及防护是航空航天医学研究的重要课题。近年来+Gz 暴露对消化系统的影响是重要的研究内容之一。飞行工作紧张、生活不规律、精神高度紧张等特点及特殊的飞行环境因素极易导致飞行人员消化系统疾病的发生。统计资料表明,中国人民解放军总医院近40 年来空军总医院住院的歼击机飞行员中,消化系统疾病列在疾病谱前20 位[1]。有研究表明[2-3],高+Gz 值暴露可引起胃黏膜充血、水肿,并有点片状糜烂,我们前期的研究也表明高+Gz 值暴露可对正常胃黏膜造成损伤。还原性谷胱甘肽(GSH)是细胞内最为丰富的非蛋白巯基化合物,在体内起到重要的抗氧化、清除自由基的细胞保护作用。目前主要用于病毒性肝炎、肿瘤、肾脏、心脑血管系统等疾病的治疗[4],对急性胃黏膜损伤的预防及治疗还少有报道,对已有胃黏膜损伤后再次暴露于+Gz 条件时,对胃黏膜的影响未有报道。本实验通过无水乙醇大鼠急性胃黏膜损伤模型结合不同+Gz值暴露,并给予GSH 进行预处理,观察+Gz 对大鼠胃黏膜损伤的影响及GSH 对胃黏膜的保护及治疗作用,并测定胃黏膜组织中MDA、GSH 的含量及GSH-Px 的活性,为临床防治飞行员胃肠疾病提供新的理论依据。
1 材料与方法
1.1 资料 健康雄性SD 大鼠40 只,SPF 级,体质量(200 ±10)g,由中国军事医学科学院实验动物中心提供,许可证号SCXK-(军)-2007-004;模拟加速度动物离心机(由中国人民解放军空军第四研究所提供);动物手术器械,游标卡尺,MDA、GSH、GSH-Px 酶联免疫试剂盒均购自北京华英生物技术研究所;无水乙醇(北京化工公司,批号20120314);GSH(双益健)[(杭州澳亚生物技术有限公司生产,批号20120916)];戊巴比妥钠(sigma 公司,生产批号P4281);0.9%氯化钠注射液(华润双鹤药业股份有限公司,生产批号C201212171);40%甲醛溶液(北京益利精细化学品有限公司,生产批号20110823)。
1.2 方法
1.2.1 分组:SD 大鼠40 只,随机分成4 组:无水乙醇对照组(A 组)、+5 Gz 值暴露组(B 组)、+10 Gz 值暴露组(C 组)、GSH 预处理组(D 组),每组10 只,D 组大鼠适应性喂养7 d 后,连续3 d 腹腔注射GSH(800 mg/kg)。各组大鼠于第10 天禁食24 h,禁水12 h,经灌胃针无水乙醇(0.4 ml/100 g)灌胃。
1.2.2 大鼠模拟加速度模型制备:+Gz 暴露方式采用离心机模拟+Gz 暴露。利用特制固定盒承载大鼠,固定于动物离心机转臂上,大鼠头朝向离心机轴心,离心机半径为1 m,每只大鼠专用1 个固定盒,保证加速度作用的方向。加速度值增长率为1.0 Gz/s,由计算机进行加速度程序控制。各组大鼠无水乙醇灌胃1 h后,A 组上机捆绑3 min,不受加速度作用;B 组在+5 Gz 值下连续暴露3 min;C、D 组分别在+10 Gz 值下连续暴露3 min。4 组下机后均立即处死,留取胃黏膜及胃组织标本,待肉眼及光镜下观察,并检测胃黏膜组织中MDA、GSH 的含量及GSH-Px 的活性。
1.2.3 标本处理:(1)每组大鼠下离心机后3%戊巴比妥钠0.6 ml/200 g 腹腔麻醉,解剖大鼠取出胃。沿胃大弯侧剪开,用生理盐水冲洗,滤纸吸干,平铺于载玻片上。胃黏膜损伤程度以黏膜损伤指数表示,参考Guth 法计分:正常胃黏膜为0 分,损伤呈长条索状者,测其长度,以1 mm 计1 分,若宽度>1 mm,则计分加倍;出血点状者(长、宽均<1 mm)计0.5;出血呈斑块状者(长、宽均>2 mm),测定其面积,以面积计分。(2)测量胃黏膜损伤指数及留取病理标本后,用刀片轻轻刮取胃黏膜,置EP 管中,于-80 ℃冰箱保存待用,采用ELISA 检测MDA、GSH 的含量及GSH-Px 的活性,用时称重,以4%生理盐水制成10%的组织匀浆,4 ℃下4 000 r/min 离心10 min,取上清液检测,具体操作方法按照MDA、GSH、GSH-Px 酶联免疫试剂盒说明书进行,为保证实验结果的可靠性,每一标本均做复孔测定,同时设立阳性和阴性对照。
1.3 统计学分析 应用SPSS 17.0 统计学软件,对数据进行方差分析,以x ±s 表示,采用t 检验,P <0.05为差异有统计学意义。
2 结果
2.1 不同+Gz 值暴露及GSH 预处理后对大鼠胃黏膜大体损伤指数的影响 A 组大鼠胃黏膜表面轻度充血、水肿,+Gz 暴露后胃黏膜损伤加重,B 组胃黏膜表面充血、水肿,有散在点状和条索状糜烂及出血,与A组相比差异有统计学意义(P <0.05);C 组胃黏膜损伤最重,胃黏膜表面弥漫性充血、水肿,可见多发点状及灶状糜烂、大面积出血斑,部分黏膜剥脱,黏膜皱襞平坦,与A 组及B 组相比差异均有统计学意义(P 均<0.05);D 组胃黏膜损伤明显减轻,胃黏膜表面轻度充血、水肿,与C 组相比差异有显著统计学意义(P <0.01,见表1)。

表1 不同+Gz 值暴露及GSH 预处理后大鼠胃黏膜的损伤指数(x±s)Tab 1 Damage index rat gastric mucosa after exposure to different +Gz values and pretreatment with GSH (x±s)
2.2 不同+Gz 值暴露组及GSH 预处理后大鼠胃黏膜MDA、GSH 的含量及GSH-Px 的活性 与A 组相比,+Gz 暴露组胃黏膜中MDA 含量均有升高,但B 组升高不明显,与A 组相比差异无统计学意义(P >0.05);C 组胃黏膜MDA 含量明显升高,与A 组、B 组相比,差异均有统计学意义(P <0.05);D 组胃黏膜MDA 的含量与C 组相比明显降低,差异有统计学意义(P <0.05)。
与A 组相比,+Gz 暴露组胃黏膜中GSH 含量均有下降,但B 组下降不明显,与对照组相比差异无统计学意义(P >0.05);C 组胃黏膜GSH 含量明显下降,与A 组、B 组相比,差异均有统计学意义(P <0.05);D组胃黏膜GSH 的含量与C 组相比明显升高,差异有统计学意义(P <0.05)。
与A 组相比,B 组GSH-Px 的活性明显升高,差异有统计学意义(P <0.05);与A 组、B 组相比,C 组胃黏膜GSH-Px 的活性明显下降,差异均有统计学意义(P <0.05);D 组胃黏膜GSH-Px 的活性与C 组相比明显升高,差异有统计学意义(P <0.05)。
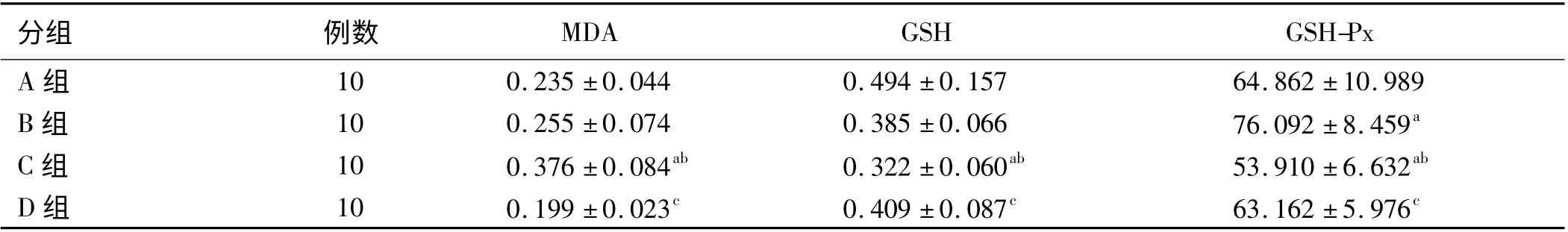
表2 不同+Gz 值暴露及GSH 预处理后大鼠胃黏膜MDA、GSH 的含量及GSH-Px 的活性(x±s)Tab 2 The levels of gastric mucosa MDA,GSH content and the activity of GSH-Px after exposure to different +Gz values and pretreatment with GSH(x±s)
3 讨论
GSH 是由谷氨酸、半胱氨酸和甘氨酸组成的含有疏基(-SH)的小分子三肽化合物。参与体内三羧酸循环及糖代谢,并能激活多种酶,从而促进糖、脂肪和蛋白质代谢,并能影响细胞的代谢过程,是细胞内重要的调节代谢物质之一;还可通过直接清除自由基,减少自由基生成,调节离子分布,抑制细胞因子合成,减少效应细胞活化,减轻靶细胞损伤,对维持细胞的正常代谢、保护细胞膜的完整性具有重要的生化功能[5]。GSH 作为体内重要的抗氧化剂,与超氧化物歧化酶(SOD)和过氧化氢酶(CAT)、GSH-Px 一起构成机体的抗氧化防御系统[6]。谭曼红等[7]研究显示,补充外源性GSH 可增强胃黏膜的抗氧化作用,减轻阿司匹林所致的胃黏膜损伤。
正常情况下,胃黏膜氧化/抗氧化系统保持平衡[8],在一些损伤因素的作用下,如:缺血、缺氧、离子辐射、化疗药物等可诱导并产生大量的活性氧(ROS),造成机体细胞损伤[9-11]。脂质过氧化反应作用于各种疾病中[12],并生成最终产物MDA,用作确定脂质过氧化作用的水平[13],因此,MDA 的含量是氧化应激的生物标志物[14]。我们的研究结果显示,+Gz 暴露可加重急性胃黏膜损伤,可使胃黏膜中MDA 含量升高,且与+Gz 值暴露呈正相关,+Gz 值越大,胃黏膜的损伤程度越重,MDA 含量越高。Hajrezaie 等[15]的研究显示,急性胃黏膜损伤后部分胃黏膜平坦化,我们的实验也观察到,高+Gz 暴露后胃黏膜皱襞部分消失,这可能与高+Gz 暴露值使胃黏膜坏死面积增加有关。经补充外源性GSH 预处理后,胃黏膜损伤程度明显减轻,黏膜皱襞相对完整,MDA 含量显著下降。
GSH 水平的增加与胃黏膜表现出一致的适应现象,GSH 含量越高,胃黏膜损伤越轻[15]。GSH 和其他抗氧化剂共同阻止活性氧对组织的损伤[16]。GSH 保护细胞的功能,主要是通过GSH-Px 保护细胞膜中的多不饱和脂肪酸防止脂质过氧化而实现,在GSH-Px 参与下,通过氧化还原反应清除ROS,减轻胃黏膜损害[17]。GSH 是GSH-Px 的反应底物,在GSH-Px 发挥抗脂质过氧化作用时起辅助因子作用[18],GSH-Px 以硒代半胱氨酸(Sec)的形式,利用GSH 还原氢过氧化物为H2O 或醇类化合物,消除机体内的过氧化氢及脂质过氧化物,阻断活性氧自由基对机体的进一步损伤[19]。在此过程中,GSH 自身被氧化为氧化型谷胱甘肽(GSSG),GSSG再在谷胱甘肽还原酶(GSH-Rx)的作用下还原为GSH,使体内自由基的清除反应能够持续进行[20]。当GSH的含量不足以清除过多的ROS 时,ROS 便对机体造成损伤。我们的研究结果显示,+Gz 暴露可降低胃黏膜GSH 的含量,且与+Gz 值大小呈负相关,+Gz 值越大,胃黏膜GSH 的含量越低,损伤越重;另外我们观察到,低+Gz 值组胃黏膜的GSH-Px 活性明显高于对照组,这可能与大鼠应激自身保护作用有关;高+Gz 值暴露组GSH-Px 活性明显低于对照组,说明高+Gz 值暴露对胃黏膜损伤较大;经外源性GSH 预处理后,胃黏膜GSH 的含量及GSH-Px 的活性均升高,说明补充GSH 可增强胃黏膜的抗氧化能力。
另外最近的研究显示氧衍生的自由基在乙醇诱导的大鼠急性胃黏膜损伤的缺血再灌注发病机制中起到重要作用[14],即缺血再灌注诱导的胃黏膜病变,主要是由于过多的ROS 代谢产物和内皮细胞的嗜中性粒细胞黏附。de-Faria 等[21]研究显示,ROS 参与了胃黏膜的缺血再灌注损伤。缺血削弱了胃黏膜的屏障,增加H+返渗而引起胃黏膜损伤。+Gz 暴露使血流量下降到临界值以下时,加重了胃黏膜的缺血、缺氧[22]。再灌注后,黄嘌呤-黄嘌呤氧化酶系统和中性粒细胞激活,产生大量的ROS,导致组织发生脂质过氧化,造成胃黏膜损伤[23]。我们的研究显示+Gz 暴露与MDA含量呈正相关,经补充外源性GSH 后,胃黏膜MDA 含量显著降低,说明GSH 实现对胃黏膜的保护作用机制之一是降低ROS 对胃黏膜缺血再灌注时的损伤。
综上所述,模拟飞行训练在高+Gz 值下暴露可加重胃黏膜的急性损伤,补充外源性GSH 可增强胃黏膜的抗氧化能力,实现对胃黏膜的保护作用,本文对其机制进行了初步的探讨,为GSH 作为临床药物应用于防治飞行员胃肠疾病提供了理论依据。
[1] Xu XR,Fu ZJ,Yin X,et al. Analysis of disease spectrum in hospitalized fighter pilots [J]. Chin J Aerospace Med,2005,16 (2):135-138.徐先荣,付兆君,尹欣,等. 歼击机飞行员住院疾病谱分析[J].中华航空航天医学杂志,2005,16(2):135-138.
[2] Zhao HL,Wu ZJ,Sun Y,et al. The research for prevention & treatment of the rats gastric mucosa injury induced by exposuring to high +Gz value[J]. Prac J Med & Pharm,2010,27(6):545-550.赵洪礼,吴战军,孙跃,等. 高+Gz 值暴露对胃黏膜损伤的防治性研究[J]. 实用医药杂志,2010,27(6):545-550.
[3] Zhong XJ,Wu ZJ,Sun YP,et al. Changes of somatostatin (SS)in stomach and duodenum of rats after + Gz exposure[J]. Space Medicine & Medical Engineering,2005,18(2):148-150.钟学军,吴战军,孙延平,等. + Gz 值暴露后大鼠胃十二指肠粘膜及生长抑素含量的变化[J]. 航天医学与医学工程杂志,2005,18(2):148-150.
[4] Yan WM. Progress in the clinical application of domestic glutathione[J].Chinese Journal of Clinical Pharmacy,2009,18(3):190-194.严伟民. 还原型谷胱甘肽在国内的临床应用研究进展[J]. 中国临床药学杂志,2009,18(3):190-194.
[5] Li BC,Wu MY,Meng G,et al. Progress of glutathione in clinical research and application [J]. China Healthcare Innovation,2008,3(6):9-10.李斌晨,吴明营,蒙革,等. 还原型谷胱甘肽临床研究及应用进展[J]. 中国医疗前沿,2008,3(6):9-10.
[6] Li Y,Wo JM,Ellis S,et al. A novel external esophageal perfusion model for reflux esophageal injury[J]. Dig Dis Sci,2006,51(3):527-532.
[7] Tan MH,Wang HJ. Protection of Sulfhydryl on low dose aspirin-induced gastric mucosal lesions in rats[J]. Chin J Gastroenterol,2008,13(3):174-178.谭曼红,王惠吉. 巯基物质对小剂量阿司匹林所致大鼠胃黏膜损伤的保护作用[J]. 胃肠病学,2008,13(3):174-178.
[8] Das D,Banerjee RK. Effect of stress on the antioxidant enzymes and gastric ulceration[J]. Mol Cell Biochem,1993,125(2):115-125.
[9] Alexandrova M,Bochev P,Markova V,et al. Dynamics of free radical processes in acute ischemic stroke:influence on neurological status and out come[J]. J Clin Neurosci,2004,11(5):501-508.
[10] Cantore M,Siano S,Coronnello M,et al. Pirenoxine prevents oxidetive effect s of argon f luoride excimer laser irradiat ion in rabbit corneas:biochemical,histological and cytofluorimetric evaluations[J]. J Photochem Photobiol B,2005,78(1):35-42.
[11] Woiniak A,Drewa G,Wozniak B,et al. The effect of antitumor drugs on oxidative stress in B16 and S91melanoma cells in vitro[J].Med Sci Monit,2005,11(1):BR22-BR29.
[12] Ajitha M,Rajnarayana K. Role of oxygen free radicals in human diseases[J]. Indian Drug,2001,38:545-554.
[13] Dursun H,Bilici M,Albayrak F,et al. Antiulcer activity of fluvoxamine in rats and its effect on oxidant and antioxidant parameters in stomach tissue[J]. BMC Gastroenterol,2009,9:36.
[14] Kwiecień S,Brzozowski T,Konturek SJ. Effects of reactive oxygen species action on gastric mucosa in various models of mucosal injury[J]. J Physiol Pharmacol,2002,53(1):39-50.
[15] Hajrezaie M,Golbabapour S,Hassandarvish P,et al. Acute toxicity and gastroprotection studies of a new schiff base derived copper (II)complex against ethanol-induced acute gastric lesions in rats [J].PLoS One,2012,7(12):e51537.
[16] Polat B,Suleyman H,Alp HH. Adaptation of rat gastric tissue against indomethacin toxicity [J]. Chem Biol Interact,186(1):82-89.
[17] Tu BQ,Li J,Wang MJ,et al. Experimental study of glutathione on gastric mucosal protection[J]. Shanghai Medical Journal,2000,23(2):115-116.屠柏强,李健,王美娟,等. 谷胱甘肽对胃粘膜保护作用的实验研究[J]. 上海医学,2000,23(2):115-116.
[18] Cheng S,Ding HQ. Glutathione and antioxidant talk today[J]. Progress in Physiological Sciences,2002,33(1):85-90.程时,丁海勤. 谷胱甘肽及其抗氧化作用今日谈[J]. 生理科学进展,2002,33(1):85-90.
[19] Wang YM. Free radicals and glutathione peroxidase[J]. Pharm J Chin PLA,2005,21(5):369-371.王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报,2005,21(5):369-371.
[20] Hamaishi K,Kojima R,Ito M. Anti-ulcer effect of tea catechin in rats[J]. Biol Pharm Bull,2006,29(11):2206-2213..
[21] de-Faria FM,Almeida AC,Luiz-Ferreira A,et al. Antioxidant action of mangrove polyphenols against gastric damage induced by absolute ethanol and ischemia-reperfusion in the rat [J]. Scientific World Journal,2012,2012:327071.
[22] Liu JB,Wang HB,Liu L,et al. The effect of centrifuge training on the mRNA expression of IL-6 and TNFα in brain and other tissues of rat[J]. Chinese Journal of Biochemistry and Molecular Biology,2002,18(5):649-653.刘建彬,王洪波,刘丽,等. 离心机训练对大鼠脑及其它组织IL-6 和TNFα 基因表达水平的影响[J]. 中国生物化学与分子生物学报,2002,18(5):649-653.
[23] Rao CV,Vijayakumar M. Protective effect of (+)-catechin against gastric mucosal injury induced by ischaemia-reperfusion in rats[J]. J Pharm Pharmacol,2007,59(8):1103-1107.

