DTI与MRS成像在一氧化碳中毒迟发性脑病中的应用研究
1.第二军医大学海军临床医学院海军总医院高压氧科
2.第二军医大学海军临床医学院海军总医院医学影像中心(北京 100048)
李铭鑫1 胡慧军1 郑奎宏2 潘晓雯1
一氧化碳中毒迟发性脑病是急性一氧化碳中毒后较为常见的中枢神经系统后遗症,其表现主要为复发的意识障碍或意识夺获、认知和运动障碍等[1]。核磁共振弥散张量成像(Diffusion tensor imaging,DTI)与磁共振波谱成像(Magnetic resonance spectroscopy,MRS)是常用的组织结构影像学检查,对于脑白质组织损伤定量分析具有重要意义[2]。为了解DTI和MRS结果对DNS预后的诊断价值,随机选取2013年1月~5月间于我科就诊的一氧化碳中毒患者20例进行研究如下。
1 资料与方法
1.1 一般资料 选取2013年1月至5月在我科就诊的DNS初发患者。按照DNS诊断标准:1、有明确的急性一氧化碳中毒昏迷史。2、有明确的假愈期。3、临床表现以精神症状及锥体外系症状为主。4、头颅CT为两侧大脑半球白质及基底节区对称性低密度改变,MRI 为相应区域等或长T1、长T2信号。同时排除:1、既往有脑血管疾病、脑肿瘤及其他脑部合并症。2、既往有可导致意识障碍,功能受限的其他系统性疾病。3、不愿入组参加研究,拒绝签署知情同意书的。根据以上原则随机选取20名入组,其中12名男性,8名女性,年龄25~67岁,平均年龄(51.2+11.2)岁。入组患者均为家庭煤气中毒,具有昏迷史,假愈期平均(16.8±8.6)天。
1.2 治疗方法 所有患者均于DNS加重期入院,短期内病情表现逐渐加重至最严重状态。对所有患者应用脑血管活化、神经营养药物,使用高压氧、康复训练等综合恢复性治疗,对部分出现持续肌张力增高或精神严重异常患者实行对症药物治疗。
1.3 仪器设备和软件 使用我院核磁共振室GE公司的Signa excite 3.0T磁共振机,应用该公司配套的Advantage workstation工作站,使用GE healthcare工作站图像后处理软件进行检查。
1.4 检查时间 于DNS病情加重期至最重状态时间段以及治疗1月后临床症状有所改善时间段进行分别检测。
1.5 检查方法 定位灯的垂线和被检查者的矢状面平行,水平线平行两内眦连线,以听眦线为基线。扫描由资深磁共振专业医师专人完成,所有患者前后两次扫描参数保持一致。DTI选择在T2像可显示基底节区平面,于双侧额叶、颞叶和基底节区对称部位,共取六个1×1cm2区域,利用软件计算ADC和FA值。前后两次检查选取位置保持一致。MRS感兴趣区选择位于额叶的白质损害区,体积为1.5×1.5×1.5cm3,避免邻近骨、脑脊液等组织干扰。前后两次扫描感兴趣区位置选择一致。MRS根据工作站图像处理软件计算结果,记录NAA、Cho、Cr值。
1.6 临床功能评分 在核磁检查同期,前后不超过3天,选择上午患者清醒时间,在病房对患者进行MMSE智能量表和ADL生活能力量表检测。ADL量表有患者不能当场配合的,由患者陪护家属告知患者具体可完成情况。
1.7 统计学处理 用SPSS18.0版本统计软件包-处理,数值以均数标准差形式(X ±s)表示,前后数据用配对t检验,以P<0.05为具有显著性差异。
2 结 果
病情最重时M M S E平均评分为(3.1±2.3),治疗后为(8.9±4.7),有明显差异(P<0.05),病情最重时ADL平均评分为(18.0±9.1),治疗后为(26.0±16.3),有明显差异(P<0.05)。DTI选择观察表观弥散系数(a p p a r e n t diffusion coefficient,ADC)值和各向异性分数(fractionalanisotropy,FA)值,两者均无明显变化(P>0.05)。MRS选择观察N-已酰天门冬氨酸(N-acetyl aspartate,NAA)、胆碱化合物(choline,Cho)、肌酸/磷酸肌酸(creatine,Cr)三项,结果处理为NAA/Cr、Cho/Cr。NAA/Cr治疗后明显升高(P<0.05),Cho/Cr无明显变化(P>0.05)。具体结果见表1、表2、表3(*:P<0.05)。
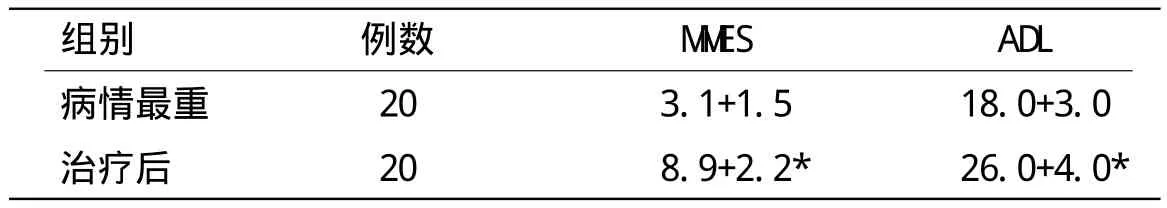
表1 治疗前后MMES、ADL结果比较
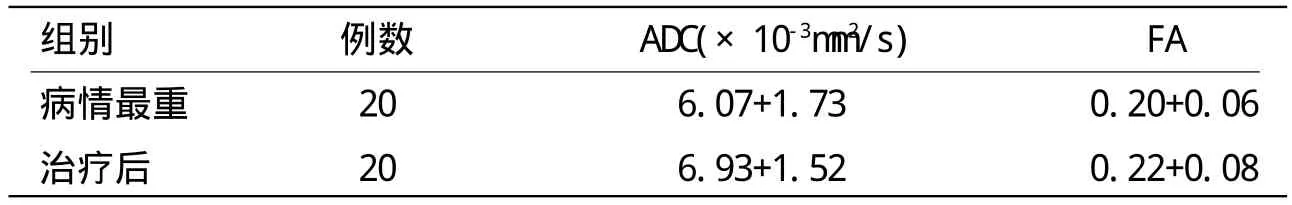
表2 治疗前后DTI结果比较

表3 治疗前后MRS结果比较
3 讨 论
DNS作为一种常见一氧化碳中毒相关中枢神经并发症,以其高发性、难治性成为CO中毒最严重并发症之一。由于大脑的功能特性使得CO中毒造成的缺氧对其造成的损伤较其它组织更加严重[3],并且由于缺氧导致的脑细胞凋亡、免疫炎性损伤、血管及循环因素机制、CO/NO信号转导机制等[4-6],使得脑组织受到继发性损伤。DNS多发生于首次临床治愈后的几周假愈期内[7]。DNS可造成意识障碍、认知障碍及运动障碍,极易导致患者结束治疗后甚至终生生活不能自理,丧失劳动能力[8],给患者自身及其家属造成沉重的经济和精神负担。但目前对于DNS的研究尚处于初级阶段,许多问题尚未厘清[9]。
MMSE和ADL能够对DNS患者的智能水平及行动能力进行客观准确的评估。DTI通过在三维空间内定时定量地分析组织内水分子弥散特性,能在活体显示脑白质纤维束的走行、方向、排列、髓鞘等信息,对DNS白质损害的评价具有良好的优越性[10]。MRS在脑内主要可检测的化合物包括N-已酰天门冬氨酸(N-acetyl aspartate,NAA)、胆碱化合物(choline,Cho)、肌酸/磷酸肌酸(creatine,Cr)、谷氨酸类化合物(glutamate,Glx)、乳酸(lactate,Lac)以及移动脂肪(lipds,Lip)等。NAA由神经元的线粒体产生,是神经元密度及活力的标志,NAA峰及NAA/Cr比值提示线粒体活力及功能性神经元情况。Cho含于神经胶质细胞中,参与细胞膜的合成和降解,Cho峰及Cho/Cr比值提示神经纤维细胞膜合成功能的变化[11]。本研究通过对患者最危重期和治疗后两阶段行MMSE和ADL评分及DTI、MRS检查观察相关变化,确定DTI、MRS对于DNS预后的判断作用。
通过研究,我们发现通过高压氧等综合支持治疗后,MMSE和ADL评分均有明显提高,这说明以高压氧疗为主的综合疗法,对于DNS患者的智能和行动能力恢复有明确作用。
但本研究中DTI结果前后无明显差异,提示在DNS患者,症状最重的时期和好转期虽然病情发生变化,但脑白质纤维髓鞘损伤并未出现明显修复。有研究发现,DNS患者大脑白质脱髓鞘、细胞毒性水肿的持续时间超过3个月,而白质纤维功能和结构的恢复至少需要5个月[12]。说明症状改善并非因髓鞘损伤修复造成,有其他更深层次的原因。
本研究中,Cho/Cr两次检查前后无明显差异,提示髓鞘修复无明显增强,与DTI结果可以互相印证。而NAA/Cr前后出现了明显差异(P<0.05),提示治疗后神经元功能和活力得到增强,与临床症状功能评分结果方向一致。据此可以说明DNS患者症状改善的机制并非是髓鞘损伤的再修复,而是神经元功能的活性增强。
综合本研究结果可知,MRS检测数据中NAA/Cr在治疗后明显升高,以MMES测定的患者认知功能、精神状况在治疗后明显改善,以Barthel指数对ADL进行评定的患者行动能力在治疗后也明显改善,因而可以认为NAA/Cr能够反映患者精神状况、认知及行动能力的变化,MRS对于DNS预后具有预测价值。在所选取DTI检测项目ADC值和FA值,MRS检测项目NAA/Cr、Cho/Cr等四组项目中,仅观察到NAA/Cr一组数据在治疗前后有明显升高,其它几组均未呈现统计学意义。樊中营等[13]对34例DEACMP患者行MRS检查,患者波谱数据与对照组比较Cho/Cr升高,NAA/Cr降低。DEACMP组与正常对照组NAA/Cr,Cho/Cr差异有统计学意义。这与我们观察到的结果相吻合。
尽管本研究还存在诸多不尽人意之处,但综合本次结果及结合国内外研究[14-16],表明我们通过DTI、MRS及MMSE和ADL评分结合,对DNS进行诊断及预后评估的思路是可行的,也是对于评估DNS病情体系中的核心性研究,因而我们将继续不断完善研究方法及思路,进行更进一步探索和研究。
1.Lee W K, Yu Z H, Lee C C.Delayed neurological sequelae after carbon monoxide poisoning[J].Aust NZJ Psychiatry, 2008, 42: 430-433.
2.王凌玲,石静萍,刘文,等.CO中毒后迟发性脑病的临床与磁共振表现[J].临床神经学杂志,2004,17(1):4445-4447.
3.何西钢,徐东.急性一氧化碳中毒后迟发性脑病的发病机制及治疗进展[J].山东医学高等专科学校学报,2009, 31(1): 44-46.
4.Guan L, W en T, Zhang Y, et a1.Induction of heme oxygenase-1 with hemin attenuates hippocampal injury in rats after acute carbon monoxide poisoning[J].Toxicology, 2009, 262(2): 146-152.
5.Thom SR, Bhopale VM, Han ST,et a1.Intravascular neutrophil activation due to carbon monoxide poisoning[J].Am J Respir Crit Care Med,2006,174(11):1239-1248.
6.王伯良,仲月霞,曹义战,等.纳洛酮对急性一氧化碳中毒患者血浆一氧化氮、内皮素含量的影响[J].中华急诊医学杂志, 2005, 14(10): 853-855.
7.Song I U, Chung S W.Chorea as the first neurological symptom of delayed encephalopathy after carbon monoxide intoxication[J].Internal Medicine, 2010, 49(11): 1037-1039.
8.Sahni T, Jain M.A Case of Neuropsychological Sequelae of Carbon Monoxide Poisoning Treated with Hyperbaric Oxygen Therapy[J].Apollo Medicine,2011, 8(1): 57-60.
9.Weaver L K.Carbon monoxide poisoning[J].New England Journal of Medicine, 2009, 360(12):1217-1225.
10.王海燕,赵斌.颅脑磁共振弥散张量成像应用进展[J].医学影像学杂志,2005,15(10): 908-911.
11.孙素杰,李素红,荆爱霞.基底节区异常信号的MRI鉴别诊断及临床价值[J].中国中西医结合影像学杂志,2008, 6(3): 167-170.
12.Terajima K, Igarushi H, Hirose M, et a1.Serial assessments of delayedencephalopathy after carbon monoxide poisoning using magnetic resonance spectroscopy and diffusion tensor imaging on 3.0T system[J].Ear Neurol,2008, 59(1/2): 55-61.
13.樊中营,罗福成,汪青松.急性一氧化碳中毒后迟发性脑病氢质子波谱学研究[J].中国医学影像技术,2008,24 (11):1708-1710.
14.Karalliedde L, Keshishian C.Carbon monoxide poisoning[J].Essentials of Toxicology for Health Protection: A Handbook for Field Professionals, 2012:157-160.
15.吴朋,吕国士,韩峰.DWI、DTI及DTT对药物过敏中毒性脑病的诊断及预后评估价值[J].中国CT和MRI杂志,2013, 11(1): 26-29.
16.Ku H L, Yang K C, Lee Y C, et al.Predictors of carbon monoxide poisoning-induced delayed neuropsychological sequelae[J].General hospital psychiatry,2010, 32(3): 310-314.

