白酒细菌酒曲固态培养条件下B.subtilis S12产四甲基吡嗪的合成机制
吴建峰 , 徐 岩
(1.江南大学,生物工程学院/工业生物技术教育部重点实验室,江苏 无锡 214122;2.江苏今世缘酒业股份有限公司,江苏 涟水 223411)
四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪(1igustiazine),是中药川芎治疗心脑血管疾病的有效成分之一,临床上已广泛应用于治疗缺血性心脑血管疾病及慢性心衰、肾衰等并且取得了良好的疗效。从1962年第一次报道通过微生物法生产吡嗪类物质开始[1],科研工作者就开始了吡嗪类物质合成机制的探索。到目前为止,关于吡嗪类物质的合成机制主要有两种:(1)对于烘焙食品,吡嗪类物作为风味物质,主要由糖和氨基酸类物质通过美拉德反应形成[2-5]。在烘焙过程中,所用基质中的pH环境和不同的氨基酸源对吡嗪类物质的合成与积累有重要的影响[6];(2)对通过微生物法来合成吡嗪类物质过程,由于发酵状态的不同,其生产功能机制有比较大的差异:对液态发酵生产吡嗪类物质来讲,微生物通过代谢调控积累3-羟基丁酮和外加铵盐来提高四甲基吡嗪的含量,并提出了四甲基吡嗪的代谢途径[7-9];而对通过微生物固态发酵生产四甲基吡嗪机制的研究却进展缓慢,虽然有很多传统发酵食品利用固态发酵法提高产品中吡嗪类物质的含量[10],并且发现发酵后加热温度对吡嗪类物质的含量影响很大[11],但是对通过发酵法生产包含四甲基吡嗪在内的吡嗪类物质的研究主要集中在通过优化发酵条件来提高产量[8],对吡嗪类物质的形成机制研究较少,目前研究较清楚的是我国的酿醋工艺,其研究表明加热、煎煮条件下和陈化过程所发生的美拉德反应是香醋中川芎嗪主要来源[12]。
白酒酿造不仅是一个典型的固态发酵过程,而且是一个开放式的高温过程:从制曲、堆积到入池发酵,各个环节都有大量微生物的参与,在工艺上,无论是酱香型酒还是芝麻香型酒,都存在高温制曲和堆积过程,如果此过程温度偏低,酒体中吡嗪类物质含量下降,说明提高温度有利于吡嗪类物质的产生。但是,在制曲过程中,自然状态下最高温度也只有60℃左右,而Maillard反应产生吡嗪类物质的的最佳温度在120~180℃[13]。因此,关于白酒中吡嗪类化合物是否通过美拉德反应来产生仍是一个颇有争议的话题[14]。前期研究结果表明:在酿造的不同阶段,细菌曲中TTMP含量最高。由于细菌曲是多菌种混合发酵过程,为简化研究模型,作者以细菌曲中分离到的高产四甲基吡嗪菌株B.subtilis S12为研究对象,通过用单一的B.subtilis S12模拟细菌曲培养过程,来实现探索TTMP合成机制的目的。
1 材料与方法
1.1 主要试剂
2,3,5,6-四甲基吡嗪(2,3,5,6-tetramethylpyrazine),3-羟基丁酮 (3-hydroxy-2-butanone),2-乙酰基吡啶(2-acetylpyridine),庚酮(heptanone)均为色谱纯,美国Sigma Aldrich公司产品;谷氨酸、苯丙氨酸、酪氨酸、亮氨酸、苏氨酸、乙醇和氯化钠:均为分析纯,国药集团化学试剂有限公司(上海)产品。
1.2 菌种
B.subtilis S12:作者所在本实验室筛选并保藏。
1.3 培养基
营养肉汤培养基:牛肉膏5 g,蛋白胨10 g,氯化钠 5 g,加水至 1 000 mL,pH 调至 7.2,于 121℃湿热灭菌20 min。
斜面培养基:葡萄糖5 g,蛋白胨10 g,牛肉膏5 g,氯化钠 5 g,加水至 1 000 mL,pH 调至 7.2,于121℃湿热灭菌20 min。
麸皮固体培养基:麸皮 700 g,花生米粉 300 g,加水1 000 mL,混匀分装后121℃湿热灭菌20 min。
1.4 培养条件
种子液培养条件:从新鲜斜面上挑取一环菌落至营养肉汤培养基中 (每100 mL摇瓶装 20 mL培养基),于 37℃、150 r/min下培养24 h。
发酵培养条件:将培养好的种子液,按体积分数2%的接种量接入麸皮固体培养基(每250 mL摇瓶装 50 g培养基)中,37℃下培养48 h。
1.5 3-羟基丁酮及TTMP的提取
称取5 g样品,加入50 mL体积分数12%的乙醇,浸泡10 min,再超声波处理30 min,离心,收集上清。吸取5 mL提取液到15 mL顶空瓶中,加入1.5 g NaCl和 1 μL 的庚酮(内标),混匀,50 ℃下萃取40 min,通过气相色谱-质谱仪进行3-羟基丁酮和四甲基吡嗪质量分数的测定,每个样品重复3次。
1.6 粗酶液的制备
将枯草芽孢杆菌S12接种于牛肉膏蛋白胨培养基中,37℃、150 r/min培养。取培养24 h的发酵液,8 000 r/min冷冻离心15 min,上清液作为胞外粗酶液。收集上述发酵液离心所得的菌体,生理盐水洗涤两次后,将其悬浮于0.2 mol/L PBS缓冲(pH 7.2)中,超声波破碎。破碎条件为:功率300 W,破碎时间8 min,冰水浴环境,工作2 s停4 s。将破碎液12 000 r/min离心15 min,取上清液作为胞内粗酶液。
1.7 分析方法
1.7.1 3-羟基丁酮和TTMP含量测定 3-羟基丁酮和四甲基吡嗪含量采用GC-MS进行测定,参照优化后的文献方法[15],进样口温度为250℃,He为载气,流量为1 mL/min。程序升温:50℃恒温2 min,以10℃/min的速度升温至230℃,保持15 min。EI电离源,温度为220℃,电子能量70 eV,扫描范围50~500。通过建立3-羟基丁酮和四甲基吡嗪的标准曲线,进行定量分析。
1.7.2 蛋白酶活力测定 蛋白酶活力测定参照文献方法[16]。称取2.5 g样品,加入50 mL缓冲液(乳酸缓冲液pH 3.0;磷酸缓冲液pH 7.5;硼砂缓冲液pH 10.5),在40℃水浴中浸出30 min,离心,收集上清液。准确吸取酶浸出液1 mL,注入10 mL离心管中(一式3份),在(40℃)水浴中预热5 min,准确加入体积分数2%酪蛋白溶液1 mL,计时,保温10 min,立刻加入2 mL 0.4 mol/L三氯醋酸,以沉淀多余的蛋白质,中止反应。15 min后离心分离(或过滤)。准确吸取上层清夜1 mL,注入试管中加入5 mL 0.4 mol/L碳酸钠溶液和1 mL Folin试剂,摇匀,在40℃水浴加热20 min显色。以空白试液为对照,在680 nm波长下测定试样的光密度,取3次平均值。
酶活力定义为:1 g绝干样品,在一定温度和pH值条件下,1 min水解酪素产生1 μg酪氨酸为一个酶活力单位。
1.7.3 氨基酸脱氢酶活力测定 L-谷氨酸脱氢酶活力测定[17]:以NAD+为辅酶测定GDH酶活性测定反应体系为:6 mmol/L NAD+,100 mmol/L谷氨酸,160 mmol/L 甘 氨 酸 ,1.8 mol/L NaCl,4.2 mmol/L EDTA,pH 9.0。测定GDH催化辅酶NAD+还原所引起的光吸收值在340 nm波长处的变化。每分钟催化1 μmol NAD+还原所需的酶量定义为一个酶活力单位(U)。单位酶活=酶活/蛋白浓度。
苯丙氨酸脱氢酶[18]:反应体系为:200 μL 粗酶液加入到2 mL 20 mmol磷酸缓冲液(含0.1 mol苯丙氨酸,pH 7.0),反应5 min后,取1.5 mL混合液,加入1.5 mL质量分数1%FeCl3,614 nm处测定吸光值变化。每分钟催化1 μmol苯丙氨酸所需的酶量定义为一个酶活力单位(U)。
1.7.4 氨(铵)质量分数的测定 样品中铵(氨)质量分数的测定参照弓晓峰等[19]的方法。称取1 g固体样品于三角瓶中,加入质量分数20%NaCl溶液10 mL,振荡30 min后,离心。吸取50 μL上清液液于25 mL比色管中,加水稀释至20 mL左右后,加入1 mL酒石酸钾钠溶液,1.5 mL质量分数20%NaOH溶液,充分摇动,静置15 min后加入0.5 mL纳氏试剂,边加边摇动,然后定容至刻度。一段时间后用分光光度计于390 nm处测定吸光度。
2 结果与讨论
2.1 固态条件下Maillard反应对TTMP合成贡献率分析
关于TTMP的合成目前有两种机制:(1)葡萄糖和氨基酸通过Maillard反应可以产生吡嗪类物质[20];(2)3-羟基丁酮和铵盐通过化学反应能够产生TTMP,且提高温度利于反应的正向进行[21]。
在细菌曲培养过程中,微生物生长代谢产生大量的热量,如果不进行控温,温度能达到近60℃,而美拉德反应在60℃即可以进行。作者以细菌曲培养模式作为研究对象,以产TTMP含量最高的菌株B.subtilis S12为对照,对固态制曲阶段TTMP合成是否主要以Maillard反应生成进行研究。实验分为3组,第一组在麸皮培养基中添加葡萄糖和氨基酸、第二组在麸皮培养基中添加葡萄糖和磷酸氢二铵,第三组中只接种枯草芽孢杆菌S12,作为对照。3组实验分别于37℃(48 h)和 37~60℃培养(37℃培养24 h后,60℃继续培养24 h),测定TTMP质量分数,结果如图1所示。
根据结果可知,在只加葡萄糖和氨基酸的实验组中TTMP质量分数非常低:在37℃和37~60℃两种培养模式下TTMP质量分数分别为1.8 mg/kg和2.1 mg/kg;葡萄和磷酸氢二铵实验组TTMP质量分数分别为 2.4 mg/kg和 2.3 mg/kg。而在接种 B.subtilis S12后培养产生的TTMP质量分数高达65.4 mg/kg和319.73 mg/kg,分别是葡萄糖和氨基酸组的36倍和152倍。这表明在此培养过程和温度条件下,通过单纯的Maillard反应产生的TTMP质量分数很低,即此过程中TTMP的合成主要产生途径不是Maillard反应的结果。

图1 不同基质对TTMP产生的影响Fig.1 Effect of ground substance on TTMP synthesis
3-羟基丁酮和铵合成TTMP的时主要通过添加外加铵盐的方式来强化四甲基吡嗪的合成[22-24],这就是目前关于TTMP合成的另外一种途径:液态发酵条件下细菌在发酵过程中首先要代谢产生TTMP的前体物质3-羟基丁酮[25],然后3-羟基丁酮和铵盐反应生成TTMP[26-27]。测定了B.subtilis S12固态培养条件下,随温度和培养时间3-羟基丁酮质量分数变化情况,结果如图2所示。由图2可知,随着培养的进行,3-羟基丁酮质量分数逐步上升,在24 h左右达到最大值,最高质量分数达到7.5 g/kg(37℃)。此外,不同温度下,37℃时3-羟基丁酮质量分数最大,随着温度的升高,3-羟基丁酮合成量逐渐下降,当温度达到60℃时,细菌基本不生长,几乎检测不到3-羟基丁酮质量分数变化。值得注意的是:24 h后℃呈下降趋势,这主要由于一部分3-羟基丁酮合成了TTMP,同时3-羟基丁酮可在2,3-丁二醇脱氢酶作用下还原成2,3-丁二醇[28]。因此,如果可以在曲中发现氨(铵离子),并且能证明3-羟基丁酮和氨基酸不能反应生成TTMP,就可以证明细菌曲中TTMP的形成应该主要是通过3-羟基丁酮和氨(铵盐)缩合而形成。

图2 不同培养温度下3-羟基丁酮质量分数变化Fig.2 Content of 3-hydroxy-2-butanone at different temperature
2.2 制曲过程中TTMP合成时曲中N源的存在形式及其来源
前期我们对酿酒各阶段中吡嗪类物质的变化规律发现,同一培养温度下,多粮曲中四甲基吡嗪含量明显高于纯小麦曲,推测这主要是多粮曲中添加了豌豆,提高氮质量分数的结果。Besson和Larroche等人[29-30]通过在培养基中外加氨基酸和铵盐的方式来提高发酵产吡嗪类物质的含量。为了研究TTMP合成中N的掺入方式,以3-羟基丁酮为底物(20 mg/mL),分别与氨基酸和铵盐(磷酸氢二铵)(30 mg/mL)作用,在37℃和60℃下反应1 h,检测TTMP质量分数。
图3显示,在37℃和60℃条件下,3-羟基丁酮和氨基酸反应后几乎检测不到TTMP,3-羟基丁酮和铵盐反应后TTMP吡嗪质量分数分别为17.8 μg/mL和516.7 μg/mL,这说明在此温度条件下,3-羟基丁酮和氨基酸反应不能产生四甲基吡嗪,而是和铵盐(磷酸氢二铵)反应产生TTMP。

图3 氮源对TTMP合成的影响Fig.3 Effect of nitrogen source on the synthesis of TTMP
从图4可知,随着曲堆积时间的增加,曲中氨的浓度逐渐增加,在37℃条件下,氨质量分数高达12 g/kg,但是60℃条件下最高质量分数在25 h左右获得,质量分数为4.5 g/kg。该结果表明:曲中存在高质量分数的氨物质。在制曲过程中没有添加外源的氨源,因此氨的来源只能由细菌代谢产生。
因此,作者提出一个假设:细菌应该是以氨基酸为底物通过脱氨作同获得氨,然后游离态氨与3-羟基丁酮反应进而合成TTMP。这就需要验证两个过程的存在:(1)B.subtilis S12固态培养过程中将蛋白分解为氨基酸残基;(2)氨基酸残基在 B.subtilis S12合成的脱氨酶的作用生成氨。

图4 枯草芽孢杆菌S12培养过程氨质量分数变化Fig.4 Changing profile of ammonia in bacterial qu cultured with B.subtilis S12
为验证以上假设的正确性,作者对B.subtilis S12的蛋白酶及氨基酸脱氢酶的酶活性进行了测定。B.subtilis S12的蛋白酶活性的分析结果结果如图5所示。从图5可知,在37℃条件下,B.subtilis S12的碱性蛋白酶活力最高,每克样品中活力达到464.36 U,其次是中性蛋白酶(383.04 U/g),酸性蛋白酶活力最低(114.76 U/g)。这表明B.subtilis S12固态培养过程中存在着高浓度的蛋白酶,用于实现将蛋白和肽段水解成氨基酸残基。此外,与37℃相比,经60℃作用后,蛋白酶活力明显降低,碱性蛋白酶活力仅为37℃下的21.9%,中性和酸性蛋白酶活力也相应的降低。这说明60℃高温下,B.subtilis S12的蛋白酶活性受到抑制。

图5 枯草芽孢杆菌S12蛋白酶活力Fig.5 Protease activity of B.subtilis S12
由于在对培养基中氨基酸质量分数进行测定时发现苯丙氨酸和谷氨酸质量分数较高,因此,作者主要测定了苯丙氨酸和谷氨酸脱氢酶活性,结果如图6所示。根据实验结果可知,37℃下谷氨酸脱氢酶和苯丙氨酸脱氢酶活性分别为209 U/mg和161 U/mg,而60℃下脱氢酶活性很低,说明高温下酶的活性受到抑制。此外,通过测定B.subtilis S12培养过程中铵(氨)质量分数发现,前期铵(氨)积累很少,18 h后开始大量合成,当24 h后改为60℃培养,铵(氨)质量分数变化不大,这主要是酶活受到抑制所致。
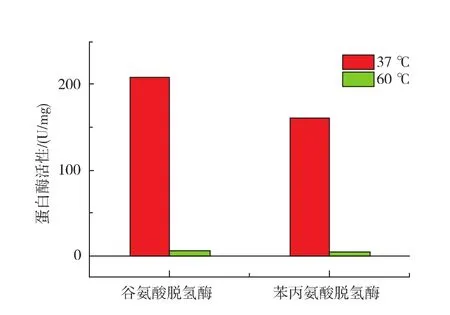
图6 不同温度下氨基酸脱氢酶活性Fig.6 Activity of amino acid dehydrogenase at 37℃and 60℃
结果证明:B.subtilis S12固态培养过程中首先将蛋白分解为氨基酸残基,然后在B.subtilis S12分泌的脱氢酶作用下将氨基酸脱氢生成氨,进而为TTMP的合成提供了充足的N源。
2.3 TTMP合成热反应研究
上述研究结果发现,B.subtilis S12固态培养过程中四甲基吡嗪是微生物代谢产物3-羟基丁酮和氨缩合反应而成。但是可以明显地发现:高温能明显强化3-羟基丁酮和氨缩合产生TTMP,这是否表明:3-羟基丁酮和氨的缩合反应是化学缩合反应,而不是微生物及酶参与的酶催化反应呢。为此,以3-羟基丁酮和铵为底物,分别在不同温度下反应,研究温度对TTMP含量的影响,结果如图7所示。
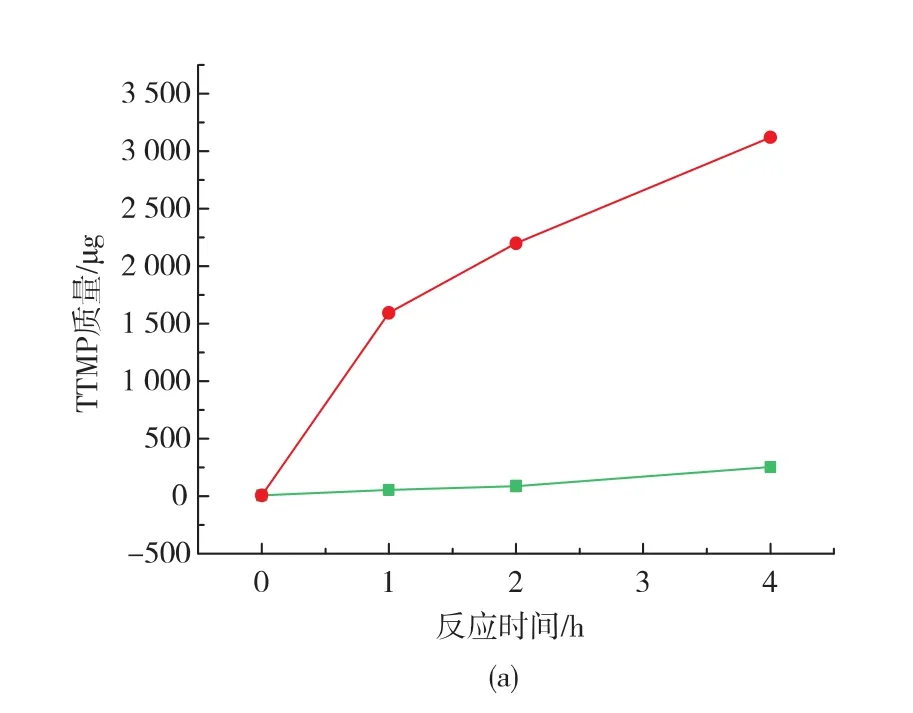

图7 温度对TTMP合成的影响Fig.7 Effect of temperature on TTMP synthesis
由图7可知,随着时间的延长,TTMP质量分数呈增加趋势。37℃时,TTMP质量分数增加很慢,4 h后质量分数增加了245.34 μg;60℃作用下,TTMP反应速率很快,1 h后达到1 594.28 μg,随后反应速率逐渐下降,反应4 h后四甲基吡嗪质量分数是37℃下的12倍,说明3-羟基丁酮和铵离子通过非酶反应就可以合成TTMP,且高温下合成速率加快。
以上结果表明:在B.subtilis S12固态培养过程中,葡萄糖和氨基酸不能直接通过Maillard反应合成TTMP,需经微生物的代谢,在酶的作用下产生前体物质3-羟基丁酮和氨,再进一步缩合反应生成TTMP,缩合反应是一热力学反应。
因此,B.subtilis S12发酵中TTMP的合成是由酶与热动力学反应联合作用的结果,即:第一阶段,微生物生长代谢过程中,在一系列酶的作用下产生3-羟基丁酮和氨;第二阶段,3-羟基丁酮和氨进一步缩合生成四甲基吡嗪,此阶段为热力学反应,高温利于反应的进行。根据该结论,作者对TTMP的合成途径进行了构建如图8所示。
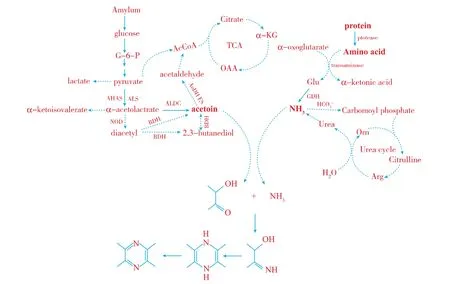
图8 TTMP的酶/热动力学耦合催化合成过程Fig.8 Synthesis of TTMP base on enzyme and thermo-kinetics coupling
2.4 B.subtilis S12产TTMP的原位反应验证
上述结果显示:3-羟基丁酮质量分数在24 h达到最大值,同时氨质量分数在18~24 h也有明显的增加。因此在B.subtilis S12培养过程中,选择前24 h为37℃培养用于实现前体物质的积累;24 h后提高温度,用于加快前体物质的缩合反应,结果如图9所示。由图9可知:前24 h TTMP质量分数变化很少,24 h后TTMP开始逐步合成;且温度越高,TTMP生成速度越快,合成量越多;60℃下TTMP质量分数为307.99 mg/kg,是37℃下的5倍。在前期对菌株的生理生化实验发现,B.subtilis S12在60℃时不能生长,如果3-羟基丁酮到TTMP合成是酶促,60℃下TTMP质量分数应该较37℃低。因此,这也进一步说明了B.subtilis S12培养过程中,3-羟基丁酮和氨缩合成TTMP过程为非酶反应。

图9 温度对B.subtilis S12中TTMP合成的影响Fig.9 Effect of temperature on TTMP production of B.subtilis S12
3 结 语
研究表明B.subtilis S12固体培养温度下,以葡萄糖和氨基酸为底物通过Maillard反应不能产生四甲基吡嗪,3-羟基丁酮和氨基酸不能合成四甲基吡嗪,只有3-羟基丁酮和氨相互作用才能合成四甲基吡嗪。
在固态发酵条件下,Bacillus subtilis S12代谢产生3-羟基丁酮,分泌蛋白酶将蛋白质降解为氨基酸,并在氨基酸脱氢酶(如谷氨酸脱氢酶和苯丙氨酸脱氢酶)将氨基酸脱氢得到氨,实现氨基酸到氨的转化,氨和3-羟基丁酮通过缩合作用合成四甲基吡嗪,因此氨基酸脱氢酶是合成TTMP的关键酶。
固态条件下四甲基吡嗪的合成为两阶段酶/热力学联合作用过程:在第一阶段在全细胞催化下细菌利用底物合成四甲基吡嗪的前提物质3-羟基丁酮,在氨基酸脱氢酶作用下生成氨;第二阶段3-羟基丁酮和氨在热动力作用下生成四甲基吡嗪。其中温度对第二阶段TTMP合成影响很大,高温利于反应的进行。
[1]Kempler G.Production of flavor compounds by microorganisms[J].Adv Appl Microbiol,1983,29:29-51.
[2]Koehler P E,Mason M E,Newell J A.Formation of pyrazine compounds in sugar-amino acid model systems[J].Journal of Agricultural and Food Chemistry,1969,17(2):393-396.
[3]Amrani-Hemaimi M,Cerny C,Fay L B.Mechanisms of formation of alkylpyrazines in the Maillard reaction[J].Journal of Agricultural and Food Chemistry,1995,43(11):2818-2822.
[4]Koehler P E,Odell G V.Factors affecting the formation of pyrazine compounds in sugar-aminereactions[J].Journal of Agricultural and Food Chemistry,1970,18(5):895-898.
[5]Bemis-Young G L,Huang J,Bernhard R A.Effect of pH on pyrazine formation in glucose-glycine model systems[J].Food Chemistry,1993,46(4):383-387.
[6]Wong J M,Bernhard R A.Effect of nitrogen source on pyrazine formation[J].Journal of Agricultural and Food Chemistry,1988,36(1):123-129.
[7]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].Journal of Industrial Microbiology&Biotechnology,2010,37(8):815-821.
[8]ZHU B F,XU Y.A feeding strategy for tetramethylpyrazine production by Bacillus subtilis based on the stimulating effect of ammonium phosphate[J].Bioprocess and Biosystems Engineering,2010,33(8):953-959.
[9]Selamat J,Harun S M.Formation of methyl pyrazine during cocoa bean fermentation[J].Pertanika Journal of Tropical Agricultural Science,1994,17(1):27-32.
[10]Rodriguez-Campos J,Escalona-Buendía H,Contreras-Ramos S,et al.Effect of fermentation time and drying temperature on volatile compounds in cocoa[J].Food Chemistry,2012,132(1):277-288.
[11]贺铮怡,敖宗华,吴珏,等.镇江香醋中川芎嗪的测定及生成机理的研究[J].中国调味品,2004,2:36-39.HE Z Y,AO,Z H,WU Y,et al.Study on the mensuration of tetramethylpyrazine in zhenjiang vinegar and its generant mechanism[J].China Condiment,2004,2:36-39.(in Chinese)
[12]Müller R,Rappert S.Pyrazines:occurrence,formation and biodegradation[J].Applied Microbiology and Biotechnology,2010,85(5):1315-1320.
[13]庄名扬,王仲文,孙达孟,等.美拉德反应与酱香型白酒[J].酿酒,1999,4:42-47.ZHUANG M Y,WANG Z W,SUN D M.Maillard reaction and Maotai flavor liquor[J].Liquor Making,1999,4:42-47. (in Chinese)
[14]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011,7:37-39.XU Y,WU Q,FAN W L.The discovery&verification of the production pathway of tetramethylpyrazine (TTMP) in Chinese liquor[J].Liquor Making Science&Technology,2011,7:37-39.(in Chinese)
[15]沈怡方.白酒生产技术全书[M].中国轻工业出版社,1998.
[16]张影陆,范文来,姜文广,等.顶空固相微萃取法测定果酒中的挥发性成分[J].食品与生物技术学报,2008,27(6):115-120.ZHANG Y L,FAN W L,JIANG W G,et al.Determination of volatile compounds in fruit wine by Headspace Solid Phase Microextraction (HS-SPME) followed by Gas Chromatography-Mass Spectrometry (GC-MS)[J].Journal of Food Science and Biotechnology,2008,27(6):115-120.(in Chinese)
[17]陈丽丽,潘玉兰,张建华.纳豆芽孢杆菌谷氨酸脱氢酶基因的克隆,表达及酶活性测定[J].上海交通大学学报:农业科学版,2010,1:18.CHEN L L,PAN Y L,ZHANG J H.Gene cloning expression and enzyme activity assay of a Glutamate Dehydrogenase from Bacillus Subtilis Natto[J].Journal of Shanghai Jiaotong University:Agriculture Science,2010,1:18.(in Chinese)
[18]Massad G,Zhao H,Mobley H.Proteus mirabilis amino acid deaminase:cloning,nucleotide sequence,and characterization of aad[J].Journal of Bacteriology,1995,177(20):5878-5883.
[19]弓晓峰,张静,张振辉,等.纳氏试剂比色法测定土壤铵态氮的研究[J].环境科学与技术,2006,29(1):43-44.GONG X F,ZHANG J,ZHANG Z H,er al.Measurement of NH3-N in Soil with Nessler's Reagent Colorimetry[J].Environmental Science&Technology,2006,29(1):43-44.(in Chinese)
[20]Rizzi G P.The Strecker degradation and its contribution to food flavor.In:Flavor chemistry:Springer,1999:335-343.
[21]Rizzi G P.Formation of pyrazines from acyloin precursors under mild conditions[J].Journal of Agricultural and Food Chemistry,1988,36(2):349-352.
[22]CHEN J C,CHEN Q H,GUO Q,et al.Simultaneous determination of acetoin and tetramethylpyrazine in traditional vinegars by HPLC method[J].Food Chem,2010,122(4):1247-1252.
[23]Aungpraphapornchai P,Sangobpun N,Sopha P.Isolation of Lactic Acid Bacteria from Fermented Foods Which Have Potential for Tetramethylpyrazine Production[J].Srinakharinwirot Science Journal,2007,23(1):94-108.
[24]Hao F,Wu Q,Xu Y.Precursor supply strategy for tetramethylpyrazine production by bacillus subtilis on solid-state fermentation of wheat bran[J].Applied Biochemistry and Biotechnology,2013,169(4):1346-1352.
[25]Montville T J,Hsu A H-M,Meyer M E.High-efficiency conversion of pyruvate to acetoin by Lactobacillus plantarum during pH-controlled and fed-batch fermentations[J].Applied and Environmental Microbiology,1987,53(8):1798-1802.
[26]ZHU B,XU Y,FAN W.Study of tetramethylpyrazine formation in fermentation system from glucose by Bacillus subtilis XZ1124[J].New Biotechnology,2009,25:S237.
[27]HUANG T C,FU H Y,HO C T.Mechanistic studies of tetramethylpyrazine formation under weak acidic conditions and high hydrostatic pressure[J].J Journal of Agricultural and Food Chemistry,1996,44(1):240-246.
[28]XIAO Z,QIAO S,MA C,et al.Acetoin production associated with the increase of cell biomass in Bacillus pumilus ATCC 14884[J].Afr J Biotechnol,2010,18:1997-2003.
[29]Besson I,Creuly C,Gros J,et al.Pyrazine production by Bacillus subtilis in solid-state fermentation on soybeans[J].Applied Microbiology and Biotechnology,1997,47(5):489-495.
[30]Larroche C,Besson I,Gros J-B.High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J].Process Biochemistry,1999,34(6):667-674.

