复合改性改善大豆分离蛋白功能性质的研究
张亚婷, 张晓鸣
(食品科学与技术国家重点实验室/江南大学 食品学院,江苏 无锡,214122)
大豆分离蛋白(SPI)由于价格低廉、具有良好的营养价值,广泛应用于食品加工行业[1-3]。随着食品工业的发展,蛋白质的需求量大大增加,尤其是功能特性和营养特性高的蛋白质原辅料,更存在巨大的需求缺口。然而大豆分离蛋白功能特性相对较差,对加工条件(高温、pH等)敏感,很大程度限制了其在诸多食品体系的应用[2]。为此,加强或改善大豆分离蛋白的功能特性成为食品加工行业亟待解决的问题。乳化能力及气泡性能是大豆分离蛋白作为功能性食品添加剂的最重要功能特性之一。大豆分离蛋白乳化能力改性的主要方法包括物理法、化学法和酶法,其中化学法中的糖基化改性安全、简单,符合近年来人们对于绿色安全的天然食品添加剂的要求,成为近年研究的热点。蛋白分子上引入多糖后,分子间空间位阻加大,同时接枝物中蛋白质分子侧链具有一定的疏水性,使得接枝物能快速且紧密地吸附在油/水界面上,因而SPI的乳化活性得到提高,其他功能性也随着结构变化而相应改变[1]。酶法改性通过蛋白酶的作用使蛋白质的空间结构及其功能特性发生相应的改变。酶促反应由于效果显著、条件温和、一般不会导致营养方面的损失,也越来越多的受到人们的重视[4]。作者尝试将糖基化改性和酶法改性结合到一起,对大豆分离蛋白-麦芽糊精的接枝产物进一步酶解,优化了复合改性工艺条件,并对产物功能性质进行了研究。
1 材料与方法
1.1 材料与试剂
脱脂大豆粕:河南安阳漫天雪食品制造有限公司提供;麦芽糊精:山东保龄宝生物股份有限公司提供;中性蛋白酶:诺维信生物技术有限公司提供。
1.2 仪器与设备
恒温水浴锅:江苏省金坛环宇科学仪器厂提供;超级恒温水浴锅:上海一恒科技有限公司提供;T18高速均质分散机:德国IKA公司提供;DELTA 320 pH计:梅特勒-托利多仪器上海有限公司提供;UV-1600紫外可见分光光度:上海美谱达仪器有限公司提供;CF-16RXII冷冻离心机:日本日立有限公司提供;梅特勒AL204分析天平:梅特勒-托利多仪器上海有限公司提供。
1.3 实验方法
1.3.1 大豆分离蛋白的制备 参考文献[3]的方法,采用碱溶酸沉法制备大豆分离蛋白。称取一定量脱脂豆粕粉(粉碎过100目筛),按照 1∶15(蛋白质与去离子水质量比)溶于去离子水,充分搅拌混匀。用2 mol/L NaOH溶液调节pH至7.0,持续搅拌2 h。所得溶液用高速离心机8 000 g离心30 min,取上清液用2 mol/L HCL调节pH至4.6,持续搅拌2 h,8 000 g离心30 min,得到沉淀水洗,加入少量蒸馏水充分搅拌混匀,调节pH至中性,所得溶液冷冻干燥得到大豆分离蛋白,经凯氏定氮法测定,蛋白质质量分数为96.7%。
1.3.2 大豆分离蛋白-麦芽糊精糖基化产物制备将大豆分离蛋白与麦芽糊精按照不同的比例溶解于一定去离子水中,蛋白质质量分数为0.5%~60%,水浴条件下(70℃~90℃)反应一定时间(20~120 min),反应结束后迅速冰浴至室温,冷冻干燥制成干粉置于冰箱中备用。
1.3.3 游离氨基氮浓度的测定及接枝度的计算游离氨基氮浓度采用OPA法进行测定[5]。准确称取40.0 mg的OPA溶解于1.0 mL甲醇中,再加入质量分数20%的十二烷基硫酸钠(SDS)2.5 mL,硼砂(0.1 mol/L)25.0 mL,β-巯基乙醇 100 μL 最后用蒸馏水定容到50 mL。测定时,取4.0 mL OPA试剂于试管中,加入200 μL样品,混合均匀,放入 35℃水浴中反应 2 min后在 340 nm下测吸光值 A340,另取 4.0 mL OPA试剂于试管中,加入 200 μL去离子水作为空白对照。用相同的方法,以赖氨酸代替样品作标准曲线,根据曲线计算样品中自由氨基的浓度 A。
接枝度计算公式:
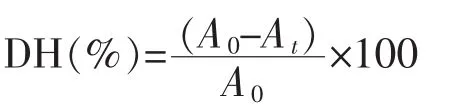
其中:A0为接枝反应前溶液中自由氨基的浓度,mol/L;At为接枝反应后溶液中自由氨基的浓度,mol/L。
1.3.4 大豆分离蛋白-麦芽糊精糖基化产物酶解物制备及水解度的测定 将大豆分离蛋白-麦芽糊精糖基化产物粉末溶于适量的去离子水,制备质量分数4%的蛋白质溶液,80℃条件下预热10 min然后调节溶液温度为54℃,pH为7.0。加入适量的中性蛋白酶进行酶解,计时25 min。通过加入0.5 mol/L氢氧化钠稳定酶解过程pH为7.0,记录碱液的消耗量。酶解结束80℃水浴加热10 min灭酶。实验通过控制不同加酶量制备不同水解度的酶解产物。采用pH-stat法[6]计算产物水解度,公式如下:
DH(%)=BNb(1/α)(1/Mp)(1/htot)×100
其中:B-水解过程中消耗 NaOH溶液的体积(mL);Nb-NaOH 溶液的浓度 (mol/L);α-α-氨基解离度;Mp-底物蛋白质浓度(g);htot-蛋白质中总的可被水解的肽键数。
1.3.5 复合改性产物乳化能力测定 参照Pearce&Kinsella[6]的方法进行改进。 取 12 mL 0.1%(w/v)待测样品蛋白液 (样品蛋白于0.2 mol/L pH 7.0磷酸缓冲液中),加入4 mL大豆色拉油(福临门,东海粮油集团),在10 000 rpm,25℃下高速均质1 min,分别在搅拌后 0、2、4、6、8、10 min 取样。以 0.1 g/dL SDS(pH 7.0)稀释50倍,测定500 nm处的吸光值,以SDS溶液为空白。乳化活性指标EAI的计算:

其中,A为测定的吸光度值;ψ为乳化液中油相的比例;L为比色杯光径;C表示蛋白质的初浓度;N为稀释倍数。
乳化稳定性(ES)用乳化稳定指数(ESI)表示:
ESI=A0×ΔT/(A0-At)
其中,A0,0 时刻的吸光值;At,t时刻的吸光值;ΔT,时间差。
1.3.6 复合改性产物气泡能力测定 参照郭凤仙[7]的方法,将一定浓度的SPI溶液20 mL置于100 mL量筒(口径6 cm,高为20 cm,实验室自制)中,使用高速乳化均质机以10 000 r/min的速度均质1 min,记录均质后液面高度记为V0,静置 30 min后记录液面高度,记为 V30。起泡能力(Foaming capacity)公式如下:

泡沫稳定性(Foaming stability)公式如下:
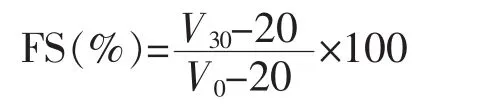
1.3.7 抗脂质氧化能力测定 抗脂质过氧化能力测定方法参见文献 [3]。将卵磷脂溶于0.01 mol/L、pH 7.4的磷酸缓冲溶液中配制成10 mg/mL的溶液(标记为 LLS)。 将三氯乙酸(15 g)、硫代巴比妥酸(0.37 g)、浓盐酸(2 mL)加入蒸馏水配成 100 mL 溶液,标记为TCA/TBA/HCl。试管中依次加入1 mL LLS、1 mL 400 μmol/L FeCl3、1 mL 样品溶液, 溶液置于37℃水浴中暗处放置60 min,加入2 mL TCA/TBA/HCl,在沸水浴15 min,取出冰水冷却,将粉红色溶液8 355 g离心10 min,取上清液测定532 nm下的吸光度值,空白用蒸馏水代替样品,抗氧化能力按式3-5计算:
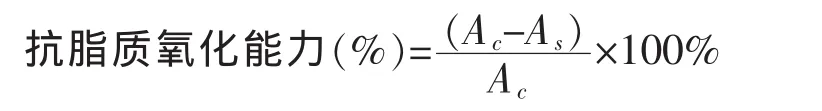
1.3.8 还原力测定 还原能力的测定参见文献[3],试管中顺序加入1.0 mL稀释后的样品溶液,1.0 mL、0.2 mol/L、pH 6.6 的磷酸盐缓冲液和 1.0 mL、1.0 g/dL 的 K3Fe(CN)6溶液,均匀混合,50 ℃下保温20 min后快速冷却,加入三氯乙酸(10 g/dL)溶液1.0 mL,混合均匀后以2 089 g离心10 min。取上清液1.0 mL,加入1.0 mL蒸馏水和1.0 mL 0.1 g/dL的FeCl3,混合均匀,静置10 min,以700 nm处的吸光度表示样品的还原能力,以蒸馏水代替铁氰化钾作为空白。
1.3.9 DPPH自由基清除能力 清除DPPH自由基能力的测定方法见参考文献[3],准确吸取适当稀释的MRPs 1.0 mL,加入2.0 mL 0.1 mmol/L DPPH甲醇溶液均匀混合后室温暗处放置20 min,2 089 g离心10 min,取上清液测定517 nm处的吸光度值,空白以蒸馏水代替样品,对照以甲醇代替DPPH,DPPH自由基清除能力按式3-3计算:
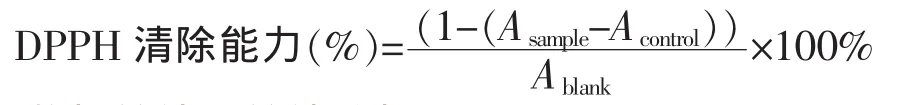
1.4 数据统计及统计分析
对于大豆分离蛋白与麦芽糊精在某一条件上进行研究时,反应的其它条件均相同。所有实验均进行三次平行实验,所得数据应用SPSS软件进行方差分析和差异显著性分析。
2 结果与分析
大豆分离蛋白-糖的接枝反应受很多因素影响,如蛋白/糖的比例、反应浓度、反应温度、反应时间等,接枝反应的程度及接枝物的性质,是多种因素共同作用的结果。
2.1 大豆分离蛋白糖基化反应的影响因素研究
2.1.1 反应物比例对大豆分离蛋白糖基化反应的影响 蛋白和多糖的分子间的共价结合是在一定的基团间发生的,适当的反应物配比不仅可以提高反应的速度和最终的反应程度,而且可以减少副反应(如焦糖化)的发生。
大豆分离蛋白与麦芽糊精按照一定质量比 (2∶1,1∶1,1∶2,1∶3,1∶4)混合,pH 为 7.0,蛋白质质量浓度5 g/dL,温度80℃,反应2 h得到美拉德接枝反应产物,考察反应物比例对接枝反应(接枝度和褐变程度)的影响,结果如下所示。

图1 SPI与麦芽糊精的比例对SPI-Md接枝反应接枝度与褐变程度的影响Fig.1 Effect of the ratio of SPI to Maltodextrin on the DG and degreeofbrowning ofSPI-Md conjugation
结果表明,随着麦芽糊精添加量的增大,接枝度有一定的下降。这可能是由于反应物过量会影响反应的速度;另外,由于麦芽糊精本身是白色,可以适当掩盖反应产物的颜色,使得反应带来的褐变不明显。当底物配比为2∶1时,接枝度最高,褐变程度相对较低仅0.13左右。
2.1.2 蛋白质质量浓度对大豆分离蛋白糖基化反应的影响 控制大豆分离蛋白与麦芽糊精配比2∶1,pH为7,温度80℃,反应2 h得到美拉德反应产物,考察蛋白质质量浓度对接枝反应影响,接枝度和褐变程度结果如下所示。
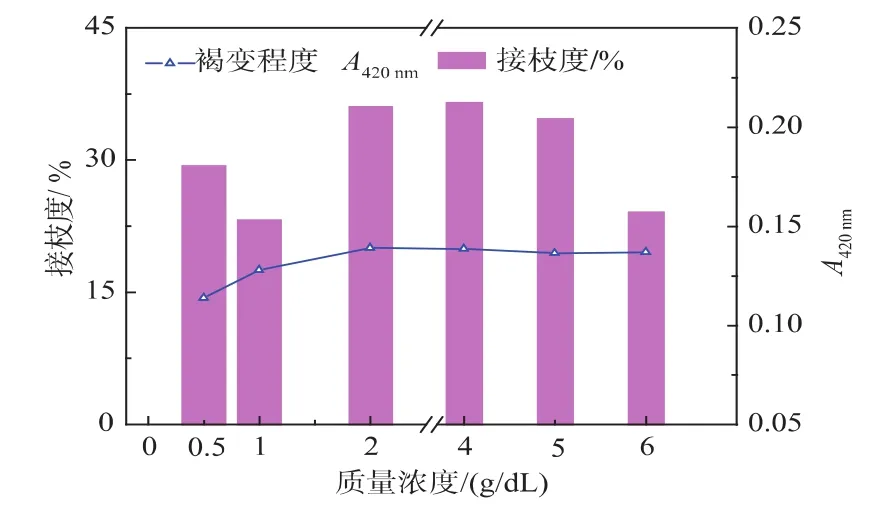
图2 蛋白质质量浓度对SPI-Md接枝反应接枝度与褐变程度的影响Fig.2 Effect of protein concentration on the DG and degree of browning of SPI-Md conjugation
随着蛋白质质量浓度的上升,接枝度出现先上升后下降的趋势,蛋白质质量浓度在4%时最高。这可能是由于,在当反应物的配比一定时,随着蛋白质质量浓度的提高,反应物分子之间碰撞的几率大大增加,有利于反应的进行[8]。而浓度增加到一定程度,考虑到蛋白质分子和多糖分子的空间位阻,分子之间的碰撞几率会减少,不利于反应的进行[2]。
2.1.3 反应温度对大豆分离蛋白糖基化反应的影响 控制大豆分离蛋白与麦芽糊精质量比2∶1,底物质量浓度为4 g/dL,pH为7.0,反应2 h制备美拉德反应产物,研究不同反应温度对美拉德反应的影响,结果如下图所示。
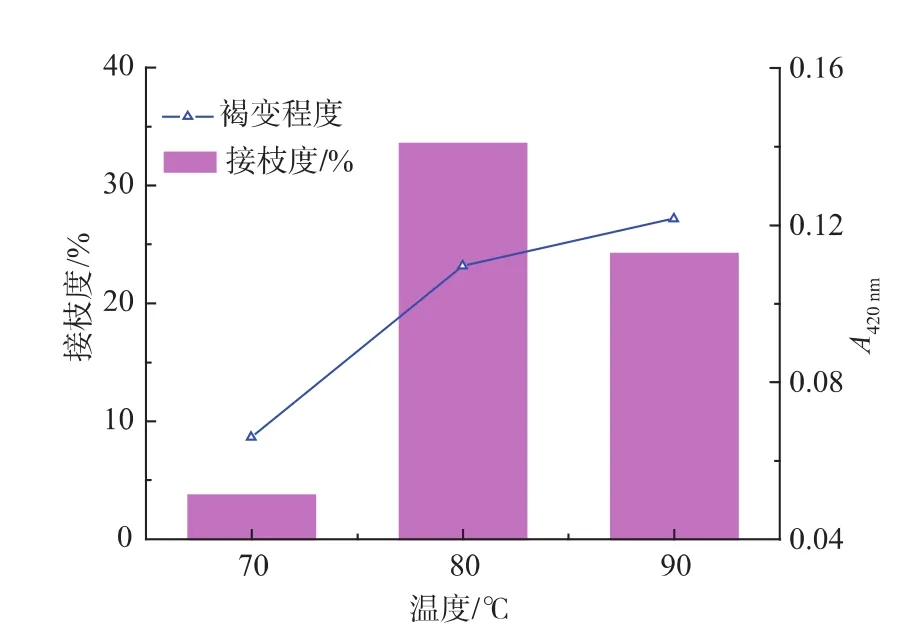
图3 反应温度对于SPI-Md接枝反应接枝度和褐变程度的影响Fig.3 Effect of the temperature on the DG and degree of browning of SPI-Md conjugation
随着美拉德反应温度的上升,接枝度呈现先上升后下降的趋势,反应温度为80℃的时候接枝度最高,表示反应底物分子接触充分,反应迅速。产物色泽随反应温度的提高有加深的趋势,这可能是因为,美拉德反应的后期过程是有色产物增多。选取80℃作为合适的反应温度。
2.1.4 反应时间对大豆分离蛋白糖基化反应及终产物功能性质的影响 控制大豆分离蛋白与麦芽糊精配比2∶1,底物质量浓度为4 g/dL,温度80℃,pH为7.0,研究不同反应时间对美拉德反应的影响,结果如下图所示。
随着反应的进行,接枝度逐步上升,当反应时间达到120 min时出现下降趋势。这是可能是由于接枝反应开始后,蛋白质结构部分展开,蛋白中的ε-氨基逐步暴露,多糖与蛋白质受热逐步结合,接枝度逐渐提高。而过度加热可能使蛋白质分子的赖氨酸被破坏,也可能使蛋白质由于相互作用增加,导致凝聚和沉淀,不利于接枝反应,此外美拉德反应后期,部分接枝物可能会发生裂解,也可能导致接枝度下降。选择适中的反应程度,在保证接枝度较大的情况下褐变指数越小越好。
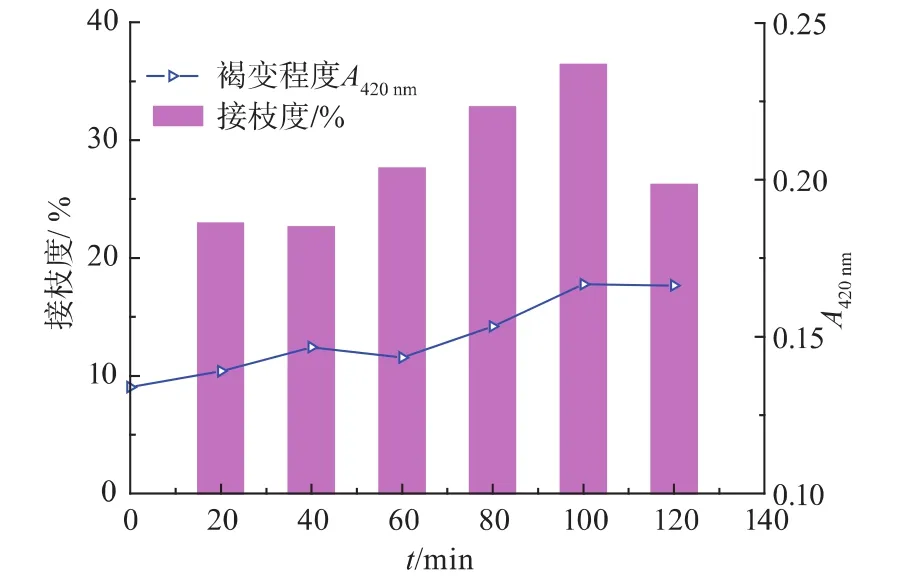
图4 反应时间对于接枝度和褐变程度的影响Fig.4 Effect of the reaction time on the DG and degree of browning of SPI-Md conjugation
考察了不同接枝反应时间对于复合改性终产物的乳化性及抗氧化能力(还原力、DPPH自由基清除能力)的影响。 如图 5(a)、(b)所示,随着接枝反应时间的增加,接枝酶解终产物乳化性先升高后逐渐减小,反应时间80 min时制备的产物乳化性最高;然而乳化稳定性则随接枝时间的变化出现下降的趋势。抗氧化能力方面,随接枝反应时间的增加,复合改性终产物还原力变化不大,DPPH自由基清除能力则有明显的先上升后下降的趋势,反应时间100 min时产物DPPH自由基清除能力最高 (图5(c)、(d))。
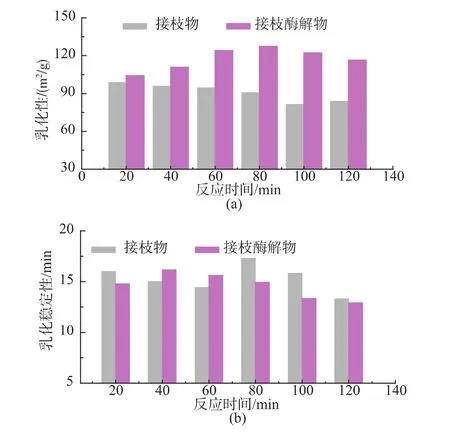
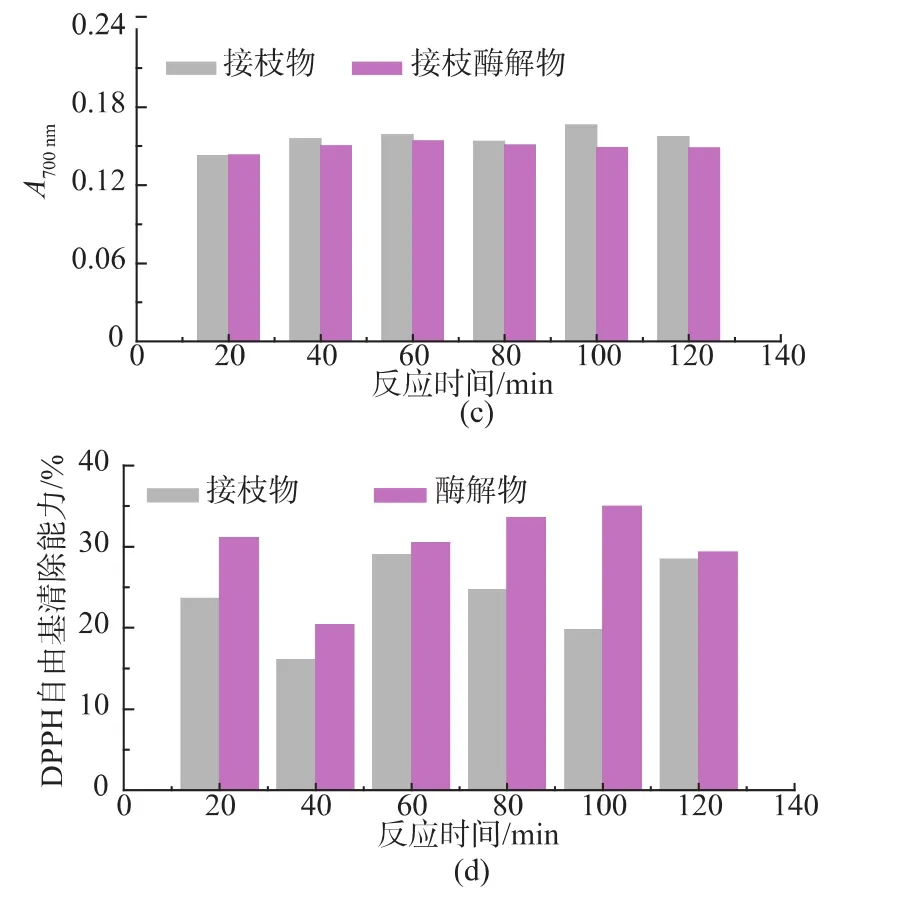
图5 接枝反应时间对于复合改性终产物乳化能力及抗氧化能力的影响Fig.5 Effect of the conjugation time on the emulsifying properties and antioxidative propertiesofthe combined modified products
2.1.5 接枝酶解反应条件的确定 综上所述,以接枝度及褐变程度为主要指标,同时参考反应时间对产物功能性质的影响,选择体系的反应物比例(大豆分离蛋白/麦芽糊精)为 2∶1,蛋白质量浓度为4 g/dL,温度80℃,pH为7.0,反应时间为80 min作为反应条件,对大豆分离蛋白-麦芽糊精接枝产物进行进一步酶解改性研究。
2.2 酶解程度对复合改性终产物的乳化能力的影响 将大豆分离蛋白-麦芽糊精糖基化产物进行酶解,通过控制不同的加酶量,制备不同酶解程度的复合改性终产物。加酶量(E/S)分别设定为0.5%,2%,4%,6%,8%,制备得到酶解度分别为1.8%,2.9%,4.6%,5.7%,6.2%的酶解物,进一步研究其功能性质的变化,结果见图6。
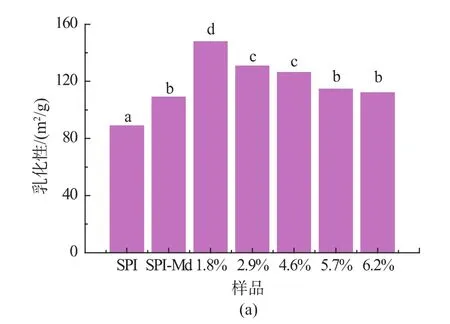
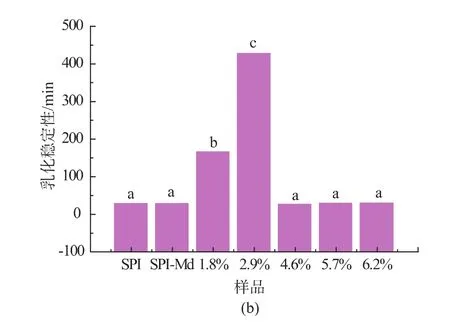
图6 复合改性对于产物乳化能力的影响Fig.6 Effect ofthecombined modification on the emulsifying properties of the modified products
大豆分离蛋白与麦芽糊精接枝后,分子间的空间位阻加大,同时接枝物中蛋白分子片段侧链具有一定的疏水性,使得接枝物能快速且紧密的吸附在油/水界面,从而提高了大豆分离蛋白的乳化性[2]。
接枝物经过适度酶解后,乳化性及乳化稳定性均呈现先增加后减少的趋势。这是因为酶解带来疏水性氨基酸侧链增加,增强的疏水性基团有利于与油滴结合,从而使乳化性增强;然而随着水解度的增加,溶液粘度下降,极性电荷数量增加,亲水性也随着增加,吸附油滴能力下降,又降低了乳化能力[9]。
2.3 酶解程度对于复合改性产物起泡性的影响
实验还研究了复合改性对于产物起泡性的影响,图7显示,接枝后产物起泡性增强。进一步酶解过程使得产物起泡性先有所降低后逐渐提高,当水解程度超过5.7%时出现明显下降。这是由于随着酶解的进行,包裹于蛋白分子内部的疏水性基团暴露,酶解产物疏水性增强,从而表面张力减弱,发泡能力增强[10-11]。然而当酶解度过大则由于肽链过短,不足以稳定泡沫液膜,从而导致起泡性下降。经过酶解改性后,泡沫稳定性出现明显下降,该结果与文献报道结论一致[12]。酶解使得产物溶解性增强的同时,也会带来溶液粘度下降,从而不利于维持泡沫液膜稳定。
2.4 复合改性对大豆分离蛋白抗氧化能力的影响
由图8可以看出,大豆分离蛋白经过接枝后抗脂质氧化能力有显著的提高。这可能是由于蛋白接枝物具有较强的铁离子螯合能力从而可以抑制卵磷脂体系的氧化[13]。然而对应的接枝酶解物随着水解程度的加深,抗脂质氧化能力则显著下降 (P<0.05)。这是由于中性蛋白酶无特定的酶切位点,可能破坏了部分具有抗脂质氧化能力的活性基团结构.然而由于本实验控制酶解程度不高(DH≤6),产生的氧化还原活性基团带来的积极影响不及原有活性基团结构被破坏失去的抗脂质氧化能力。
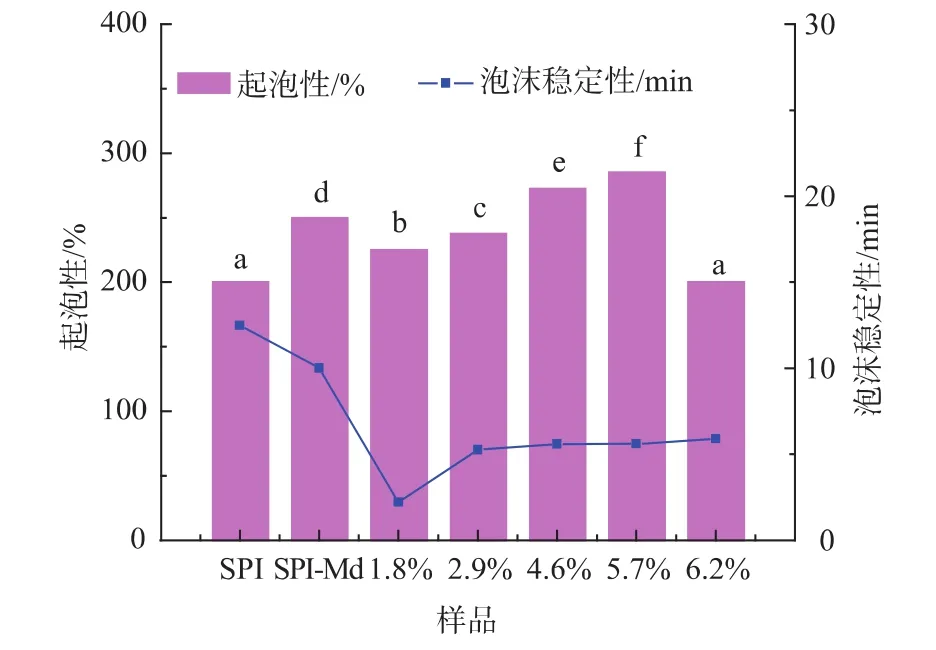
图7 复合改性对于产物起泡性的影响Fig.7 Effect of the combined modification on the foaming properties of the modified products
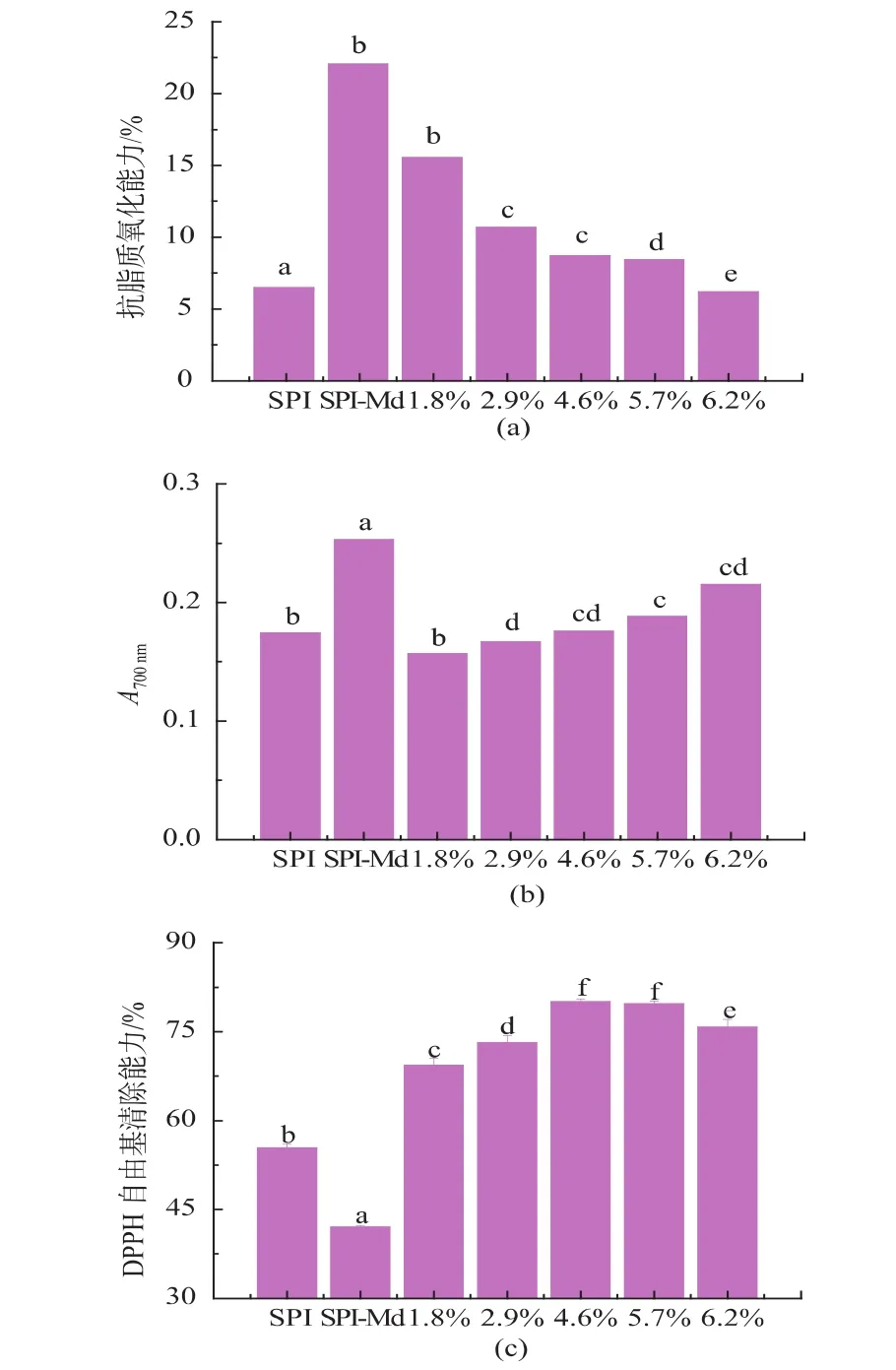
图8 复合改性对于产物抗氧化能力的影响Fig.8 Effect ofthecombined modification on the antioxidative properties of the modified products
样品体系中还原性介质的存在可以抑制或减少Fe3+/铁氯化物向亚铁离子形式(Fe2+)转化,其中Fe2+可以通过测定体系中普鲁士蓝的生成量来监测。大豆分离蛋白经过接枝后还原力有显著增加,然而酶解作用先降低了产物的还原力,后随着酶解程度的加深,产物还原力持续增加。该现象与抗脂质氧化能力的趋势吻合,由于蛋白酶解程度加深,生成氧化还原活性基团、氢离子增多,从而进一步增强产物的还原力。
乙醇溶液中DPPH自由基在517 nm处有最大吸收,溶液呈紫色。当有自由基清除剂存在时,由于与DPPH自由基单电子配对使溶液由紫色变黄色,其吸收逐渐减弱消失[13]。大豆分离蛋白接枝物经过不同程度的酶解后,DPPH自由基清除能力显著增强,这是由于接枝物酶解后产生氢离子与DPPH结合生成稳定的DPPH-H分子从而终止氧化反应。由此,复合改性除了能增强大豆分离蛋白的界面两亲性质,同时对于增强其抗氧化能力也有积极意义。
3 结语
通过实验得出大豆分离蛋白-麦芽糊精接枝反应最佳条件为:大豆分离蛋白与麦芽糊精质量比为2∶1,蛋白质质量浓度为4 g/dL,温度80℃,pH为7.0,反应时间为80 min。对复合改性产物乳化能力及起泡性能的研究证实,经过接枝及适度酶解复合改性后,蛋白的乳化能力及起泡性有了较大的提高,然而深度的酶解则有可能破坏蛋白的空间结构,降低粘度从而影响功能性质的发挥。另外,复合改性对于增强大豆分离蛋白的抗氧化能力也有积极意义。
[1]管军军.博士论文 微波合成大豆蛋白-糖接枝物机理、结构及功能性[D].无锡:江南大学,2005.
[2]穆利霞.大豆蛋白—糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学,2010.
[3]ZHANG Y,TAN C,ZHANG X,et al.Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J].European Food Research and Technology,2014.
[4]高育哲.定位限制性酶解对大豆分离蛋白表面性质及结构特性的影响[D].哈尔滨:东北农业大学,2008.
[5]Church2 F C,Swaisgood H E,Porter D H,et al.Spectrophotometric assay using O-Phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins1[J].Journal of Dairy Science,1983,66(6):1219-1227.
[6]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[7]郭凤仙.热处理对大豆分离蛋白结构及功能特性的影响[D].无锡:江南大学,2009.
[8]管军军,裘爱泳,刘晓亚,等.微波辐射大豆分离蛋白-糖接枝反应条件的研究[J].食品与生物技术学报,2005,24(5):16-20.GUAN Junjun,QIU Aiyong,LIU Xiaoya,et al.Effects of conditions on soy protein isolate-saccharide graft reaction by microwave radiation[J].Journal of Food Science and Biotechnology,2005,24(5):16-20.(in Chinese)
[9]张燕.醇法大豆浓缩蛋白的酶改性研究[D].无锡:江南大学,2008.
[10]齐军茹,杨晓泉,彭志英,等.小麦面筋蛋白酶法改性研究[J].中国食品学报,2003(5):117-121.QI Junru,YANG Xiaoquan,PENG Zhiying,et al.Study on enzymatic modification of wheat gluten[J].Journal of Chinese Institute of Food Science and Technology,2003(5):117-121.(in Chinese)
[11]张影陆,孙琳琳,陆健,等.小麦面筋蛋白质酶解产物用作啤酒发泡蛋白的研究[J].食品与生物技术学报,2009,28(6):822-827.ZHANG Yinglu,SUN Linlin,LU Jian,et al.Enzymatic hydrolysates of wheat gluten as foaming proteins in beer[J].Journal of Food Science and Biotechnology,2009,28(6):822-827.(in Chinese)
[12]Ortiz S E M,Wagner J R.Hydrolysates of native and modified soy protein isolates:structural characteristics,solubility and foaming properties[J].Food Research International,2002,35:511-518.
[13]Benjakul S,Visessanguan W,Phongkanpai V,et al.Antioxidative activity of caramelisation products and their preventive effect on lipid oxidation in fish mince[J].Food Chemistry,2005,90(1-2):231-239.
- 食品与生物技术学报的其它文章
- 皂苷类似物与肾素的分子对接和结合能分析
- 原生贡寮山药萃取物抗氧化成分及抗氧化活性的研究

