原生贡寮山药萃取物抗氧化成分及抗氧化活性的研究
赵一霖, 蔡国珍, 娄永江*, 丁仲仲, 张兴龙
(1.宁波大学 海洋学院,浙江 宁波 315211;2.台湾海洋大学 生命科学院,台湾 基隆)
山 药 为 薯 蓣 科 (Diosoreaceae) 薯 蓣 属(Dioscorea)的蔓性块茎类植物,俗称怀山或山芋。具有抗氧化、抗肿瘤、降血糖等多项生理功能,是值得关注及发展成为保健食品[1-4]。
Farombi指出,褐变后山药(D.rotundata)粉末的乙酸乙酯萃取物具有很好的抗氧化效果[5-6];若将此乙酸乙酯萃取物进一步以 Sephadex LH-20管柱层析配合甲醇流洗作区分,所得的各区分物同样显示具有很好抑制脂质氧化的效果。Araghiniknam以购自市面上的山药萃取物补充剂给予 65~82岁的老年人服用,经过3周后发现效果明显,山药萃取物补充剂可以缓解血清中脂质过氧化,降低三酸甘油酯的含量,增加高密度脂蛋白(HDL)的含量,减少低密度脂蛋白(LDL)造成的氧化损伤。Hu等以热水萃取、乙醇沉淀、Sephadex G-100纯化所得的山药多糖(相对分子质量 8.1×104),能降低维生素 CNADPH及Fe2+-cysteine诱发小鼠脑、肝脏和肾微粒体(microsome)脂质过氧化物的生成,同时山药多糖对 hypoxanthine/xanthine oxidase反应系统生成的超氧自由基 (O2-·)及 Fenton反应系统生成的氢氧自由基(HO·)也一样具有清除能力。现代许多疾病均与氧化压力有关,如老化、癌症、骨质疏松以及发炎等[7]。山药可以当做是一种天然的抗氧化剂,并能抵抗环境中的化学物质所造成的氧化伤害与疾病。发炎反应容易引起免疫相关的细胞产生趋化作用,进而造成活性氧(ROS)的产生。
目前对山药提取物的研究,主要集中在山药多糖上,认为多糖是其主要活性成分[8-9],而对山药提取物中酚类物质及其抗氧化性方面研究尚未见报道。作者采取不同干燥方法及萃取方式分别探讨了原生贡寮山药(Dioscores alata)山药皮与山药肉的抗氧化性及抗氧化成分,望进一步评估山药作为功能性产品的可能性。
1 材料与方法
1.1 材料与仪器
原生贡寮山药:产自台湾省贡寮市山药园,采后厚纸包装置于4℃冰箱中;磷酸氢二钠、六氰合铁酸钾、碳酸氢钠、没食子酸、磷酸二氢钾等:均为分析纯试剂;二苯代苦味酰基自由基(DPPH·)、福林酚试剂、绿原酸:购自 Sigma公司;Dulbecco’s Modified Eagle Medium (DMEM)(low glucose) 培养基,胎牛血清(FCS):购自 Gibco公司。
CR-21型高速离心机:日立建机株式会社产品;UV-160-A型分光光度计:日本岛津公司产品;Bichi RE111 型减压浓缩机:Model 107905,Boekel Scientific Inc产品;FACScan流式细胞仪:美国碧迪医疗器械有限公司产品;高效液相色谱仪:日本岛津公司产品。
1.2 实验方法
1.2.1 山药粉末的制备 清洗干净,表面晾干后的山药适量,表面削皮得到厚度约为0.2 cm的山药皮以及去皮的山药(后称山药肉,切成2 cm左右厚的小块状),分别浸入90℃热水中30 s热烫处理。热烫后每个样品分成两份分别进行热风干燥以及冷冻干燥后破碎过80目筛网,粉末于封口袋密封后备用。
1.2.2 萃取物的制备 将预先制得的山药皮、肉粉末分别用体积分数50%的乙醇,25、100℃去离子水,以200 r/min搅拌避光萃取1 h,减压浓缩后冷冻干燥。得到粉末密封后储存于-20℃冰柜中备用。
1.2.3 体外抗氧化实验
1)总多酚类化合物测试 参考Sato的方法[10],首先取400 μL不同浓度值萃取物及没食子酸(3.125~100 μg/mL)作为对照组,加入 400 μL 福林酚试剂充分振荡后静置3 min,再加入40 μL质量分数10%NaCO3溶液,经充分振荡后静置于暗室1 h以分光光度计检测于700 nm的吸光值。以不同浓度的没食子酸替代样品进行反应,制作标准回归曲线,每毫升萃取液中等同于含有没食子酸的毫克数,吸光值越高表示总酚类化合物越多。
2)DPPH自由基清除能力 参考Yamaguchi and others的方法[11],取样品液0.05 mL,加入0.5 mL 100 μmol/L的 DPPH溶液(溶于体积分数95%的乙醇),混匀后在室温下静置避光反应40 min后在517 nm处测吸光值Ai,未添加样品的控制组吸光值A0;维生素C为标准品。
清除率按下式计算:
DPPH·清除率 (%)=(1-(样品吸光值 Ai)/(未添加样品的控制组吸光值A0))×100
3)还原力测定 参考Yen and chen的方法[12],取150 μL不同质量浓度萃取物以及没食子酸(0.001 95~0.062 5 mg/mL)做对照组,加入等体积的磷酸钠缓冲溶液以及1%K3Fe(CN)6充分震荡后静置14 min,在700 nm下检测吸光值,以不同质量浓度的没食子酸反应制定还原力标准曲线,还原力以相同吸光值的没食子酸浓度表示,吸光值越高待变萃取物的还原能力越强。
1.2.4 高效液相色谱分析多酚类物质 柱温30℃,流量1 mL/min,进样量为20 μL,检测波长是280 nm,Thermo C18(250 mm×4.6 mm,D 5 μm),洗脱液A:乙腈 B:体积分数1% 乙酸,洗脱梯度:0~7 min v(A)∶v(B)=1∶9,8~12 min v(A)∶v(B)=3∶7,13~18 min v(A)∶v(B)=1∶1 ,19~25 min v(A)∶v(B)=1∶9,标准品绿原酸。
1.2.5 胞内活性氧分析 参考Prabhu等的方法[13],取每毫升 1×106个细胞 (含体积分数10%FCS的DMEM)以有或者无样品与最终质量浓度在1 μg/mL 的脂多糖(LPS)在 37 ℃(体积分数 5%CO2)的恒温培养箱内共同培养18 h后,再加入荧光染剂DCFH-DA于培养液(不含serum)中,使最终浓度为20 μmol/L。非极性物质 DCFH-DA渗入细胞内,经细胞内cellular esteraser作用可成为非荧光极性物质DCFH,待其进入细胞后遭到细胞内部H2O2等氧化,使其成为荧光物质 DCF,间接可量化细胞内ROS生成量。 细胞与DCFH-DA于37℃反应30 min后,将细胞液吸到15 mL离心管中,以 400 g离心10 min,弃上清液,细胞用 PBS清洗两次,加入1 mL PBS悬浮细胞,在流式细胞仪中进行分析。分析时,读取被水解成DCF所激发的荧光,收取10 000个细胞作为检品。
1.3 统计分析
利用Spss软件进行统计分析,实验结果数据以(平均值±标准差)表示,利用单因子变异数分析法,当p<0.05表示有显著性差异。
2 结果与讨论
2.1 山药总多酚类化合物质量分数分析与体外试管抗氧化能力
表1为比较原生贡寮山药皮与山药肉的总多酚含量。可以发现,不同干燥方式、萃取方式山药皮萃取物的总多酚质量分数远高于山药肉质量分数,山药皮萃取物总多酚质量分数为山药肉总多酚质量分数的3~20倍。干燥方式以冷冻干燥更好地保留了山药中的多酚成分;萃取物以体积分数50%乙醇萃取最优。
表2、表3为比较原生贡寮山药皮与山药肉的抗氧化能力,可以发现无论哪一种萃取方式的山药皮萃取物的DPPH自由基清除能力、还原力均远远高于山药肉萃取物。干燥方式也均以冷冻干燥优于热风干燥;DPPH自由基清除能力跟还原力测试以乙醇萃取优于常温水萃取和热水萃取;热水萃取物的抗氧化能力均低于其余萃取物的抗氧化能力。

表1 原生贡寮山药的总多酚质量分数Table 1 Total phenolic content of Dioscores alata mg(以10 g山药干燥粉末计)

表2 原生贡寮山药的DPPH清除能力Table 2 Reducing power of Dioscores alata %

表3 原生贡寮山药的还原力Table 3 Reducing power of Dioscores alata mg(以10 g干燥山药粉末计)
实验结果显示,加热处理会显著降低山药的抗氧化能力,Hsu等[14]也指出冷冻干燥的山药粉末通常比热风干燥保留了更多的抗氧化活性。冷冻干燥的山药皮热水萃萃取物较常温水萃取物抗氧化能力与总多酚质量分数显著降低:DPPH降低了78%,还原力降低了45%,总多酚质量分数降低了34%。热风干燥的山药皮较冷冻干燥山药皮的抗氧化能力与总多酚质量分数也显著降低,其中热风干燥的DPPH清除能力为冷冻干燥的DPPH自由基清除能力的45%~68%。总多酚质量分数,热风干燥较冷冻干燥的山药皮常温水萃取物降低32%,热水萃取降低15%,乙醇萃取降低31%。
原生贡寮山药皮的抗氧化能力高于山药肉部分。萃取方式以体积分数50%乙醇的萃取物的抗氧化能力最强,这与黄等人的研究结果相同[15]。在Hou的研究报告中指出山药肉部分主要抗氧化能力的活性物质包括粘质、酚类化合物、储存蛋白[16-17];但尚未有报道指出山药皮具有的抗氧化活性物质到底是什么。实验发现,山药皮比山药肉的总多酚质量分数高很多,因此推测山药皮具有较高的还原力以及DPPH自由基清除能力可能由于山药皮具有较高的总多酚质量分数,此推断有待于进一步论证。
2.2 HPLC分析山药萃取物多酚物质
图1为12种样品(不同山药部位,不同干燥方式,萃取方式处理后共12个样品中具有代表性的4个图谱,经全波长扫描后确定检测波长为280 nm。结果显示在绿原酸为主要检出酚酸(比对绿原酸标准品),保留时间为11.64~11.67 min,标准品绿原酸保留时间为11.66 min,其余多酚类集中在5 min以内,极性极强,萃取物中绿原酸质量分数为0.85~11.91 mg/g。图1可见,经冷冻干燥处理后的山药皮乙醇萃取物高于热风干燥处理的山药皮乙醇萃取物,萃取方式以乙醇萃取优于热水萃取,干燥方式以冷冻干燥优于热风干燥。且绿原酸为山药肉中主要多酚类物质,绿原酸质量分数占总多酚质量分数的44%~87%。山药皮中,绿原酸占总多酚类物质的34%~59%。HPLC分析绿原酸质量分数以及细胞ROS实验分析结论与体外试管抗氧活能力以及总多酚质量分数一致,初步证明山药中粗提取物中主要的抗氧化成分为多酚类物质——绿原酸,但是绿原酸的抗氧化性质待进一步论证。
2.3 山药乙醇萃取物对RAW264.7细胞产生胞内活性氧分析(ROS)的影响
图2为原生贡寮山药乙醇萃取物抑制由LPS诱导RAW264.7细胞产生ROS的影响,结果显示较LPS诱导组相比,添加原生贡寮山药乙醇萃取的样品低浓度下即可显著降低细胞产生ROS的活性。即原生贡寮山药乙醇萃取物对于在LPS刺激下RAW264.7细胞所产生的ROS具有良好的清除结果,所以认定此萃取物良好的抗氧化能力可能与其具有ROS清除能力有很大关系。RAW264.7细胞在山药皮的抑制能力优于山药肉,干燥方式以冷冻干燥的萃取物抑制能力优于热风干燥,此结果与体外试管结论一致。
3 结语
山药皮较山药肉具有较少的蛋白质跟较多的总多酚质量分数,所以山药皮具有较高的还原力与DPPH自由基清除能力可能与山药皮具有较高的总多酚质量分数有关。冷冻干燥比热风干燥保留了较高的山药抗氧化能力以及总多酚质量分数是由于热处理影响了酚类物质的稳定性与抗氧化能力。山药皮的体积分数50%乙醇,热水和水萃取液的总多酚质量分数、还原力及DPPH自由基清除能力皆远高于山药肉的萃取液。在3种萃取方式的山药萃取液的抗氧化能力体积分数50%乙醇的萃取方式最优。体外抗氧化分析,HPLC分析绿原酸实验以及萃取物降低由LPS所诱发RAW 264.7细胞产生ROS的活性实验结论一致。

图1 部分原生贡寮山药的萃取物的HPLC分析图谱Fig.1 Part of HPLC chromatogram of extraction from Dioscores alata
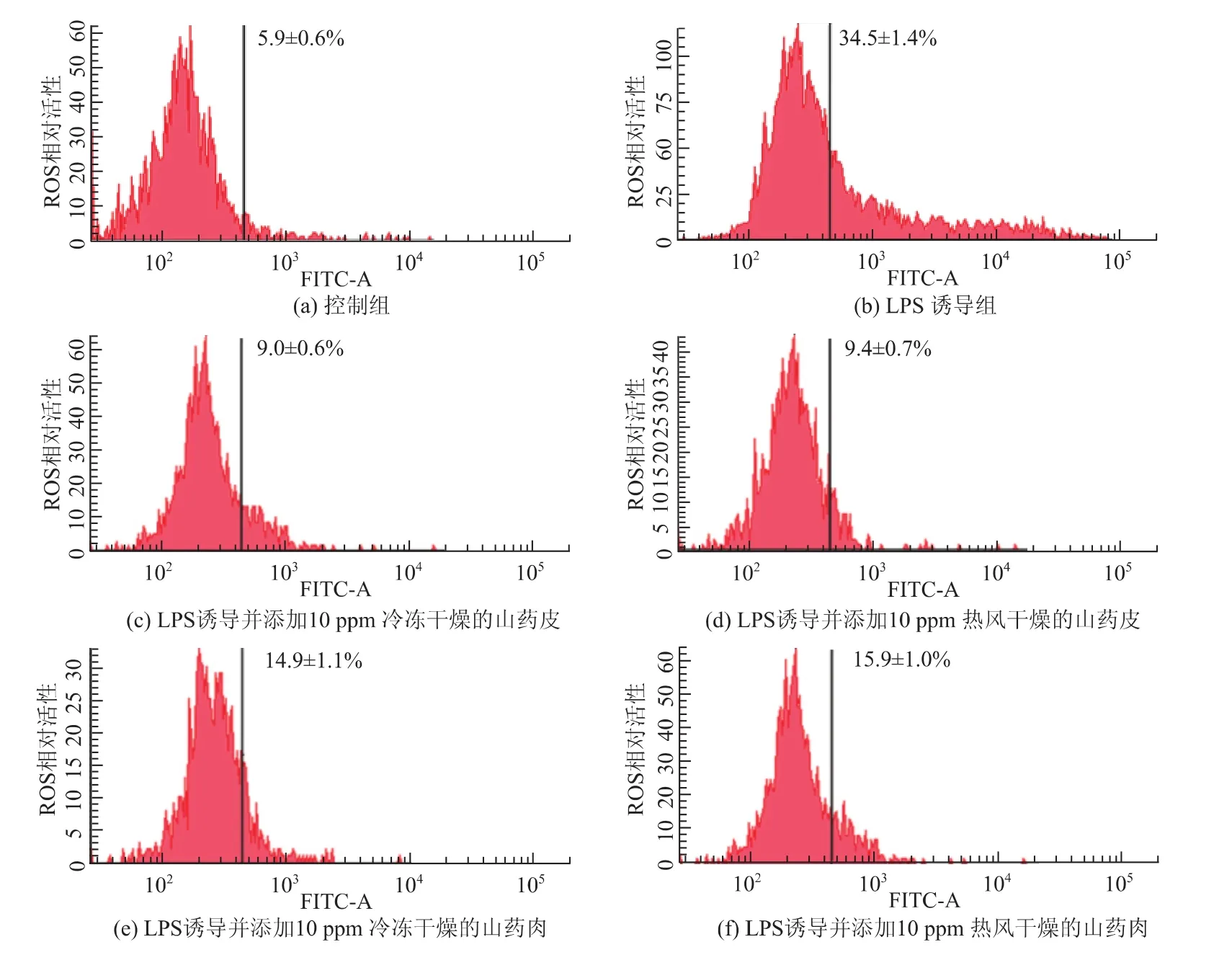
图2 原生贡寮山药的乙醇萃取物对抑制小鼠RAW264.7细胞产生ROS能力的影响Fig.2 Effect of 50%ethanolic extraction from Dioscores alata on the ROS scavenging in murine RAW 264.7 macrophage
[1]王洪新,王远辉.山药多糖研究进展[J].食品与生物技术学报,2011,30(3):321-327.WANG Hongxin,WANG Yuanhui.Investigative progress of Chinese yam (Rhizoma dioscorea) polysaccharide[J].Journal of Food Science and Biotechnology,2011,30(3):321-327.(in Chinese)
[2]孙宇婧,韩涛,李丽萍,等.山药糖蛋白体外抗氧化活性研究[J].园艺学报,2010,37(6):1009-1014.SUN Yujing,HAN Tao,LI Liping,et al.Antioxidant activity in vitro of glycoprotein from Chinese yam[J].Acta Horticulturae Sinica,2010,37(6):1009-1014.(in Chinese)
[3]赵国华,李志孝,陈宗道.山药多糖 RDPS-I的结构分析及抗肿瘤活性[J].药学学报,2003,38(1):37-41.ZHAO Guohua,LI Zhixiao,CHEN Zongdao.Structural analysis and antitumor activity of RDPS-I polysaccharide from Chinese yam[J].Acta Pharmaceutical Sinica,2003,38(1):37-41.(in Chinese)
[4]Rosser A.The day of the yam[J].Nursing Times,1985,81(18):47.
[5]Farombi E O,Britton G,Emerole G O.Evaluation of the antioxidant activity and partial characterisation of extracts from browned yam flour diet[J].Food Research International,2000,33(6):493-499.
[6]Araghiniknam M,Chung S,Nelson-White T,et al.Antioxidant activity of dioscorea and dehydroepiandrosterone(DHEA) in older humans[J].Life Sciences,1996,59(11):147-157.
[7]Epstein F H,Diaz M N,Frei B,Vita J A,et al.Antioxidants and atherosclerotic heart disease[J].New England Journal of Medicine,1997,337(6):408-416.
[8]张忠泉,陈百泉,许启泰.山药多糖对大鼠血糖及胰岛释放影响的研究[J].上海中医药杂志,2003,37(10):52-53.ZHANG Zhongquan,CHEN Baiquan,XU Qitai.Efect of polysaccharides of rhizoma dioscoreae oppositae on blood glucose and insular function in diabetic rats[J].Shang Hai Journal Of Traditional Chinese Medicine,2003,37(10):52-53.(in Chinese)
[9]徐小伟,李振宇,苗敬芝.超声结合酶法提取山药多糖及抗氧化活性研究[J].农业机械,2013,6:79-81.XU Xiaowei,LI Zhenyu,MIAO Jingzhi.Ultrasound combined with enzymatic extraction of yam polysaccharide and the study ofantioxidant activity[J].Farm Machinery,2013,6:79-81.(in Chinese)
[10]Sato M,Ramarathnam N,Suzuki Y,et al.Varietal differences in the phenolic content and superoxide radical scavenging potential of wines from different sources[J].Journal of Agricultural and Food Chemistry,1996,44(1):37-41.
[11]Yamaguchi T,Takamura H,Matoba T,et al.HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J].Bioscience,Biotechnology,and Biochemistry,1998,62(6):1201-1204.
[12]YEN G C,CHEN H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].Journal of Agricultural and Food Chemistry,1995,43(1):27-32.
[13]Prabhu K,Zamamiri-Davis F,Stewart J,et al.Selenium deficiency increases the expression of inducible nitric oxide synthase in RAW 264.7 macrophages:role of nuclear factor-κB in up-regulation[J].Biochem J,2002,366:203-209.
[14]Hsu C L,Chen W,Weng Y M,et al.Chemical composition,physical properties,and antioxidant activities of yam flours as affected by different drying methods[J].Food Chemistry,2003,83(1):85-92.
[15]马婷婷,田呈瑞,李龙柱,等.响应曲面法优化黄参茎叶多酚的提取工艺及其抗氧化活性[J].食品与生物技术学报,2013,32(11):1218-1226.MA Tingting,TIAN Chengrui,LI Longzhu,et al.Response surface methodology for optimization extraction process of sphallerocarpus gracilis stem leaves polyphenol and determination of antioxidant activity[J].Journal of Food Science and Biotechnology,2013,32(11):1218-1226.(in Chinese)
[16]HOU W C,LEE M H,CHEN H J,et al.Antioxidant activities of dioscorin,the storage protein of yam (Dioscorea batatas Decne)tuber[J].Journal of Agricultural and Food Chemistry,2001,49(10):4956-4960.
[17]HOU W C,Hsu F L,Lee M H.Yam (Dioscorea batatas) tuber mucilage exhibited antioxidant activities in vitro[J].Planta Medica,2002,68(12):1072-1076.
- 食品与生物技术学报的其它文章
- 复合改性改善大豆分离蛋白功能性质的研究
- 皂苷类似物与肾素的分子对接和结合能分析

