高纯三氟甲烷的制备工艺
袁淑筠,廖恒易
(佛山市华特气体有限公司,广东佛山 528241)
三氟甲烷(CHF3,也称氟仿,R23)是一种用途广泛并且化学性能稳定的无色、微味、不导电的气体,主要用作制冷剂、灭火剂和蚀刻剂。此外,CHF3是氟化物有机合成的基本原料之一,也是超临界萃取溶剂,还可用作红外检测器直接冷却剂,或作为推进剂与其他非可燃推进剂混合使用,用于物化实验等。对制冷、灭火领域而言,CHF3产品的纯度要求不高,一般定位99.5%。但作为半导体、微电子行业的蚀刻剂,CHF3的纯度则至关重要。因为在等离子刻蚀或反应离子刻蚀二氧化硅工艺中,CHF3具腐蚀二氧化硅的速度快,腐蚀硅的速度慢的特点[1],满足了以硅为衬底表面氧化一层二氧化硅薄膜的硅片蚀刻的工艺要求,成为硅片的主要蚀刻剂之一。高纯度的CHF3是制作高水平、高质量硅片的保证,因此,电子级的CHF3的纯度要求≥99.999%。
近年,佛山市华特气体有限公司承担了国家《极大规模集成电路制造装备成套工艺》项目(简称“02”专项)中高纯CHF3的研发。本文结合本公司自主研发的CHF3提纯工艺,概述了高纯CHF3的制备工艺过程。
1 CHF3的制备
1.1 实验室制备方法[1-3]
1.电解法
在无水氢氟酸中电解醋酸、丙酮或甲胺。该法能耗过高,且不能连续、一体化地生产高纯的CHF3。
2.三氯甲烷与氟化银反应

3.在125℃和加压下,三氟化锑或氟化氢与三氯甲烷反应
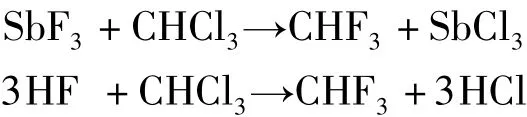
本反应可根据CHF3和氯化氢在不同溶剂的溶解度不同的特性[4],利用溶剂吸收法进行CHF3和氯化氢的分离。
1.2 工业化生产方法
1.二氟一氯甲烷(CHClF2,氟利昂 22,也称R22)在 AlCl3作用下的催化歧化反应[5-6],该工艺是目前生产CHF3的主要方法。其反应如下:

即CHClF2在一定温度和压力条件下,以一定流量进入一级歧化反应器中,其反应产物经一级冷凝器除去CHF3后,未反应的CHClF2进入第二级歧化反应器中进一步反应。从二级歧化反应器中的产物,经过二级冷凝器除去三氯甲烷和二氟二氯甲烷(CCl2F2,也称 R12)后,得到纯度99.5%以上的CHF3。
2.利用膜分离技术回收CHClF2产品的副产物CHF3。
CHClF2是目前制冷剂R11、R12较为理想的替代品,也是生产四氟乙烯和氟树脂、氟橡胶的重要原材料,在生产 CHClF2的过程中会大量的副产CHF3。有文献报道,采用硅橡胶膜通过二级三段式膜从CHClF2中分离副产物CHF[7]3,可得到纯度为97%的CHF3。
2 CHF3的纯化
气体的纯化技术是制备高纯度气体的重要环节。上述CHF3制备过程中会或多或少含有不同的副产物生成,虽然可以通过诸如溶剂吸收法,膜分离技术等,得到纯度≥99.5%的 CHF3,但要得到99.999%的高纯CHF3还要进一步的纯化。通常是采用低温精馏、低温吸附进行纯化。
本文阐述的CHF3纯化过程是采用低温精馏和低温吸附相结合的方法,使CHF3产品纯度最终达到≥99.999%。具体工艺流程见图1。
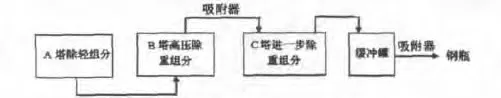
图1 高纯CHF3提纯工艺流程图Fig.1 High-purity CHF3 purification process flow diagram
2.1 精馏过程
2.1.1 精馏操作参数的选择
以CHClF2为原料生产CHF3的制备过程中会产生大量的副产物,现将CHF3原料气的组成及其沸点汇集在表1。

表1 CHF3原料组分沸点表Table 1 The boiling points of CHF3 raw material components
由表1可见,除三氟一氯甲烷(CClF3,也称R13)、CO2和CHF3的沸点比较接近外,使用精馏法可以轻松去除原料中的大部分杂质。
查阅资料[1,8],取 CHF3及其原料气中主要杂质CO2、CClF3、CBrF3、C2HF5、CHClF2和 CCl2F2在温度分别为 -110、-80、-50、-20、10 ℃时的饱和蒸气压数据,绘制其蒸气压—温度变化趋势图(图2)。并根据表1中CHF3与CClF3沸点接近的情况,绘制CHF3和 CClF3在 -90、-80、-70、-60、-50、-40、-30、-20、-10、0、10 ℃时的饱和蒸气压—温度变化趋势图(图3)。

图2 CHF3及其主要杂质饱和蒸气压—温度变化趋势图Fig.2 The saturated vapor pressure and temperature change trend chart of CHF3 and its main impurities
由图2可见,当精馏塔温度控制为-80℃以下时,CHF3与其主要杂质不易分离。随着温度升高,同一温度下各物质的饱和蒸气压的差异也增大,有利于CHF3与其他组成的分离。

图3 CHF3和CClF3饱和蒸气压—温度变化趋势图Fig.3 The saturated vapor pressure and temperature change trend chart of CHF3 and CClF3
由图3可见,控制精馏塔压力为1300 kPa以上时,可将CClF3液化,实现去除CHF3中的CClF3杂质的目的。另,CHF3和CClF3的分离起码在应控制精馏塔温度为-20℃以上,又因CHF3的临界温度为25.7℃(临界压力为4.816 MPa),CClF3的临界温度为28.9℃(临界压力为3.87 MPa),故精馏塔的操作温度应控制≤20℃。
2.1.2 低温精馏操作
2.1.2.1 初步精馏去除空气、CO2等轻组分
从表1可见,轻组分中除CO2外的气体组分可以很容易通过精馏除去,CO2的沸点和CHF3的沸点仅相差5.55℃,相对较难除去。但从图2可见在相同的温度下,CO2在较高的压力下才能液化,故将第一个精馏塔(A塔)的压力控制在500 kPa左右并在相应的温度下将表1中的轻组分包括空气、氮气、一氧化碳、二氧化碳等作为塔顶气相组分排放,去除大部分轻组分。经取精馏塔液相组分检测,CO2等杂质含量合格,可将精馏塔塔釜液态组分转移到另一个精馏塔(B塔)继续纯化。
2.1.2.2 第二步高压精馏去除重组分
本步精馏在 B塔内进行,主要将 CHF3和CClF3、CBrF3、C2HF5、CHClF2、CCl2F2等卤代烃气体分离。图 2 中,CBrF3、C2HF5、CHClF2、CCl2F2的蒸气压—温度曲线在-20℃后开始变陡,即随着温度增大饱和蒸气压也增大得很快。虽然随着操作温度变大,CHF3和CClF3的分离变得越容易,但同时更可能将原料中液态中的 CBrF3、C2HF5、CHClF2、CCl2F2全部或部分气化,此时取精馏塔气态组分充装,可能会得到 CBrF3、C2HF5、CHClF2、CCl2F2等重组分严重超标的产品。因此,通过增加精馏塔压力至 1300 kPa 以 上,可 将 CClF3、CBrF3、C2HF5、CHClF2、CCl2F2与 CHF3分开。值得注意的是,在CHF3原料气中CHClF2是最常见的杂质,也是含量相对较大的杂质,往往在实际操作中,由于气流量较大,很容易将CHClF2夹带至气相中,且液相中也会含有 CHClF2,因此,容易被人误认为 CHF3和CHClF2存在共沸,冯耀声等[9]对 CHF3和 CHClF2的气液平衡进行了研究,确认该物系为非恒沸系。又因CHClF2的饱和蒸气压相对于其它杂质偏低,需把精馏压力控制在较低的范围才能实现和CHF3的分离。这就需要在第三个塔内(C塔)进一步调整操作条件进行去除。
2.1.2.3 进一步去除重组分
由图1可见,当精馏塔温度为-80~-50℃范围内,控制精馏塔压力小于200 kPa,能使CHClF2保持为液态,此时把精馏塔顶部的气体组分转移到充装,可实现CHF3和CHClF2的分离。
在气体纯化过程中,所涉及的精馏塔一般是要根据气体各组分间的气液平衡数据,通过模拟软件的模拟,进行精馏塔的设计,做到专气专用。但实际上许多生产厂家会采用一套精馏装置进行不同种类气体的纯化,或由于气体的来源不同,其杂质的种类或含量发生变化,给实际操作带来不少的问题,纯化达不到理想的效果。这就需要我们先确定该塔是否适用该项气体的纯化,并通过检测等手段确认原料的组成,查阅各组成的饱和蒸气压—温度曲线图,调整精馏操作参数,方可达到理想分离效果。
2.2 低温吸附分离
精馏操作可去除绝大部分的杂质,但当杂质的含量降到很低,例如≤10×10-6时,再靠精馏将杂质减低至尽量接近0的话,难度变大,既费时又耗能。特别是原料气中水含量偏高时,单靠精馏很难得到高纯度的CHF3产品。本文在精馏的基础上,还采用了低温吸附技术。利用分子筛对杂质分子大小、极性、不饱和度的大小等特性进行选择性吸附,去除低含量的杂质(包括水)。经分子筛或高效吸附剂的多级净化,完成高纯CHF3的制备。
本吸附工艺中重点关注的杂质有CO2和水。其中,去除CO2可选择专用的CO2高效吸附剂,或13X分子筛,各种改性分子筛等。除水效果较好的有3A分子筛,也建议选择4A分子筛,因其除了能吸附水,还能吸附NH3、H2S、二氧化硫、二氧化碳、C2H5OH、C2H6、C2H4等直径不大于4Å的分子。
另外,吸附工艺中的吸附容器的径高比(r/h)应小,有利于提高吸附效率。这是由于吸附过程的阻力问题,导致同样体积的装有同样重量的吸附剂的两容器,半径小者吸附剂利用率高。
3 结论
本文通过低温精馏和低温吸附结合对CHF3进行纯化,即A塔控制500 kPa左右去除轻组分,待精馏塔釜液态组分检测CO2≤15×10-6时,将其转移到B塔;控制B塔压力为1300 kPa以上除部分重组分,待塔顶气态组分检测 CClF3≤0.5×10-6时,将其经吸附器纯化转移到C塔;控制C塔压力为200 kPa以下去除剩余重组分,待塔顶气态组分检测OHC≤0.5×10-6时将其转移到缓冲罐;控制缓冲罐压力为膜压机设计进气压力,经吸附器纯化后充装至钢瓶。经检测CHF3成品纯度达到99.999%。
[1]中国工业气体工业协会.中国工业气体大全[M].大连:大连理工大学出版社,2008:2671-2673.
[2]李华昌,符斌.实用化学手册[M].北京:化学工业出版社,2006:76-166,247-262,273-276,280.
[3]黄建彬.工业气体手册[M].北京:化学工业出版社,2002:247-265.
[4]刘婵,李春喜,孟洪,等.三氟甲烷和氯化氢气体在不同溶剂中的溶解度[J].高校化学工程学报,2008(1):1-5.
[5]杜贡生,梁国仑.特种气体贮运、应用、安全与特性[J].低温与特气,1994(1):63-64.
[6]李仲瑾,李晓钡,牛育华,等.精细化工原料及中间体手册:电子化学品[M].北京:化学工业出版社,2006:40-462.
[7]王跃.膜法分离二氟一氯甲烷/三氟甲烷混合气的研究[D].大连理工大学,2008.
[8]卡尔 L约斯,Matheson气体数据手册(原书第七版)[M].北京:化学工业出版社,2003:75,126,180,195,261,816.
[9]冯耀声,李昌圣,寿张根.三氟甲烷与二氟氯甲烷的汽液平衡[J].化学工程,1984(3):41-47.

