手性有机酸薄层色谱保留指数的拓扑模型
李鸣建, 王欲晓, 冯 惠, 冯长君
(徐州工程学院化学化工学院,江苏 徐州221111)
分子的手性即不对称性(亦称为旋光性)在生命系统中起着极为关键的作用,是因为许多重要的生物活性皆通过严格的手性匹配即立体结构契合产生分子识别而实现的[1-4]。因此,许多有机物参与生物体内代谢时都表现出严格的立体选择性与专一性。这就促使人们对手性化合物(特别是手性药物)的合成、分离、生物学实验等进行许多有益的探讨,但与之相应的物质定量结构-性质相关性(quantitative structure-property index relationship,QSPR)研究相对滞后[5-7]。这是因为已建立的拓扑指数(topological index)多不考虑分子的空间形状,而不能区分分子的旋光异构[8,9]。目前已有较多学者对拓扑指数进行扩展修正,以建立能够揭示分子三维结 构 特 征 的 手 性 拓 扑 指 数(chiral topological index)。
文献[10]采用手性乘积方法构建能够反映分子手性的拓扑指数,将其与16个手性有机酸(6种手性羟酸和10种手性氨基酸)的薄层色谱保留指数进行多元统计回归分析及人工神经网络研究。文献[11]运用3种方法建立手性拓扑指数,将它们与18种手性有机酸(8种手性羟酸和10种手性氨基酸)的薄层色谱保留指数进行拟合,经多元统计及人工神经网络分析,建立了良好的数学模型,为开展手性表征方法及其定量结构-保留指数相关性(quantitative structure-retention index relationship,QSRR)研究具有启示性意义。作者前文[12-14]分别基于原子类型电性拓扑指数、电性距离矢量、连接性指数与手性指数关联上述手性有机酸的薄层色谱保留指数,构建的最佳二元、三元及四元数学模型的判定系数(R2)依次为0.915、0.909、0.969,为手性分子表征提供了一种简便方法。
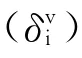
1 理论与方法
1.1 手性薄层色谱保留指数
18种手性化合物包括8种手性羟酸和10种手性氨基酸,它们的薄层色谱的保留指数(RM)数据引自文献[11]:

其中Rf称为手性有机酸的比移值,其RM值见表1。
1.2 新型连接性指数的建立方法
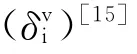
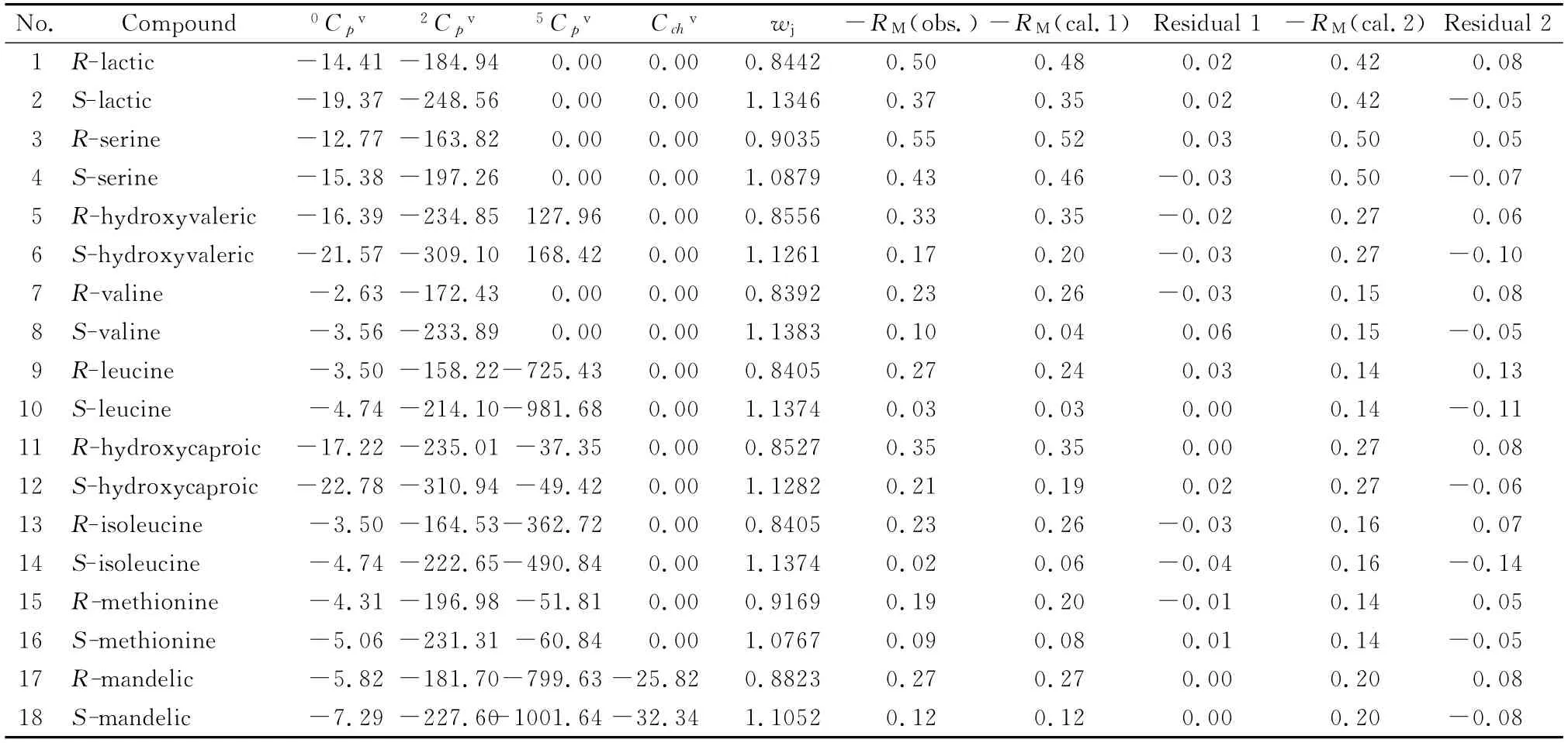
表1 18种手性有机酸的手性拓扑指数及其保留指数Table 1 Chiral topological indices and retention indices of the 18 chiral organic acids
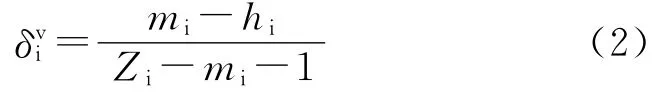
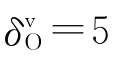
综合考察18种手性有机酸的薄层色谱保留指数RM与其母体、取代基及其组成原子结构特征的关系,建议非氢原子i的新型原子点价(gi):
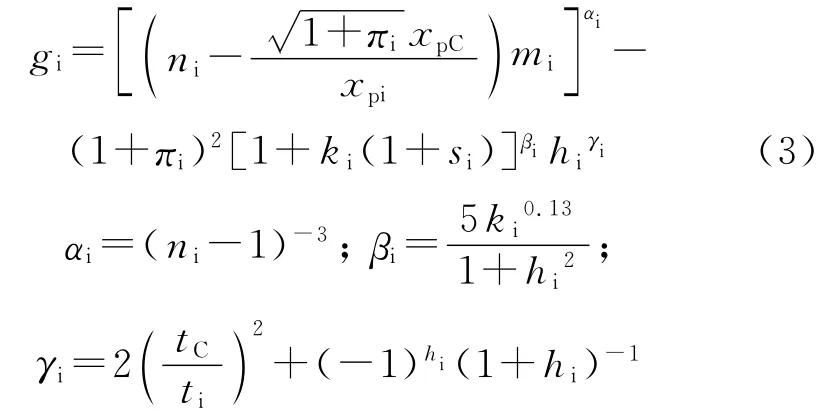
式(3)中,ni、xpi、ti、ki、mi及πi依次为非氢原子i的电子层数、Pauling电负性、成单价电子数、孤电子对数、价电子数、成π 键电子数。xpC、tC为碳原子的Pauling电负性、成单价电子数。考虑醇羟基受苯环上大π键电子影响较大,引入芳环校正因子si。对于分子中含有苯环的si=-0.5,否则,si=0。按式(3)可求得-OH、=O、-NH2、-S-等基团中非氢原子的gi依次为-12.644 2、5.710 0、1.139 8、1.365 3。对于伯、仲、叔、季碳原子的gi依次为-2.838 5、-1.039 7、3.000 0、4.000 0;含有π键电子的叔、季碳原子的gi依次为-1.656 9、2.343 1;而含有苯环的醇羟基中氧原子的gO为0.934 9。
价连接性指数定义为若干个相邻非氢原子的原子点价乘积平方根的倒数之和:

式中:m 为连接性指数的阶数,m=0,1,2,…;t代表分子中子图的类型,即将分子结构剖析成若干种局部拓扑图:路径、簇、簇-径、环状子图,依次对应t为p、c、pc及ch;其“Σt”是对分子子图求和。由于本文的gi中含有负数,将式(4)中的“-0.5”修正为“1”,并 以“gi”代“δiv”构 建 新 型 价 连 接 性 指 数(mGtv):
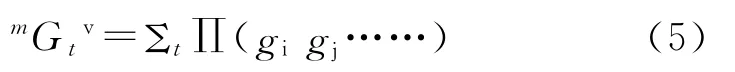
本文利用MATLAB 软件计算了9 种mGtv:0Gpv、1Gpv、2Gpv、3Gpv、3Gcv、4Gpv、5Gpv、4Gpcv、Gchv。例如乳酸的上述9 种mGtv值依次为-17.074 0、-55.666 0、-219.070 0、754.670 0、-372.730 0、0.0000、0.0000、6 108.100 0、0.0000。
1.3 手性连接性指数的建立方法
前文[13]依据手性碳原子上所连取代基的次序规程[17],定义了分子j的手性指数(wj)。如R-乳酸分 子 的wj,R=0.844 19;S-乳 酸 分 子 的wj,S=1.134 61。手性连接性指数(mCtv)定义为:
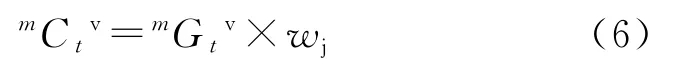
所建手性连接性指数可对具有手性的分子予以表征,其wj≠1,可以wj>1或wj<1,实现旋光异构体的数值化。亦能区别内消旋体及非手性分子的结构差异,此时wj=1(即手性连接性指数退化为连接性指数)。根据式(6)计算了每个有机酸分子的9种mCtv(描 述 子):0Cpv、1Cpv、2Cpv、3Cpv、3Ccv、4Cpv、5Cpv、4Cpcv、Cchv。对 于R-乳 酸、S-乳 酸 的0Cpv分 别 为-14.41、-19.37,2Cpv分 别 为-184.94、-248.56,其内消旋体的0Cpv、2Cpv分别为-17.074 0、-219.070 0。
1.4 RM 的多元回归分析
将每种化合物的9种描述子作为自变量,相应的RM为因变量构建数据集,应用最佳子集回归(leaps-and-bounds regression)选择最佳变量组合,建立相应QSRR 模型。采用逐一剔除法(leave-oneout,LOO)对模型的预测能力及稳健度进行检验,以交叉验证相关系数(Q2)予以评价。为了确立最终的QSRR 模型,引入Akaike信息判据(Akaike’s information criterion,AIC)、Kubinyi函数(Kubinyi function,FIT)[18,19],其计算公式:
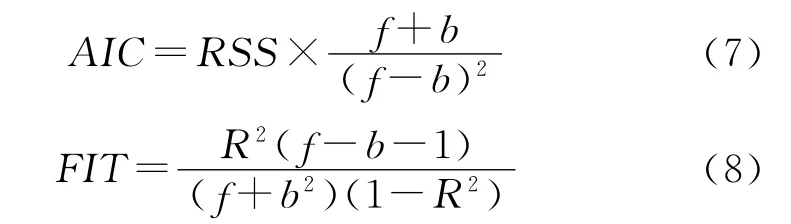
式中:RSS 为方差和,f 为化合物数,b 为变量数。AIC 值越小,FIT 值越大,所建的模型越稳定,预测能力越高。
2 结果与讨论
2.1 新建手性连接性指数的RM 模型
将18种手性有机酸的色谱保留指数RM[11]与手性连接性指数mCtv输入MINTAB14统计分析软件,经最佳变量子集回归及留一法交叉验证构建的QSRR模型见表2。其中R2、Radj2、Q2、S、F 分别为判定系数、校正判定系数(以消除自变量个数及样本容量对判定系数的影响)、留一法交叉验证系数、估计标准误差、Fischer检验值。
由表2可见,随着模型中变量数增多,其R2逐渐增大,但Q2、FIT、Radj2先逐渐增大后逐渐下降,而AIC、S 的变化趋势则完全反之。但其出现转折点的位置一致,即AIC、S 值最小,相应Q2、FIT、Radj2、F 值最大时,该模型最稳定,预测能力最高。因此,本文选用此四元数学模型:

式中n’是样本容量。按此式给出的计算值与其实验值[11]颇 为 吻 合,见 表1 的“-RM(cal.1)”与“Residual 1”。Residual 1 是表1 中-RM(obs.)与-RM(cal.1)之差。

表2 RM 与手性连接性指数的最佳变量子集回归结果Table 2 Results of mCtv and RM with leaps-and-bounds regression
2.2 模型质量的其他验证
首先用方差膨胀因子(variance inflation factors,VIF)[11]评价模型中各自变量的多重相关性,如VIF=1,表明各自变量间完全不相关;当VIF<5时,说明变量间没有明显的自相关性,所建模型是稳定的;当VIF>5时,说明变量间存在明显的共线性,所建模型不能用于估算与预测。VIF 的定义式为:
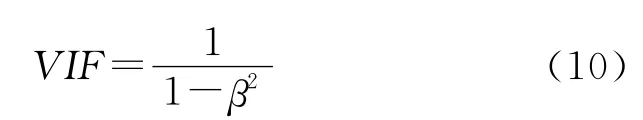
式中:β2为自变量中某一变量与余下变量的相关系数。模型(9)中 各 自 变 量0Cpv、2Cpv、5Cpv、Cvch的VIF 值依次为2.279、1.765、2.331、1.743,它们的VIF<5,说明该模型的多重共线性较低,具有良好的稳定性。
其次用LOO 法(即Jackknifed法)予以检验。其基本思想是从研究总体中每次只剔除一个化合物,用余下化合物的数据建立模型,以此模型对被剔除化合物予以预测。对模型(9)进行LOO 交叉验证共建立18个模型,这18个模型的相关性数据列于表3。由表3 可见,18 个模型的R2在0.968~0.984之间,即在0.973附近上下波动。说明模型(9)对18个手性有机酸的保留指数基本稳定,具有良好的预测能力。
其三,模型(9)的Radj2与Q2相差0.015,远小于0.3,说明该模型没有过拟合,不存在不相关的变量或数据中存在离域点。

表3 用Jackknifed法对模型(9)的稳健性检验Table 3 Robustness tests of model(9)with Jackknifed method
其四,评价QSRR 模型好坏的标准采用估计标准误差S 和数值范围的比例,当小于10%的时候,可以认为此模型是良好的[18]。本文的数值范围为0.53,S=0.028 4,其比值为5.36%,小于10%。
2.3 模型(9)揭示了影响手性有机酸保留指数的本质因素
正如文献[11]所言:“手性化合物的构效关系研究要比一般化合物难度大得多,因为同时要遵循两种规律来构造一个数学模型:不同化合物间的表征和同一分子的两个对映体间的表征。如本研究中的羟酸类化合物和氨基酸类化合物,结构看似非常简单,但要想得到一个好的预测模型是很困难的。”本文首先根据这些手性化合物的保留指数与其分子所含原子结构特征的关系建立新型连接性指数(mGtv),将模型(9)中所含原来的4 种新型连接性指数即0Cpv、2Cpv、5Cpv、Cchv与18种手性有机酸的色谱保留指数(-RM)进行统计回归,建立模型:
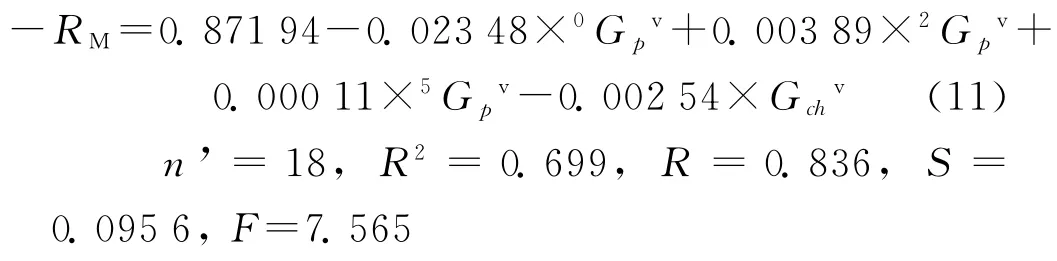
该模型的相关系数达到0.836,与0.85(统计学认为,R>0.85属密切相关关系)较接近,说明这4个参数与保留指数较密切相关。按模型(11)给出的计算值(见表1 的“-RM(cal.2)”,其中Residual 2是表1中-RM(obs.)与-RM(cal.2)之差),此值与对映体保留指数的平均值均非常接近,也佐证两者之间存在密切相关关系。根据Randic及Kier和Hall的连接性指数理论可知模型(11)揭示了原子类型、成键特征、环状结构以及分子的柔韧性和折叠程度等因素对保留指数的影响。然而,进入模型(11)的这些拓扑指数并不能区分分子的对映异构,导致相关性较低。分子旋光异构体的有些理化性质及生物活性存在较大差异,这与其分子间力差异有关。例如本文9对旋光异构体的R 型保留指数与S 型保留指数的比值在1.279~11.500之间,差异如此之大,体现了手性在其中的重要作用。薄层色谱拆分旋光异构体基于二类方法[20]:一是采用手性固定相,二是于展开剂中加入手性添加剂。对于配体交换剂固定相常采用手性氨基酸与铜离子形成的配合物,它可与样品中的旋光异构分子发生配体交换,利用铜离子与旋光异构体之间配合能力的微小差别而达到分离的目的[20]。根据本文9 对旋光异构体的R 型保留指数比S 型保留指数大的事实可见:其一是R 型异构体与铜离子的作用力小于S 型异构体与铜 离 子 的 作 用 力,而 使Rf,R>Rf,S;其 二是分子间作用力越大的旋光异构体,其与铜离子结合力的差别越小,相应RM,R与RM,S较接近。例如R-丝氨酸、S-丝氨酸分子中同时含有-OH、-NH2,能形成更多氢键,分子间力较大,而与铜离子结合力的差别较小,故其Rf,R=0.780 13,与Rf,S=0.729 11较 接 近,其 分 离 因 子(α=Rf,R/Rf,S)为1.07;本文给出的手性指数的比值谓之相对手性(ε=wj,R/wj,S)为1.204 1。又 如R-异 亮 氨 酸、S-异亮氨酸分子中只含有-NH2,形成氢键的数目较少,且分子体积较大,因此其分子间力较小,导致与铜离子结合力的差别较大,相应Rf,R=0.629 39,与Rf,S=0.511 51 有 较 大 差 别,其α=1.23;相 应ε=1.353 2。根据文献[21]的表1与图2可得,分子间力较小的Val、Ile、Ser等氨基酸(它们先出峰)的kL/kD(对于只含1个手性碳原子的手性分子,其R/S构型与L/D 构型具有对应关系)依次为1.69、1.69、1.47,而分子间力较大的Trp、Phe、His等氨基酸(它们后出峰)的kL/kD依次为1.60、1.58、1.63。基本符合本文总结的规律。可见,ε与α 的变化方向及幅度基本一致,即ε基本反映手性薄层色谱对旋光异构体的分离程度。模型(9)与模型(11)比较可见:其一,因模型(9)中的4个参数均来自模型(11),故模型(9)隐含了模型(11)所揭示的分子二维结构特征对其RM的影响;其二,进入模型(9)中的4个参数隐含了分子的三维结构信息——手性特征,揭示了旋光异构体的结构差异。可以认为模型(9)更为全面地揭示了影响本文手性有机酸保留指数的结构因素,致使其相关性、稳健性、预测能力等大幅度提高。
3 结论
(1)在新型连接性指数的基础上引入手性指数,成功建立了手性连接性指数(mCtv)。它在二维空间(隐含mGtv)基本实现了对不同化合物间的表征,在三维空间可对同一分子的两个对映体间的结构差异予以数值化表征。
(2)模型(9)呈现出良好的相关性、稳健性及预测能力。
(3)根据模型(9)可见,所建手性连接性指数揭示了影响手性有机酸保留指数的二维结构因素有原子类型、成键特征、环状结构和分子的手性特征以及柔韧性、折叠程度等三维结构因素。
(4)非氢原子的次序特征值与取代基次序规则基本一致;手性指数wj还与其分子间力有关。从文中实例可见,相对手性ε与旋光异构体的分离因子α 基本一致。
综上所述,可以认为本文为研究手性化合物的结构表征及其构效关系提供了一种简便有效的方法。
[1] Yang J,Wang L J,Guo Q L,et al.Chinese Journal of Chromatography(杨娟,王利娟,郭巧玲,等.色谱),2012,30(3):280
[2] Wu X Y,Wang R,Xie H,et al.Chinese Journal of Chromatography(武晓玉,王荣,谢华,等.色谱),2011,29(12):1205
[3] Wang L P,Fan H J,Wu K H,et al.Chinese Journal of Chromatography(王李平,范华均,巫坤宏,等.色谱),2012,30(12):1265
[4] Li X B,Shi F G,Song Q X,et al.Progress in Pharmaceutical Sciences(李晓冰,石富国,宋沁馨,等.药学进展),2013,37(8):360
[5] Feng C J.Journal of Huazhong University of Science and Technology:Natural Science Edition(冯长君.华中科技大学学报:自然科学版),2011,39(7):18
[6] Chen G H,Xia Z N,Lu Y,et al.Acta Chimica Sinica(陈国华,夏之宁,陆瑶,等.化学学报),2008,66(18):2052
[7] Li Z H,Cheng F S,Xia Z N.Chinese Journal of Chromatography(李正华,程凡圣,夏之宁.色谱),2011,29(1):63
[8] Feng C J,Du X H.Chinese Journal of Chromatography(冯长君,堵锡华.色谱),2001,19(2):124
[9] Li M J,Feng C J,Cai K Y.Transactions of Beijing Institute of Technology(李鸣建,冯长君,蔡可迎.北京理工大学学报),2011,31(12):1469
[10] Liu D,Zhang W J,Xu L.Chinese Journal of Analytical Chemistry(刘东,章文军,许禄.分析化学),2009,37(4):543
[11] Liu D,Zhang W J,Xu L.Acta Chimica Sinica(刘东,章文军,许禄.化学学报),2009,67(2):145
[12] Feng C J.Acta Physico-Chimica Sinica(冯长君.物理化学学报),2010,26(1):193
[13] Feng C J.Journal Huazhong University of Science and Technology:Natural Science Edition(冯长君.华中科技大学学报:自然科学版),2011,39(7):18
[14] Tang Z Q,Feng C J.Journal of Nanjing University of Science and Technology(唐自强,冯长君.南京理工大学学报),2012,36(2):359
[15] Kier L B,Hall L H.Molecular Connectivity in Structure-Activity Analysis.New York:John Wiley,1986
[16] Randic M.J Amer Chem Soc,1975,97(23):6609
[17] Xu S C.Organic Chemistry.Beijing:High Education Press(徐寿昌.有机化学.北京:高等教育出版社),1993
[18] Saiz Urra L,Gonzalez M P,Teijeira M.Bioorganic &Medicinal Chemistry,2007,15(10):3565
[19] Saiz Urra L,Gonzalez M P,Teijeira M.Bioorganic &Medicinal Chemistry,2006,14(21):7347
[20] Zhang Z.Natural Science Journal of the Graduates,Sun Yat-Sen University(张彰.中山大学研究生学刊自然科学版),1994,15(1):59
[21] Huang X J,Ding G S,Wang J D,et al.Chinese Journal of Chromatography(黄晓佳,丁国生,王俊德,等.色谱),2003,21(3):230

