多重吸附同步净化-气相色谱-质谱联用法测定水产品中痕量的二甲苯麝香和酮麝香
丁立平, 蔡春平, 林永辉, 吴文凡, 方 祥
(1.福清出入境检验检疫局技术中心,福建 福清350300;2.福建出入境检验检疫局技术中心,福建 福州350001)
硝基麝香是人类最早合成的人工麝香,由于其具有良好的提香、定香能力并且价格廉价,因而作为香精香料被广泛地应用于个人护理品中。该类物质常见的有20多种,但目前仍在使用的只有二甲苯麝香和酮麝香两种。二甲苯麝香和酮麝香作为个人日用品中的典型合成硝基麝香类有机物,具有极性较小、亲脂憎水性较强、在环境中不易降解的特点。由于人们持续不断地使用使得该物质不断地通过水、大气、土壤等运转途径输入环境[1],而溶解于水中的人工合成麝香可以被藻类和鱼类吸收,并通过食物链的传递蓄积到人体组织内[2,3]。研究表明,人工合成麝香容易造成环境污染并能够诱导、增强其他毒性物质的毒性,最终给人们的身体健康带来隐患[4]。日本、德国、荷兰等国家对个人护理品中合成麝香类污染物质的理化性质、去除机制、分析检测以及生态毒性等方面进行了研究[4-6]。2008 年生效的 挪 威PoHS(Prohibition on Certain Hazardous Substances in Consumer Products)法规规定了消费品中二甲苯麝香和酮麝香的最大限量(MRL)均为0.05 mg/kg[7],但当前国内外尚没有对食品中二甲苯麝香和酮麝香设定最大限量。水产品摄入是人们通过食品摄入富集人工合成麝香的重要途径[4],因此研究水产品中痕量人工合成麝香的检测技术具有显著的现实意义。
人工合成的麝香类物质极性小,沸点相对较低。当前对该类物质的检测方法多为气相色谱-质谱联用法[8-10]和气相色谱法[11],研究对象主要为化妆品[12]、少量环境中捕获的水生生物样品[13]和环境样品[8,14-16]等。文献中关于样品前处理多是采用索氏提取、加速溶剂提取等提取方式,过程繁琐费时,需要使用较大量的有机溶剂,对实验设备的要求较高,不利于样品中该类物质的快速检测。丁立平等[17]采用多重吸附同步净化(multiple adsorption synchronous purification,MASP)前处理方法结合气相色谱-质谱联用法测定了干性样品中的丁烯氟虫腈残留量,所开发的方法简便、快捷、准确且符合方法学考察要求。为了克服已有报道中前处理方法的不足,本文将MASP前处理方法应用到含水量较大的水产品基质中二甲苯麝香和酮麝香的检测中,达到了集提取、盐析、净化同步完成并取得较好净化效果的前处理目的。同时使用气相色谱-质谱联用法对水产品中二甲苯麝香和酮麝香进行定量和定性分析,实现了快速、便宜、简单、有效、可靠的分析目标。
1 实验部分
1.1 仪器与试剂
Agilent 6890N-5975B 气相色谱-质谱联用仪,美国Agilent公司;IKA T-25高速分散器、RV10旋转蒸发仪,德国IKA 公司;ZM200 超离心研磨仪,德国Retsch 公司;3K-15 冷冻离心机,德国Sigma公司。所有接触到样品的试验器皿均需要使用碱性高锰酸钾溶液(其中NaOH 的含量为10%(质量分数),KMnO4的含量为4%(质量分数))浸泡。
丙酮(色谱纯),德国Merck公司;乙腈、甲醇、二氯甲烷、氯化钠、活性炭(carbon)、聚酰胺粉(polyamide)、无水硫酸钠(分析纯),国药集团;中性氧化铝(alumina,48~75μm)、硅胶(silica gel,75~150 μm)、弗 罗 里 硅 土(Florisil)、石 墨 化 炭 黑(GCB),天津Agela Technologies公司。净化剂组成:m(中性氧化铝)∶m(无水硫酸钠)∶m(氯化钠)∶m(GCB)=20∶10∶5∶1。
二甲苯麝香(纯度99.0%,溶于环己烷配成100 mg/L)和酮麝香标准品(纯度99.0%,溶于环己烷配成10 mg/L),德国Dr.Ehrenstorfer公司。
1.2 供试样品
明虾、花蛤、鳗鱼均购自当地市场,取可食部分制成糜样,冷冻保存在-18 ℃冰箱中备用。
1.3 实验方法
1.3.1 基质匹配标准溶液的配制
选择空白基质样品,使用乙腈进行提取得到空白基质提取液。将二甲苯麝香和酮麝香标准溶液分别用丙酮配制成1.00 mg/L标准储备液,于-18℃冰箱中保存备用,使用前根据检测要求使用空白基质提取液稀释成相应浓度的工作溶液。
1.3.2 样品的提取和净化
称取解冻样品5.00 g于50 mL具塞离心管中,加入5.0 g净化剂、20.0 mL 乙腈,以10 000 r/min高速匀浆1 min;在另一个50 mL 离心管中加入20.0 mL乙腈用于清洗高速分散器刀头,并将其合并到前一离心管中,于4 500 r/min 转速下离心5 min;将上清液全部倾倒入100 mL 鸡心瓶中,并于40 ℃下旋转蒸发至干;加入2.00 mL 乙腈溶解定容,定容液经0.22μm 滤膜过滤,待分析。
1.3.3 气相色谱-质谱条件
气相色谱:色谱柱为DB-5 MS毛细管(30 m×0.25 mm×0.25 μm);载 气 为 高 纯 氦 气(纯 度99.999%);恒流模式,柱流速为1.1 mL/min;进样量为1.00μL,不分流进样;进样口温度为280 ℃;柱温升温程序:初始温度70 ℃,保持4 min;以15℃/min升至240℃,保持1 min;以30℃/min升至300 ℃,保持4 min以去除色谱柱中残留的杂质。
质谱:电子轰击离子源(EI源),电子轰击能量为70 eV,离子源温度为230 ℃;单四极杆温度为150 ℃;传输线温度为280 ℃;全扫描(SCAN)模式,扫描范围为m/z 50~450;溶剂延迟14 min;选择离子监测(SIM)模式,二甲苯麝香定量离子为m/z 282,定性离子为m/z 297、265,驻留时间为100 ms;酮麝香定量离子为m/z 279,定性离子为m/z 294、191,驻留时间为100 ms。
1.3.4 标准曲线的绘制
采用外标法定量。将二甲苯麝香和酮麝香标准储备液用空白基质提取液稀释成1、2、10、50、100 μg/kg的系列标准使用溶液。按照1.3.3中条件进行分析,以标准溶液的峰面积为纵坐标(Y)、含量为横坐标(X,μg/kg)绘制校正曲线。
1.3.5 添加回收试验
参照文献[18]的要求进行加标回收试验。本研究按照1.3.2节称取空白样品并加入适量稀释的二甲苯麝香和酮麝香标准溶液,混匀后静置老化30 min制得加标样品,并按照1.3.2节和1.3.3节方法进行前处理和测定。对制得的1.0、2.0、10.0 μg/kg的3个添加水平的加标样品进行测定,每个水平重复测定6次,计算回收率和相对标准偏差。
1.3.6 前处理条件的优化
选择明虾为样品基质,在10μg/kg添加水平下,借鉴文献[19]设计正交试验方案L9(34),考察吸附剂、除色素试剂和提取溶剂等对添加回收率、相对标准偏差、去除色素效果和目标峰等的影响。即(1)3 种吸附剂:中性氧化铝、硅胶和弗罗里硅土;(2)3 种去除色素试剂:活性炭、石墨化炭黑和聚酰胺粉;(3)3种提取溶剂:甲 醇[8,13]、乙 腈[20]和 二 氯 甲 烷[21,22]。根 据 正 交 试 验 方 案 得到9种组合条件(见表1)。其中吸附剂、无水硫酸钠、氯化钠以及除色素试剂组成的净化剂配比均按照1.1 节中的质量比混合配制,并且净化剂、提取溶剂的用量、加标样品的前处理方法与1.3.2节中相同。
1.3.7 基质效应考察试验
配制质量浓度为10μg/L的二甲苯麝香和酮麝香的基质匹配标准溶液和同样质量浓度的溶剂标准溶液,分别按照1.3.3节中条件进行测定,依照公式η=Ai基质标样/Ai溶剂标样计算基质效应[23],考察η 与1的关系,判定基质效应。其中Ai为目标分析物的峰面积,溶剂标准溶液用乙腈配制。
1.3.8 实际样品测定
随机在市场上购买8份养殖水产品和海捕水产品样品,分别是鳗鱼、冷冻带头虾、冷冻马鲛鱼、冻鲨鱼、冰鲜金线鱼、冰鲜黄花鱼、冰鲜海鲡鱼和冷冻虾仁,按1.3.2节和1.3.3 节条件进行前处理和测定。
2 结果与讨论
2.1 样品前处理方法的优化
二甲苯麝香和酮麝香均具有亲脂憎水性,不易溶于水,易溶于苯甲酸苄酯和苄醇等中弱极性的物质,常用的萃取溶剂为正己烷/丙酮(1∶1,v/v)、正己 烷/二氯甲烷(3∶1,v/v)等[21,22]。此外,研究报道表明甲醇溶液也可较好地提取这两个物质[8,13],这表明极性较大的溶剂亦可用作微量二甲苯麝香和酮麝香的提取剂。水产品样品中含有脂肪和蛋白质较多,因此本文在已有研究[17]的基础上,结合乙腈可以沉淀蛋白质和减少脂肪类物质共提取的特点,在试验中选择了与甲醇极性相当的乙腈作为提取溶剂,考察其前处理效果。此外,样品中的色素进入到毛细管柱中会较为严重地污染色谱柱,致使目标物的信号减小并增加色谱峰的拖尾现象,降低柱效,影响色谱柱的使用寿命,为此,试验中就常用的去除色素的3种吸附材料进行了考察。
前处理方法优化试验发现,在1.3.6 节中的9种前处理组合条件下,二甲苯麝香和酮麝香的色谱峰均未受到杂质峰的严重干扰。正交试验所得的添加回收率和RSD 结果见表1。从表1中可见,在中性氧化铝+石墨化炭黑+乙腈(alumina+GCB+acetonitrile)前处理组合条件下的回收率和RSD 结果优于其他组合条件,表明采用乙腈可以较好地提取目标化合物。此外,水产品样品中含有的脂肪类物质会影响亲脂性的二甲苯麝香和酮麝香的净化回收率。表1试验结果表明,相比于硅胶和弗罗里硅土,去脂效果更好的氧化铝具有更好的回收率和稳定性。对比1.3.2节中定容液的色素去除效果,发现石墨化炭黑去除色素的效果更佳。故最终确定组合条件alumina+GCB+acetonitrile用于样品的前处理。
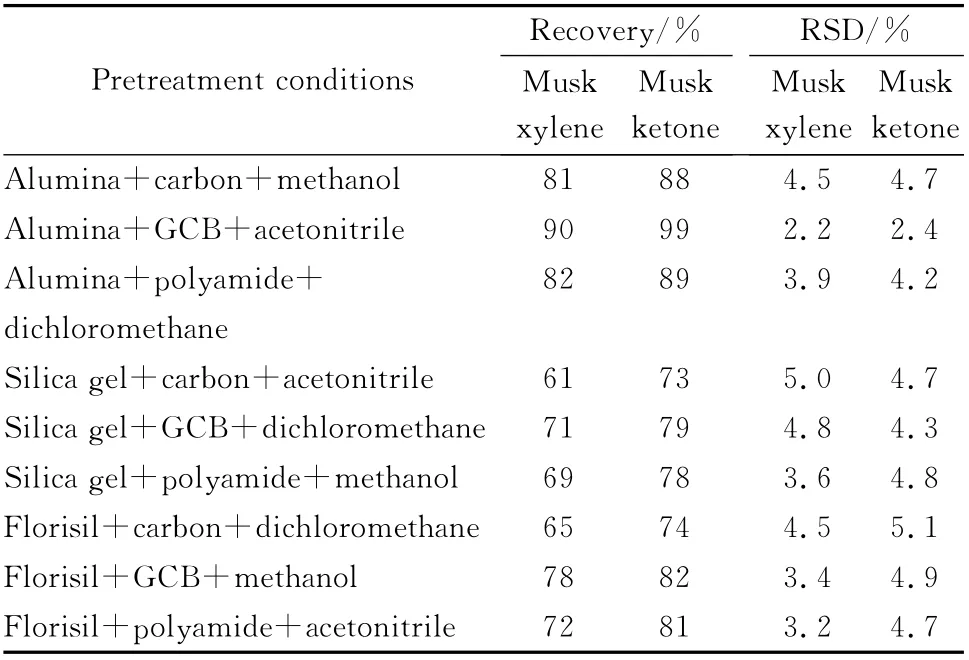
表1 正交试验条件下二甲苯麝香和酮麝香的添加回收率(n=3)Table 1 Recoveries of musk xylene and musk ketone under orthogonal experiment conditions(n=3)
图1 显示了在优化的前处理条件(alumina+GCB+acetonitrile)下3种水产品基质的净化效果。从图1中可见目标化合物不受干扰峰影响,表明优化的前处理条件有较好的净化效果。
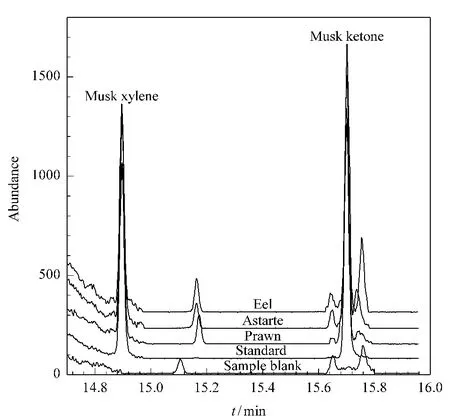
图1 明虾、花蛤和鳗鱼的净化效果Fig.1 Clean-up effect for prawn,astarte and eel samples
2.2 线性范围、检出限和定量限
外标法定量结果表明:二甲苯麝香和酮麝香在1~100μg/kg范围内有良好的线性关系,其中二甲苯 麝 香 的 回 归 方 程 为Y =1 270 X +569,r2=0.999 9;酮麝香的回归方程为Y=1 380 X +70.8,r2=0.999 9。以标准溶液进行样品加标的方式测得方法的检出限(S/N =3)为0.30μg/kg,定量限(S/N=10)为1.0μg/kg。
2.3 添加回收试验
表2 结果显示,在1、2 和10μg/kg添加水平下,二甲苯麝香和酮麝香的加标回收率为79%~104%,相对标准偏差为1.6%~13.3%。结果符合残留物分析的要求[18]。
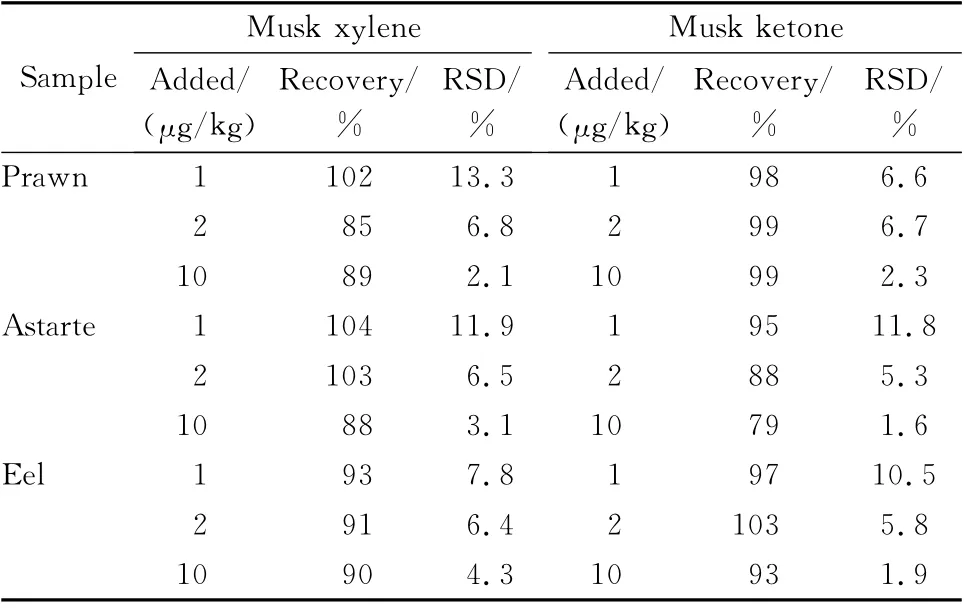
表2 空白样品中二甲苯麝香和酮麝香的加标回收率和相对标准偏差(n=6)Table 2 Recoveries and RSDs of musk xylene and musk ketone spiked in a blank sample(n=6)
2.4 基质效应分析
基质效应考察试验结果表明,3种水产品基质的η在1.02~1.06之间,数值接近1,表明基质效应不明显,说明以上基质经过本方法净化后对质谱检测不产生显著影响。
2.5 实际样品的检测
实际样品检测结果表明,二甲苯麝香均有检出,含量范围为0.45~5.34μg/kg。酮麝香在鳗鱼、冷冻带头虾、冷冻马鲛鱼、冻鲨鱼4种鱼类样品中有检出,含量范围为0.51~1.32μg/kg;其余样品中未检出。但检出的二甲苯麝香和酮麝香的含量均远低于挪威PoHS法规中规定的限量值[7]。
3 结论
本文应用乙腈高速匀浆提取,以中性氧化铝、无水硫酸钠、氯化钠和石墨化炭混合物为净化剂,GCMS检测,外标法定量,建立了水产品中痕量二甲苯麝香和酮麝香的同时分析方法,方法方便、快捷、可靠,适用于水产品中二甲苯麝香和酮麝香的快速检测。
[1] Hu H Y,Wang C,Guo M T.Ecology and Environment(胡洪营,王超,郭美婷.生态环境),2005,14(6):947
[2] Ma Y M,Qu Z H,Liu K M,et al.Asian Journal of Ecotoxicology(马永民,渠志华,刘克明,等.生态毒理学报),2006,1(3):278
[3] Chen D H,Zeng X Y,Sheng Y Q,et al.Environmental Monitoring in China(陈多宏,曾祥英,盛彦清,等.中国环境监测),2008,24(1):67
[4] Zhou Q X,Wang M E,Fan F,et al.Acta Scientiae Circumstantiae(周启星,王美娥,范飞,等.环境科学学报),2008,28(1):1
[5] Zeng X Y,Sheng G Y,Xiong Y,et al.Chemosphere,2005,60(6):817
[6] Yamagishi T,Miyazaki T,Horii S.Bull Environ Contam Tox,1981,26(1):656
[7] Gao Y P,Wu H J.Electrical Appliances(高一盼,伍华嘉.日用电器),2007(12):5
[8] LüY,Hu X F,Wang P H,et al.Environmental Chemistry(吕妍,胡晓芳,王朋华,等.环境化学),2008,27(3):382
[9] Liang G F,Wang J,Zhou J,et al.Environmental Chemistry(梁高锋,王珺,周静,等.环境化学),2010,29(1):113
[10] Hu Z J,Shi Y L,Cai Y Q.Environmental Chemistry(胡正君,史亚利,蔡亚岐.环境化学),2010,29(3):530
[11] Wei N Y,Ma C H,Duan T X.Chinese Journal of Chromatography(魏宁漪,马长华,段天璇.色谱),2005,23(5):565
[12] Ma Q,Bai H,Wang C,et al.Chinese Journal of Analytical Chemistry(马强,白桦,王超,等.分析化学),2009,37(12):1776
[13] Che J S,Wang L P,Song Q J,et al.Environmental Chemistry(车金水,王利平,宋启军,等.环境化学),2011,30(6):1197
[14] Hu Z J,Shi Y L,Cai Y Q.Chinese Journal of Analytical Chemistry(胡正君,史亚利,蔡亚岐.分析化学),2010,38(6):885
[15] Yu R P,Che J S,He E Q,et al.Chinese Journal of Analytical Chemistry(虞锐鹏,车金水,何恩奇,等.分析化学),2012,40(1):159
[16] Zeng X Y,Chen D H,Gui H Y,et al.Administration and Technique of Environmental Monitoring(曾 祥 英,陈 多 宏,桂红艳,等.环境监测管理与技术),2006,18(3):7
[17] Ding L P,Guo J,Zheng L,et al.Chinese Journal of Chromatography(丁立平,郭菁,郑铃,等.色谱),2013,31(8):747
[18] Commission of European Communities.Euro Union Off Bull,2002,221:8
[19] Ding L P,Wei Y H.Agrochemicals(丁立平,魏云昊.农药),2011,50(5):352
[20] Anastassides M,Lehotay S J,Stajnbaher D,et al.J AOAC Int,2003,86(2):412
[21] Bester K.J Chromatogr A,2009,1216:470
[22] Rudel H,Bohmer W,Kermani C.J Environ Monitor,2006,8:812
[23] Xu P J,Gao X S,Tao P,et al.Chinese Journal of Analytical Chemistry(许鹏军,高晓莎,陶晡,等.分析化学),2008,36(11):1515

