大鼠离断肢体灌注的实验研究
王 楠,韩 岩,刘虎仙,陈 淼
(解放军总医院整形修复科,北京 100853)
在当今医疗领域,肾脏、肝脏、心脏的器官移植技术日臻完善,在围手术期器官保存方面积累了很多经验。而对于整形修复外科涉及的断肢断指再植的术前保护,还停留在一个比较低的水平,缺乏与之相匹配的器官保护液。本次实验研究拟通过动物实验,对国内外常用的几种器官保护液在大鼠离断肢体模型中所发挥的作用进行对比,探讨离断肢体再植前是否需要对肢体行灌注处理,找出适用于离断肢体灌注保护的器官保护液,优化灌注效果,提高肢体再植的成功率。报告如下。
1 材料和方法
1.1 试剂与仪器
10%水合氯醛溶液,0.9%氯化钠注射液,ViaSpan(BELZER UW)器官冷藏液(Bristol Myers Squibb B.V. 生产),CUSTODIOL HTK 溶液(FRANZ KOEHLER CHEMIE GMBH 生产),乳酸钠林格注射液,肝素钠注射液,地塞米松磷酸钠注射液,Dulbecco's Modified Eagle Medium 细胞培养液(北京鼎国昌盛生物技术有限公司生产),中性福尔马林溶液,苏木精粉剂(上海化学试剂公司进口分装),伊红粉剂(北京化工厂产品)。生物组织自动脱水机(8T-12K 亚光医用电子技术研究所),病理组织包埋机(BM-1 安徽省电子科学研究所),切片漂烘温控仪(QP-B2 安徽省电子科学研究所),光学显微镜(ICC50 LEICA,德国),工作站计算机(Z470 联想,中国),全自动生化分析仪(7170 HITACHI,日本)。
1.2 大鼠离断肢体缺血模型的制备
健康成年Wistar 大鼠(雄性)40 只(体重在300 ~400g,由解放军总医院第一附属医院实验动物中心提供)。随机分为4 组。用10%水合氯醛溶液1.5mL 腹腔注射麻醉。约5 分钟麻醉生效后双下肢、腹部及背部剃毛,将大鼠置于实验台上,固定四肢。在双侧腹股沟处设计弧性手术切口。沿标记线切开大鼠皮肤,分离皮下脂肪组织,分离出大鼠股动脉、股静脉及股神经,术中结扎并离断同侧旋髂动静脉及阴部动静脉,在骶尾部行锐性分离,在股骨头处离断髋关节,使股动静脉得到最大限度的暴露。通过(0,7 ×19mm)一次性使用静脉留置针对股动脉进行穿刺,插管成功后,绑管线固定牢靠。向股动脉灌注肝素盐水,行抗凝保护。同理对股静脉穿刺插管后,结扎股动、静脉。对侧肢体行相同处理后,沿标记线完整离断双侧下肢,将大鼠下肢皮肤由远端至近端连续对位缝合,包裹骨骼肌肉组织,减少暴露面积,避免过度蒸发。
1.3 大鼠离断肢体缺血模型的实验处理
A 组每只大鼠离断下肢行UW 液灌注;B 组每只大鼠离断下肢行HTK 液灌注;C 组每只大鼠离断下肢行林格氏液+地塞米松+低分子肝素钠灌注;D 组每只大鼠离断下肢作为对照组,单纯行生理盐水灌注,灌注液自股动脉灌入,使用输液泵控制滴速及灌注压,排除肢体过度肿胀及远端灌注不足的影响。将滴速设置为12mL/小时,连续灌注24 小时,灌注全程在4℃冰箱内进行。
1.4 标本取材
自大鼠双下肢离断起计时,在第4h、8h、12h、16h、20h、24h 时间点取1mL 灌出液进行生化指标检测。在第12h、24h 时间点取肢体标本做病理切片。
1.5 观察指标
1.5.1 大鼠肌肉、血管组织结构病理变化
将大鼠离断下肢固定于木板上,于膝关节上1cm 处取同时包含动静脉的肌肉组织块(1cm* 1cm* 1cm),依次编号。将编号的组织块用10%福尔马林固定48h,再置于90%、95%乙醇各12h,用无水乙醇脱水2 次(每次12h),二甲苯透明2 次(每次12h),以上操作均在常温中进行。之后,于60℃浸蜡。浸蜡过程中使组织块平展,标本应完全浸泡在浸泡液内。将石蜡包埋好的组织块置于滑动式切片机上切片,切片厚度为5um,依次编号,标记好顺序。于45℃恒温水浴箱中展片,捞至常规大小的载玻片上,所有切片行苏木素-伊红(HE)常规染色。在光镜下观察组织结构变化。
1.5.2 大鼠离断肢体灌出液ALP、ALT、GLU 的生化指标检测
按相应时间点,采用不同灌注液对大鼠离断肢体进行灌注,在股静脉插管处收集灌出液,依次编号,标记好灌注时间及灌注液种类,保存于–20℃冰箱中,待送临床试验检测中心生化室,置于日立7170 型全自动生化分析仪中,进行ALP、ALT、GLU生化指标检测。
1.6 统计学处理
使用SPSS19.0 统计软件对得数据整理,进行方差分析,结果使用均数±标准差表示,取α =0.05为检验水准,P <0.05 为差异有显著性。
2 结果
2.1 在光镜下观察组织结构病理变化(附表1)

附表1 光镜观察组织结构比较

图1
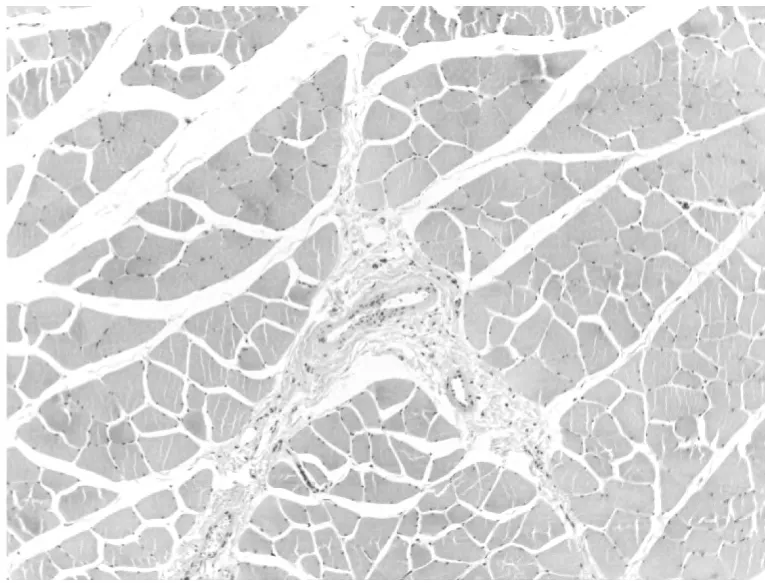
图2

图3
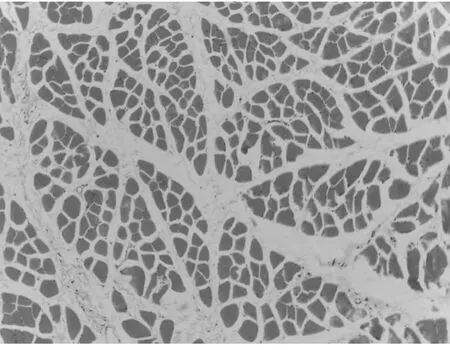
图4
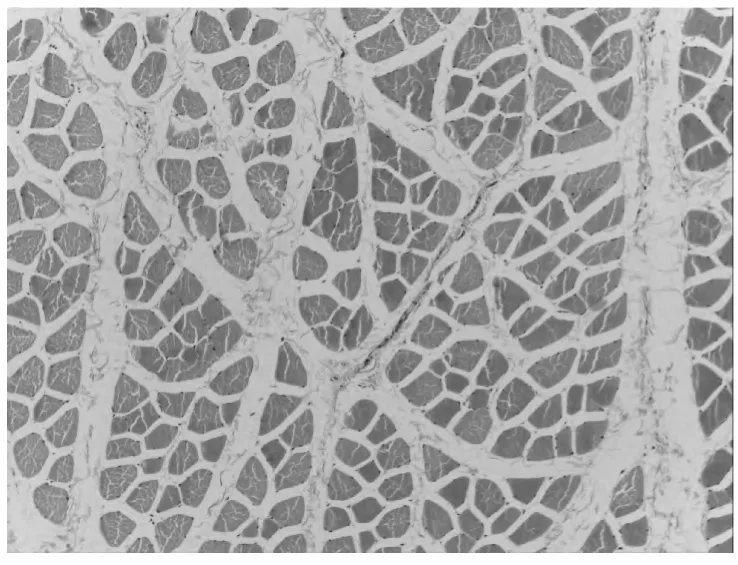
图5
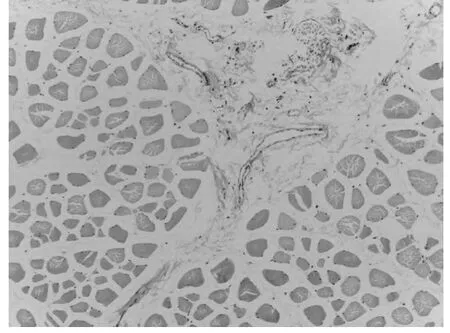
图6
2.1 相关生化指标的检测结果(附表2、附表3、附表4)
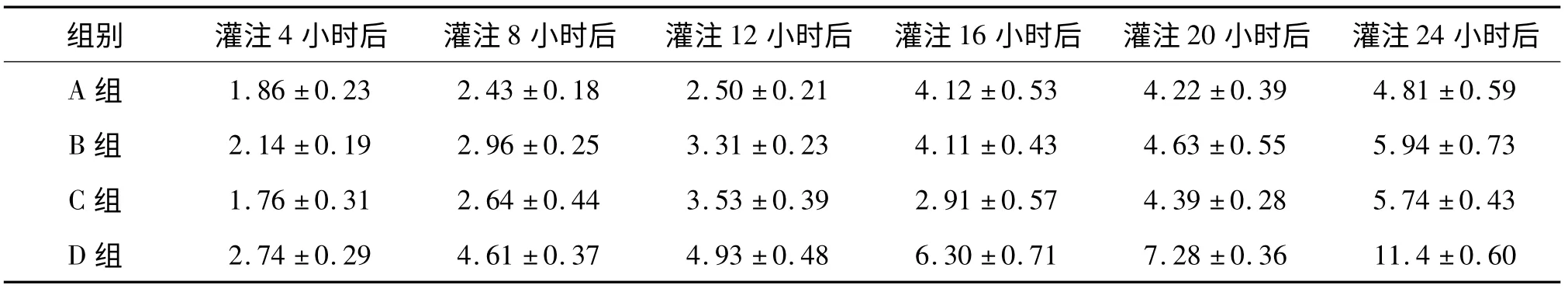
附表2 组织中ALP 含量的变化分析
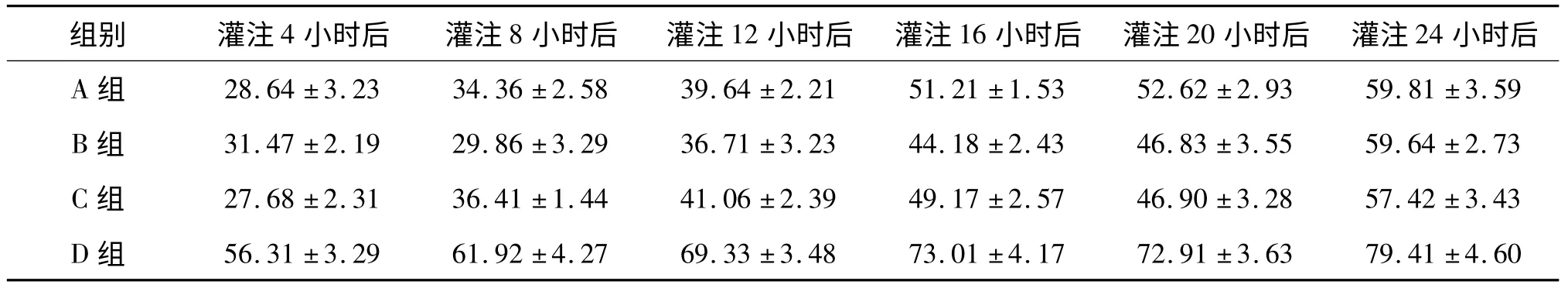
附表3 组织中ALT 含量的变化分析
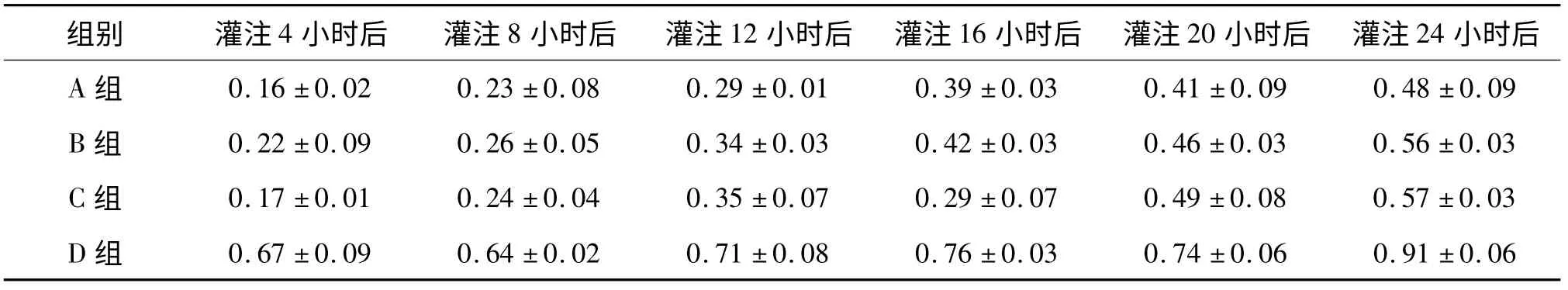
附表4 组织中GLU 含量的变化分析
通过统计学分析,对比四组数据,可以发现A、B、C 组与作为对照组的D 组存在显著性差异(P ﹤0.01),即使用UW 液、HTK 液及林格氏液+地塞米松+低分子肝素钠灌注液对大鼠离断肢体进行灌注与单纯使用生理盐水灌注组相比较,在相同时间条件下ALT、ALP 升高缓慢,而GLU 含量降低缓慢。A、B、C 组间相比较无统计学差异(P ﹥0.05)。随灌注时间延长,各组灌出液中ALP、ALT 均出现进行性增高,其中D 组升高幅度明显高于其余三组。随灌注时间延长,各组离断肢体灌出液中GLU 含量逐渐降低,其中D 组降低幅度同样明显高于其余三组。A、B、C 组之间三项生化指标变化无统计学差异。
3 讨论
在现代战争中,随着大规模杀伤性武器的不断出现,枪弹伤、爆炸伤的比重明显增加,发生肢体离断、损毁的情况在野战外科工作中十分常见,英国医学杂志《柳叶刀》调查报告显示,在伊拉克战场因四肢损伤而致残的人数占到伤残总数的20%,而到利比亚内战时期,这一比例则上升到40%[1]。受制于战场特殊因素所限,很多伤员无法得到及时有效的治疗,最终导致肢体外观的畸形及功能的丧失,对部队后续战斗力的回复和伤员今后的生活质量、心理健康造成了严重的影响。早在上世纪60年代,随着显微外科的发展,断指、断肢再植就成为了可能,整形外科和显微外科的医生在肢体功能重建领域取得了一系列引人瞩目的成就,各种新技术、新方法、新材料不断应用于临床。但在战时,四肢损伤致残率却一直居高不下,说明在战场开展断肢再植手术还存在很多问题。真正成功的肢体移植,不仅是要肢体成活,更重要的是功能恢复,这都与对离断肢体的保护有直接关系。但战地医院普遍设立在距离一线战场较远的后方,后送转运时间较长,在这期间如何对离断肢体进行保存,是否需要像肝肾移植一样对肢体进行灌注保护,由于没有专门用于肢体灌注的液体,加之肢体与肝肾等实质器官存在解剖学差异,使用哪种灌注液才能达到更好的保护效果,提高肢体再植的成功率及相关功能的恢复,这些问题都有待进一步研究。
在当今医疗领域,肾脏、肝脏、心脏的器官移植技术日臻完善,已广泛应用于临床,在围手术期器官保存、术后预防缺血再灌注损伤,抗免疫排斥反应等方面也积累了很多宝贵的经验。其中在肾脏移植前采用UW 液灌注,心脏移植前采用HTK 液灌注已在国际上达成共识,可以起到很好的器官保护功能,根据各器官组织对缺氧缺血耐受的不同,有效的组织灌注通常可以保存肾脏72 小时,肝脏近30 小时,心脏24 小时[2]。而对于整形修复外科涉及的断肢断指再植的术前保护,还停留在一个比较低的水平,一般认为在常温下缺血不超过6 ~7 小时,离断肢体基本上可以再植成活。超过10 ~12 小时,成活率则显著降低。保存方式视运送距离而定,如受伤地点距医院较近,可将离断肢体用无菌敷料或清洁布类包好,不做特殊处理。如远距离运送,则应采用干燥冷藏法保存,将断肢用无菌或清洁敷料包好,放入塑料袋中再放在加盖的容器内,外周加冰块保存,避免断肢与冰块直接接触,也不使用其他液体浸泡,也没有与之相匹配的器官保护液出现[3]。研究表明,一种有效的器官保护液需要具备以下几种保护效果:1.减轻低温条件下易出现的细胞水肿;2. 可以预防细胞的酸化作用,减少酸性物质堆积;3. 使细胞内环境保持稳定,减少正负离子跨细胞迁移;4. 减少缺血再灌注损伤,抑制氧自由基破坏作用;5. 提高细胞氧化磷酸化水平,增加糖代谢水平[4]。国外学者对UW 液及HTK 液的实验研究已十分透彻,充分肯定了两种器官保护液在抑制低温水肿、细胞损伤方面的作用,临床试验结果表明:UW 液、HTK 液均可明显延长组织器官对低温缺血的耐受,可以使器官功能的损害从33%分别下降到23%和28%。证明UW 液对肾脏、肝脏、HTK 液对心脏具有良好的保护效果[5]。但也有研究报道提到器官保护液的高钾高钠离子对血管内皮存在一定程度的损害。同时UW 液粘滞性很高,也可对脏器细胞及血管内皮细胞造成不同程度的损害[6]。另一方面UW 液与HTK 液均无法国产,只能通过国内代理商引入中国市场,这就间接导致两种器官保护液价格十分昂贵,单纯的术前器官保护性灌注就需要花费上万元,给患者及家属造成巨大的经济负担。本实验中涉及的自配灌注液在南方医科大学附属医院等单位均成功应用于临床,并证实有效[7]。
本次实验研究通过动物实验,对国内外常用的几种器官保护液在大鼠离断肢体模型中所发挥的保护作用进行比较,论证离断肢体再植前是否需要对肢体行灌注保护,找出适用于离断肢体灌注保护的器官保护液,优化灌注效果,提高肢体再植的成功率。
实验中所采纳比较的生化指标的意义:谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、葡萄糖(GLU)。正常状态下,大鼠下肢骨骼肌细胞内含有大量的碱性磷酸酶(ALP)和谷丙转氨酶(ALT)。当离断肢体后,骨骼肌细胞因缺血致肌细胞损伤,细胞膜发生破裂,大量的生物活性酶类释放入血,故可以通过测定ALP、ALT 酶的数量变化来判定离断肢体肌细胞缺血损伤的程度。谷丙转氨酶(ALT)主要在肌细胞内含量较高,随着缺血时间延长,其数值变化具备一定的规律性。国外研究发现,缺血损伤发生早期,谷丙转氨酶(ALT)随时间延长呈直线上升趋势,到达峰值后逐步回落。而碱性磷酸酶(ALP)与ALT 不同,主要分布于毛细血管内皮细胞的基底膜,同时其在细胞肌膜上均匀分布着呈线性排列的酶颗粒。研究表明ALP 的变化规律与谷丙转氨酶(ALT)大致相同,都是先上升后下降,最后随着缺血时间的进一步延长最终消失[8]。葡萄糖(GLU)是肌体糖代谢的重要物质,也是主要的供能物质。当离断下肢开始发生缺血损伤时,肌体正常的有氧氧化途径障碍,直接供能物质ATP 产量迅速下降,大量肌酸磷酸在转化为ATP 供能的同时,糖酵解途径单方面加强,使得GLU 含量显著下降[9]。
大鼠离断肢体缺血模型建立后不同时间组织的变化的意义。实验表明,在同样缺血的条件下,随着缺血再灌注时间的延长,组织的损伤情况越重,即再灌注损伤的严重程度与时间成正比,而在行肢体再植术前,对离断肢体进行灌注处理,可以有效的减轻水肿,减少氧自由基等有害成分的生成,达到增强肢体和相关机体抵抗再植及再灌注损伤的能力,使组织功能得到最大限度的保存,为提高肢体再植手术成功率提供一定的基础。离断肢体的损伤自离断起同步发生,组织细胞由于缺血发生细胞水肿,渗透压也随之发生改变,随着时间的推移,氧自由基等有害物质产生增多,导致缺血再灌注损伤的发生。因此在离断之初就进行离断肢体灌注保护是十分必要的。通过实验可以发现即使采用灌注保护,再植的最佳手术时间是在离断12 小时内,临床上也通常是采用12 小时以内作为手术的最佳时机[10]。
光镜下组织大体结构的变化情况,光学显微镜可以观察组织细胞的大体形态,从本部分实验病理结果可以发现,各组随着时间的延长,组织损伤情况逐渐加重。而各灌注组与对照组相比较,在相同时间点损伤程度较轻,病理变化较小。各对照组之间进行比较可发现UW 液灌注组损伤程度明显轻于其他三种灌注保护液。说明对离断肢体行灌注处理具有细胞保护作用,其中UW 液保护效果最佳,但随着时间推移,即便使用灌注液进行保护处理,组织损伤仍会不可避免的发生、加重。因此应谨慎选择肢体再植时间,避免出现累及全身的病理变化。
灌注保存时需要注意的问题。临床资料表明:影响再植肢体功能恢复,造成组织损伤的主要原因是由缺血损伤及血液再通后的再灌注损伤共同组成。而其中的关键在于减少肢体缺血时间,在行灌注液灌注保护前尽可能缩短机体缺血时间,尽快通血,才能有效的减低缺血损伤及再灌注损伤[11]。同时使用灌注液进行灌注保护可以有效的稀释毒性代谢产物,减轻组织损伤。在灌注过程中合理设定灌注压力,通常情况下应低于正常组织血流速度,避免因压力过大对组织造成机械性损伤,因为离断肢体极易发生细胞水肿,导致细胞脆性增加,对损伤的耐受程度减低。整个灌注过程在低温下进行(4℃),在低温条件下,离断肢体温度降低可以有效的减少无氧代谢,使因为无氧代谢产生的自由基等有害物质减少,同时也可以在一定程度上减轻炎症反应。
结合光镜、电镜分别观察各组间离断肢体肌肉组织的大体损伤情况以及提取的生化指标可以发现:三种灌注液UW 液、HTK 液及林格氏液+地塞米松+低分子肝素钠混合灌注液均可以对离断肢体起到保护作用,延长细胞活性时间,且在对肢体保护作用上要强于使用生理盐水空白灌注。其中UW 液对离断肢体的保护作用明显强于其他两种灌注液,HTK 液与林格氏液+地塞米松+低分子肝素钠混合灌注液在对组织保护的作用上差异不大。
[1]Mowlavi A,Neumeister MW,Wilhelmi BJ,et al. Local hypothermia during early reperfusion protects skeletal muscle from hemia-reperfusion injury[J]. Plast econstr Surg,2003,111(1):243-251.
[2]Wilson YT,Lepore DA,Riccio M,et al. Mild hypothermia ptotects against ischaemia-reperfusion injury in rabbit skeletal muscle[J]. Br J Plast Surg,2007,50(5):343-349.
[3]夏穗生. 临床移植医学[M]. 杭州:浙江科学技术出版社,1999.95
[4]Lancerotto L,Tocco I,Salmaso R,Vindigni V,Bassetto F.Necrotizing fasciitis:classification,diagnosis,and management[J].The journal of trauma and acute care surgery,2012,72(3):560-566.
[5]Edlich RF,Cross CL,Dahlstrom JJ,Long WB,3rd. Modern concepts of the diagnosis and treatment of necrotizing fasciitis[J]. J Emerg Med,2010,39(2):261-265.
[6]Dufel S,Martino M. Simple cellulitis or a more serious infection?[J]J Fam Pract,2006,55(5):396-400.
[7]赵闻雨,曾力,朱有.器官保存技术新进展[J]. 中华移植杂志(电子版),2011,3(5):233-236.
[8]Takei S,Arora YK,Walker SM. Intravenous immunoglobulin contains specific antibodies inhibitory to activation of T cells by staphylococcal toxin superantigens[see comment][J]. J Clin Invest,1993,91(2):602-607.
[9]Anaya DA,Bulger EM,Kwon YS,Kao LS,Evans H,Nathens AB. Predicting death in necrotizing soft tissue infections:a clinical score[J]. Surg Infect(Larchmt.),2009,10(6):517-522.
[10]李继峰,顾玉东,俞彰,等. 超氧化物歧化酶灌注对大鼠离体血管平滑肌组织结构影响[J]. 复旦学报(医学版),2004,31(1):66-69.
[11]高宏,臧旺福,田海,等. 低温氧合血微流量持续灌注保存大鼠心脏的效果[J]. 中华器官移植杂志,2007,28(9):537-540.

