多糖和土壤团聚体对扁穗冰草根鞘形成的影响
罗丽朦,王丽学,秦立刚,王 堃
(中国农业大学动物科技学院,北京 100193)
根鞘(rhizosheath)是植物根系表面粘附着大量土壤颗粒形成的、具一定厚度[1]、长度15 cm到30 cm 左右的鞘状物。Volkens[2]、Bailey 和 Scholes[1]、王瑾[3]、Rhian J[4]等人都曾对世界的不同干旱地区的植物进行调查,发现并报道了根鞘在许多植物根系中的存在。相关研究表明,根鞘对生长在干旱逆境的植物有保水[5-7]、防风固沙、增进养分吸收[3]和形成微生物库[8]等多种生态意义。
根鞘是植物根系、土壤、微生物相互作用的产物,导致它形成的主要分泌物成分及其作用机理是研究这个生理适应行为的重要课题。考虑到植物的分泌物中,糖类物质本身已经具备多羟基的亲水性结构,如果再连上长的疏水链就可以产生具有表面活性的物质;同时多聚糖上还可能连有一定的蛋白质及连接糖醛酸所需的阳离子钙和镁[9-10],所以多糖很可能是根鞘中的粘结物质之一。
冰草属(Agropyron)植物主要分布于我国西北部和中部的干旱草原或沙区,典型的旱生植物,极耐干旱。前人调查研究报道[3]扁穗冰草具有较明显的根鞘,本文以扁穗冰草为研究对象,将具体的分泌物成分与环境因子的作用结合起来综合研究分析,以期探索根鞘的形成、作用机理,为揭示具根鞘植物对环境因子的响应机理提供新的思路。
1 材料与方法
1.1 试验地概况
研究区位于河北省丰宁满族自治县西北部的鱼儿山牧场中国农业大学科技攻关试验站,地理坐标为东经 114°16'北纬41°44',海拔 1460 m。1 年中较长时间受蒙古高压寒冷干旱气候控制,年均温1℃,≥0℃年积温2000—2800℃,≥10℃年积温1500—2200℃;无霜期80—100 d;年降水量350—450 mm,主要集中在7—9月,占全年降水量的79%;年蒸发量1700—2300 mm,是降水量的4倍多;全年盛行西风、西北风,年均大风日为60—80 d,春季干旱少雨,风沙较大,年均风速4.3 m/s。
试验地土质为栗钙土,总体土壤肥力不高、土层较薄。地上植被主要由有冰草(Agropyron cristatum)、羊草(Leymus chinense)、克氏针茅(Stipa krylovii)、冷蒿(Artemisia frigida)、茵陈蒿(Artemisia Capillaris)、糙隐子草(Cleistogenes squarrosa)、二裂委陵菜(Potentilla bifurca)、星毛委陵菜(Potentilla acaulis)、披碱草(Elymus dahuricus)等组成。
1.2试验设计与方法
1.2.1 样地选择及样品采集
在试验区随机选取4个扁穗冰草单优种斑块,在其中设置1 m×1 m样方,左右间隔5—7m处设置重复(3个重复/斑块),梅花取样法在各样方中进行扁穗冰草根系及土壤样品的采集(5个采样点/样方)。将各样方中5个整株连根的10cm土柱用保鲜膜包好带回实验室做根鞘指标测定。
1.2.2 土壤指标测定
将各样方中整株连根土柱去除根系后的根鞘周围环境土,均匀混合后分成3份土壤样品。第1份用烘干法土壤含水量测定;第2份土壤根据干筛法[11-12]测定土壤团聚体构成:将风干土壤置于8411型电动振筛机上,顺次通过孔径为 4、2、1、0.5、0.25 mm的筛组,对各级筛子上的样品分别称重(精确列0.01 g),记录数据,计算各级干筛团聚体的百分含量和<0.25 mm的团聚体的百分含量,每个处理的土壤做3次平行测定;第3份用TOC法测定土壤有机碳含量。
1.2.3 根鞘指标的测定
将采集的扁穗冰草样品,取下根鞘,同一株植物的根鞘放入离心管中,冷冻干燥至恒重待用。将每个样方中所有植株的根鞘作为一个整体,借助根系分级软件测量并统计根鞘的相对厚度;采用热水醇沉法[13-18]提取根鞘中粗多糖,计算出膏率,用优化后的高效离子交换色谱技术[19]检测根鞘中粗多糖各组分含量。高效离子交换色谱条件及优化:为了避免TFA浓度过高碳化样品,同时要尽可能使粗多糖水解完全,本文对2 mol/L TFA的用量(2、3、4 mL)和水解时间(1、2、4 h和6 h)进行考察,最终确定2 mol/L TFA的用量为4 mL,水解时间为4 h(图1)。
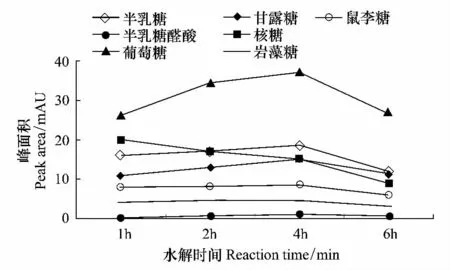
图1 水解时间对产物峰面积的影响Fig.1 Effect of reaction time on the peak areas
粗多糖检测的色谱条件:采用syminetry C18的色谱柱(150 mm×4.6 mm);流动相 A 为0.05%三氟乙酸水溶液,B为乙腈;运用梯度洗脱的方式洗脱;荧光检测激发波长为313 nm,发射波长为358 nm;柱温30℃;流速1 mL/min。该方法在荧光检测下检出限为 1.45×10-3—4.53×10-3mol/L。且各组份回归方程的相关系数均大于0.99具有较高的线性相关度。
1.3 数据分析
采用Excel 2007对实验数据进行初步的处理和作图,运用Spss 18.0软件对根鞘周围土壤指标和根鞘样品指标做方差分析、因子分析、相关分析和多元回归分析,并且计算拟合度、残差、截距等相应的检验结果,结果用平均值±标准差表示。
因子分析的原理是根据因子载荷矩阵的不唯一性,对初始公共因子进行因子旋转,使每一个变量仅在公共因子上有较大的载荷,而在其余公共因子上的载荷较小。用斜交旋转的方式对17个原始观测项目做因子分析,还摒弃了因子间彼此独立的限制,使因子的实际意义更易解释。在斜交旋转分析中,模式矩阵即为因子载荷矩阵。结构矩阵是公共因子和原始变量的相关矩阵[20]。
2 结果与讨论
2.1 多糖成分组成及含量
用优化后的色谱条件对扁穗冰草样品进行分析,结果其多糖中均检出:半乳糖(Gal)、半乳糖醛酸(Gal-UA)、葡萄糖 (Glu)、甘露糖 (Man)、核糖(Rib)、岩藻糖(Fuc)、鼠李糖(Rha),说明根鞘提取的粗多糖中热水溶性多糖含有以上各组份。出峰时间见图2,多糖成分组成及各单糖含量通过标准曲线进行校正获得。各组份所占多糖比例含量依次为:1.423∶0.049∶2.134∶0.790∶1.584∶0.267∶0.413。
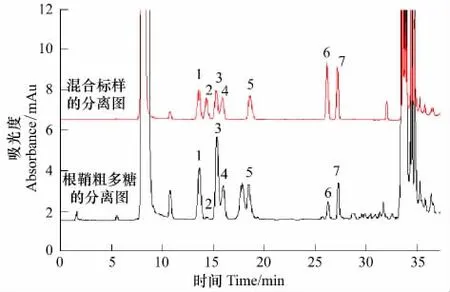
图2 样品的p-AMBA衍生物的色谱分离图Fig.2 HPLC separation of p-AMBA derivatives of samp le1:半乳糖(Gal),2:半乳糖醛酸(Gal-UA),3:葡萄糖(Glu),4:甘露糖(Man),5核糖(Rib),6:岩藻糖(Fuc),7:鼠李糖(Rha)
2.2 粗多糖中各成分、土壤质地、根鞘表观特性三类指标的因子分析
2.2.1 因子分析结果
本文采用5次因子斜交旋转后收敛,除甘露糖提取信息是0.565外,其他变量提取信息均超过70%,其中以根鞘相对体积提取信息(0.949)最高。由因子分析前3个主成分的贡献率分别为58.839%、23.971%和 7.277%,累计可解释原始变量90.087%的信息,说明了选择这3个主成分来分析原始变量的效果比较好。
由模式矩阵输出的结果知:第一主因子主要由半乳糖、葡萄糖、核糖、含水量、有机碳含量、4 mm团聚体、2 mm团聚体、1 mm团聚体、0.5 mm团聚体和<0.25 mm团聚体决定,其载荷值均在0.8以上,该主因子反映了形成根鞘的土壤结构;第二主因子主要由甘露糖量、岩藻糖量、鼠李糖量3个变量决定,其在该主因子上的载荷全在0.7以上,反映了根鞘分泌物中的多糖组分;第三主因子主要由半乳糖醛酸、根鞘相对体积和0.25 mm团聚体3个变量决定,三者的载荷都在0.6以上,反映形成根鞘的主要原因(图3)。
同时,由结构矩阵分析结果得根鞘相对体积与第二个因子的相关性达到显著水平,其相关系数为0.680。并且由三大主成分间的相关矩阵结果显示:第2个和第3个主成分间的相关性达到显著水平,其相关系数为0.559(表1)。说明甘露糖、鼠李糖、岩藻糖等多糖物质的含量和占多糖的比例也对根鞘的形成有一定的影响。
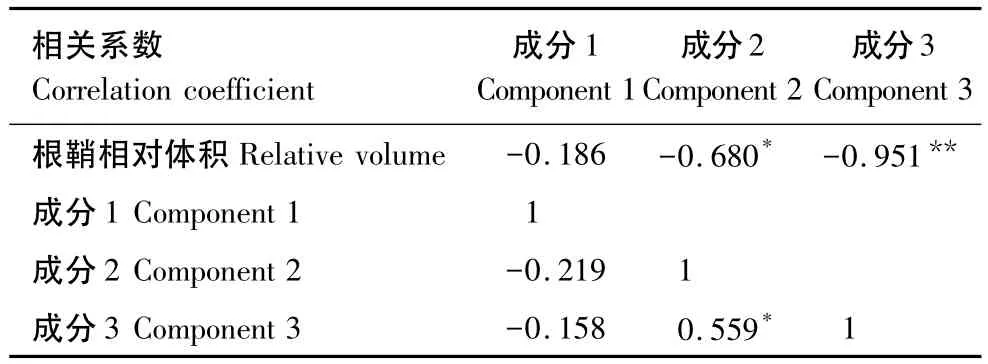
表1 因子分析的结构矩阵与成分相关矩阵结果Table 1 Structure matrix and component correlation matrix of common factor
2.2.2 讨论
第一主因子中,除包括土壤团聚体、土壤含水量和土壤有机碳含量等土壤结构指标外,还包括葡萄糖、半乳糖和核糖3个多糖指标。其中葡萄糖构成了主要的细胞壁骨架,它通过(1—4)β连结形成纤维素微纤维,进一步环绕整个细胞;核糖主要分布在植物及微生物细胞核中,是生命物质的结构组分。推论葡萄糖和核糖可能来自植物根部脱落的细胞或微生物的细胞核内。第一主因子反映了形成根鞘的环境土壤结构特性。
第二主因子包括甘露糖、岩藻糖和鼠李糖,代表生物分泌出的多糖主要组分。
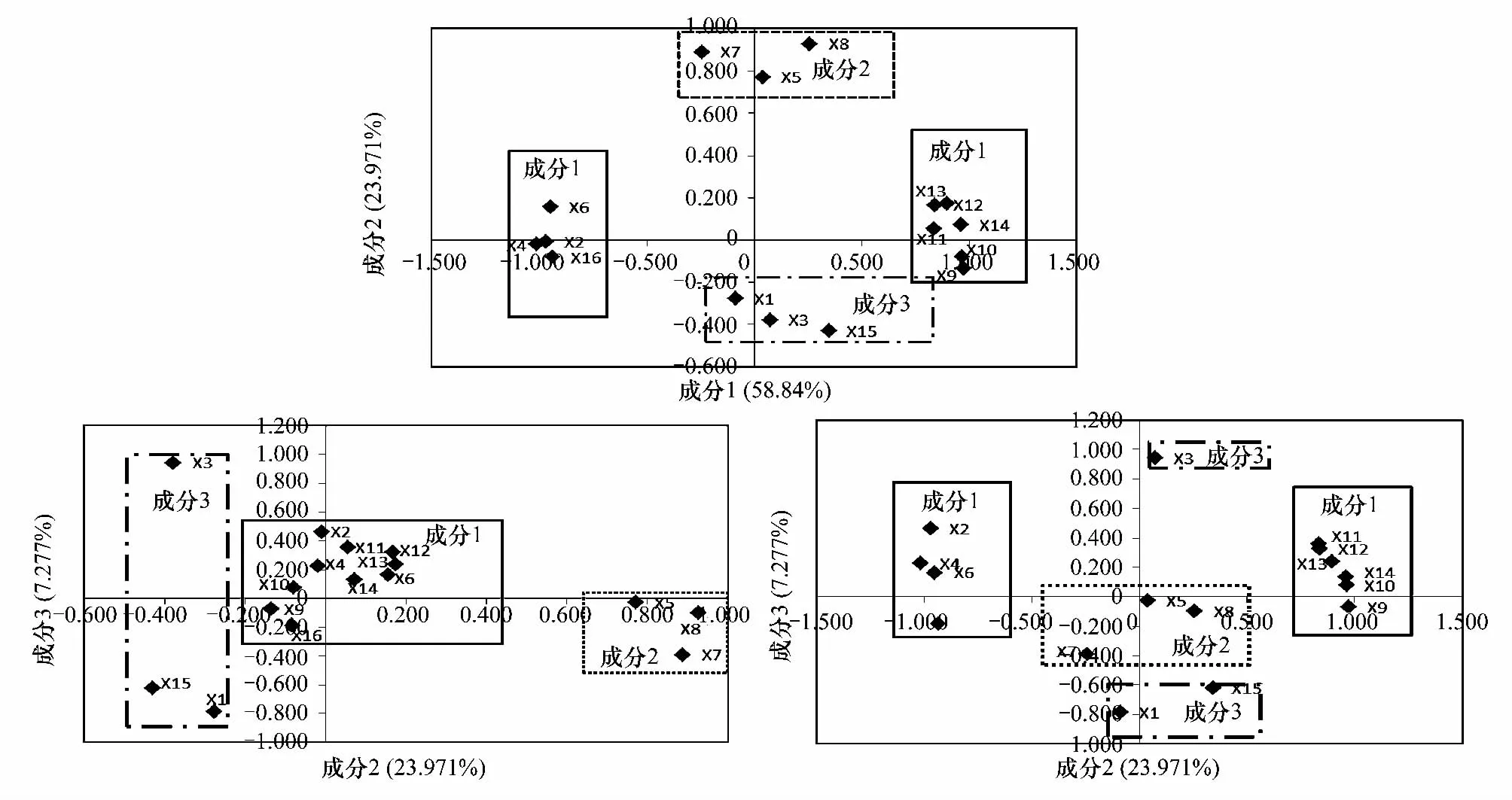
图3 因子分析的结果Fig.3 The result of common factor
根鞘相对体积、0.25 mm团聚体和半乳糖醛酸组成了第三主因子。据报道同聚半乳糖醛酸(HGAs)和鼠李糖半乳糖醛酸(RGI)是果胶的最基本的两种组成结构[21]。同聚半乳糖醛酸经甲酯化和去甲酯化的作用过程,可以与钙离子交联结合形成较大分子量的胶状物[22]。由此表明第三主因子反映了根鞘形成的主要原因。
2.3 相对体积与根鞘内粗多糖、根鞘周围土壤特性的相关分析
采用SPSS软件分析各指标的Pearson相关系数(表2),以揭示根鞘根系特性与根鞘周围土壤特性之间的内在关系。
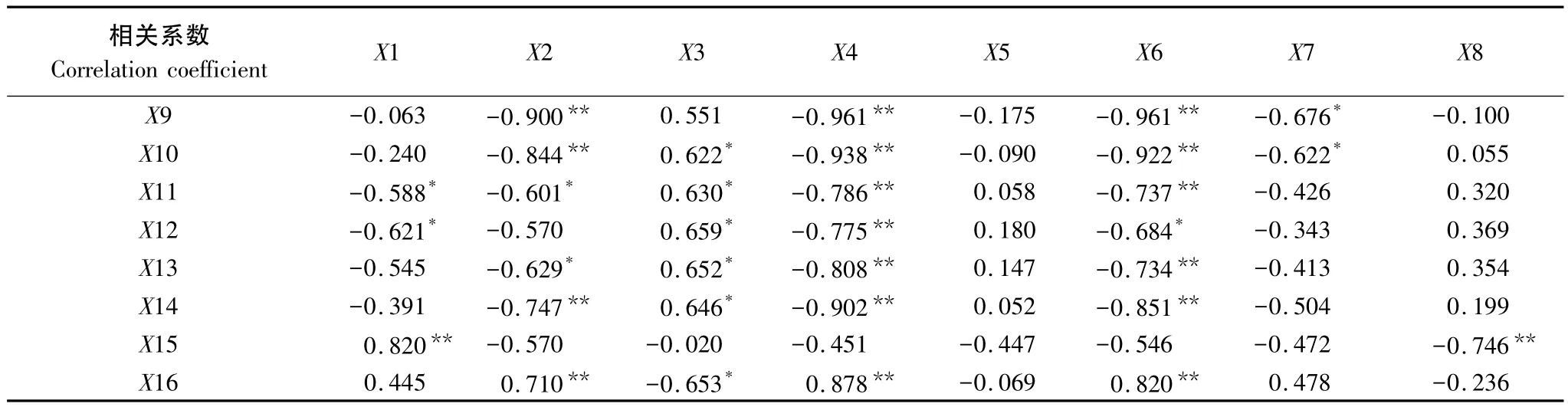
表2 根鞘根系特性与根鞘周围土壤特性之间的相关性Table 2 Correlation between rhizosheath root characteristics and surrounding soil properties
2.3.1 相关分析结果
与根鞘的相对体积呈显著性相关(P<0.05)的是根鞘周围环境土的4、2、0.25 mm级土壤团聚体以及鼠李糖含量,其相关系数依次为-0.588、-0.621、0.820、-0.651,尤其是 0.25 mm 级的团聚体占总团聚体的百分量与根鞘相对体积为极显著相关。
半乳糖与葡萄糖、核糖、岩藻糖、4 mm和1 mm土壤团聚体呈显著相关,与含水量、有机碳、0.5 mm和小于0.25 mm土壤团聚体呈极显著相关。葡萄糖与半乳糖、核糖、土壤含水量、土壤有机碳、4、2、1、0.5 mm和小于0.25 mm土壤团聚体呈极显著相关。半乳糖醛酸与土壤有机碳、4、2、1、0.5 mm 和小于 0.25 mm土壤团聚体呈显著性相关。核糖与岩藻糖、2 mm土壤团聚体呈显著相关,与半乳糖、葡萄糖、土壤含水量、土壤有机碳、4、2、1、0.5 mm 和小于 0.25 mm土壤团聚体呈极显著相关。岩藻糖与半乳糖、甘露糖、核糖、土壤含水量和土壤有机碳呈显著性相关。甘露糖与岩藻糖呈显著性相关。鼠李糖与0.25 mm土壤团聚体呈极显著相关。同时,各级土壤团聚体内部之间呈极显著相关,团聚体与土壤含水量、土壤有机碳也达到极显著相关水平。
2.3.2 讨论
根鞘周围环境土的4、2 mm和0.25 mm级团聚体结构影响着根鞘的相对体积;土壤中0.25 mm级土壤团聚体所占比例越多,所形成的根鞘越厚,说明土壤团聚体的构成直接影响了根鞘的形成。
土壤团聚体也受其内部结构、土壤特性和多糖组分的影响,这表明多糖影响着土壤团聚体的构成。具体分析分泌物中的各成分得出:鼠李糖和岩藻糖是根鞘内粗多糖的主要成分,其中鼠李糖和0.25 mm级团聚体构成有关;岩藻糖对土壤含水量有作用。半乳糖醛酸是根鞘形成的主要原因,它和土壤团聚体结构组成有关;半乳糖既影响含水量又影响团聚体结构组成。半乳糖、半乳糖醛酸和岩藻糖同时也影响了根鞘周围土壤有机碳的含量。葡萄糖和核糖可能来自植物根部细胞或微生物细胞内,他们对根鞘生长的环境土壤含水量、有机碳含量和土壤团聚体结构发挥作用。
分析结果表明:土壤团聚体构成是根鞘形成的直接原因;多糖物质发挥多糖的粘性胶结作用,并且通过多糖的亲水、吸水、保水的作用影响土壤团聚体的结构和比例,从而形成具有多种生态意义的根鞘。
2.4 多元回归分析
0.25 mm级土壤团聚体对根鞘的形成具有重大意义,并且由相关分析得多糖对团聚体结构会有影响。那么用多糖各组分对0.25 mm级团聚体做回归分析,即可预测出是何种多糖对0.25 mm级团聚体产生作用的。经逐步回归后得最优回归方程结果为:
0.25 mm 级团聚体=24.186-68.279×鼠李糖-8.87×
半乳糖-72.953×半乳糖醛酸
模型的 R2=0.866,拟合效果较好(P=0.001),表明此模型能较好解释形成根鞘的环境中多糖与0.25 mm级团聚体之间的关系。经t检验,常数项、鼠李糖、半乳糖和半乳糖醛酸的系数的P值依次为:0.000、0.001、0.004、0.037,因而都有显著性意义。经多元回归分析得出的模型,说明根鞘粗多糖中的鼠李糖、半乳糖和半乳糖醛酸影响了根鞘周围土壤的0.25 mm级团聚体构成,从而进一步影响着根鞘的形成。
黏液中可能存在强大的表面活性物质,使其能减少水分表面张力,它在改变衬质势和其他物理性质方面具有重要作用[23]。如果根系生产出足够多的表面活性物质,它会用来总体上降低根际的表面张力,而不是用来粘结土壤[24]。综上研究扁穗冰草根鞘形成的机理为:在干旱的土壤环境中,由于黏液的表面张力促使衬质势下降,并且由于黏液失水后提高了粘性,从而吸附更多0.25 mm级微团聚体的土壤颗粒。在昼夜温差大的情况下,土壤颗粒在黏液往复固着下越来越牢固,增加了稳定的鞘状物;根鞘内多糖中半乳糖、岩藻糖和鼠李糖等成分发挥了多糖的亲水、吸水和保水的作用,由此导致根鞘的抗旱、保湿、储水等生态功能。草原植物根部的碳水化合物是植物对应外界干扰或胁迫时的缓冲物质,在植物抗逆性和维持生态系统稳定性方面具有重要作用,它有助于维持植物的合适度[25]。根鞘是植物应对恶劣环境的形态对策,根鞘的形成机理表明,根鞘可能是衡量植物耐受性的一个指标。
3 结论
(1)葡萄糖和核糖可能来自植物根部脱落的细胞或微生物的细胞核内,他们与各级土壤团聚体构成了第一主因子的因素,反映了形成根鞘的环境中土壤的结构特性。
(2)甘露糖、岩藻糖和鼠李糖是根鞘内生物分泌出的多糖主要组分。根鞘相对体积与多糖主要成分、根鞘周围环境土的团聚体结构都具有较高的相关性,并且后两者之间也互相相关。综合研究结果将多糖各组分作为一个整体来考虑,说明多糖物质发挥粘性胶结作用,并且通过多糖的亲水、吸水、保水的特性对根鞘形成做出贡献。
(3)相关分析和回归分析结果表明,土壤团聚体的构成直接影响了根鞘的形成:根鞘生长的周围环境土的4、2 mm和0.25 mm级团聚体结构影响着根鞘的相对体积;土壤中0.25 mm级土壤团聚体所占比例越多,所形成的根鞘越厚。
(4)鼠李糖、半乳糖和半乳糖醛酸对0.25 mm级土壤团聚体的形成具有重要作用;具粘液特性的胶状物是根鞘形成的根本原因。
[1] Bailey C,Scholes M.Rhizosheath occurrence in South African grasses.South African Journal of Botany,1997,63:484-490.
[2] Volkens G.Die Flora der Aegyptisch-arabischen Wuste:auf Grundlage Anatomisch-Physiologischer Forschungen.Berlin:Gebrüder Borntraeger,1887.
[3] Wang J,Wang K.The Research on Rhizosheath in Agriculturepasturage Landscape Boundary,Northern China[D].Beijing:China Agricultural University,2009.
[4] Smitho R J,Hoppero S D,Shane M W.Sand-binding roots in Haemodoraceae:global survey and morphology in a phylogenetic context.Plant and Soil,2011,348(1/2):453-470.
[5] Shane M W,McCully M E,Canny M J,Pate JS,Huang C,Ngo H,Lambers H.Seasonal water relations of Lyginia barbata(Southern rush) in relation to root xylem development and summer dormancy of root apices.New Phytologist,2010,185(4):1025-1037.
[6] Robards A W,Clarkson D T,Sanderson J.Structure and permeability of the epidermal/hypodermal layers of the sand sedge(Carex arenaria L.).Protoplasma,1979,101(4):331-347.
[7] WattM,McCully M E,Canny M J.Formation and stabilization of rhizosheaths of Zea may L.(effect of soil-water content).Plant Physiology,1994,106(1):179-186.
[8] Iijima M,Higuchi T Barlow P W.Contribution of root cap mucilage and presence of an intact root cap in maize(Zea mays)to the reduction of soilmechanical impedance.Annals of Botany,2004,94(3):473-477.
[9] Abbott T P,Wu Y V,Carlson K D,Slodki M E,Kleiman R.Isolation and preliminary characterization of Lesquerella fendleri gums from seed, presscake, and defatted meal. Journal of Agricultural and Food Chemistry,1994,42(8):1678-1685.
[10] Liu X F,Tan D Y.Ecological significance of seed mucilage in desert plants. Chinese Bulletin of Botany,2007,24(3):414-424.
[11] Huang C Y.Agrology.Beijing:China Agriculture Press,2000.
[12] Nanjing Soil Research Institute,Chinese Academy of Sciences,Soil Physics Laboratory.Soil Physical Properties Determination Method.Beijing:Science Press,1978.
[13] Lin H D,Ka-HingWong,Jiao H,HuangW J,Xi X L,Liang G B,Huang JH.Monosaccharide composition of polysaccharides in Borojo in tropical rain forest.Modern Food Science and Technology,2010,26(11):1264-1266.
[14] Yu R M,Ma W X,Zhang H,Yao X S.Studies on the polysaccharides in the cell cultures and the leaves of Ginkgo Biloba.Chinese Journal of Biochemical Pharmaceutics,1999,20(5):217-220.
[15] Zhang K,Dai L,Deng Z R.Isolation and characterization of an acidic polysaccharide from Agrimonia pilosa Ledeb.Chinese Journal of Biochemical Pharmaceutics,2008,29(3):171-174.
[16] Hua Y F,Chen Y L,Zhang M.Comparative studies on three dendrobium medicinal plants.Journal of Zhejiang University:Engineering Science,2004,38(2):249-252.
[17] Wang Z Y,Dai L,Zhang K.Research on extraction techniques and antioxidantactivity of polysaccharides from Scutellaria Barbata D.Don.Chinese Journal of Biochemical Pharmaceutics,2008,29(2):96-103.
[18] Shang P,Yang T H,Jia M,Mei Q B,Zhao W M,Cao Z X,Zhao D H.Purification and analysisof polysaccharidesof Angelica sinensis(oliv.)diels.Journal of the Fourth Military Medical University,2001,22(14):1311-1314.
[19] Hao G T,Chen SW,Zhu S,Yin H P,Dai J,Cao Y H.Analysis ofmonosaccharides and uronic acids in polysaccharides by Pre-column derivatization with p-aminobenzoic acid and high performance liquid chromatography. Chinese Journal of Chromatography,2007,25(1):75-79.
[20] Zhu X Y,Chen Y Q.SPSS Statistics Analysis Method and Application.Beijing:Tsinghua University Press,2011.
[21] Caffall K H, Mohnen D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides.Carbohydrate Research,2009,344(14):1879-1900.
[22] Mo J H.The Effect of Pectin Content in Root Cell Wall of Arabidopsis on Its Resistant to Cadmium Stress[D].Hangzhou:College of Life Science,Zhejiang University,2010.
[23] Anderson M A,Hung A Y C,Mills D,Scott M S.Factors affecting the surface tension of soil solutions and solutions ofhumic acids.Soil Science,1995,160(2):111-116.
[24] Read D B,Gregory P J,Bell A E.Physical properties of axenic maize rootmucilage.Plant and Soil,1999,211(1):87-91.
[25] Kleijn D,Treier U A,Müller-Scharer H.The importance of nitrogen and carbohydrate storage for plant growth of the alpine herb Veratrum album. New Phytologist, 2005, 166(2):565-575.
参考文献:
[3] 王瑾,王堃.华北农牧交错带地区植物根系根鞘研究初探[D].北京:中国农业大学,2009.
[10] 刘晓风,谭敦炎.荒漠植物种子粘液的生态学意义.植物学通报,2007,24(3):414-424.
[11] 黄昌勇.土壤学.北京:中国农业出版社,2000.
[12] 中国科学院南京土壤研究所土壤物理研究室.土壤物理性质测定法.北京:科学出版社,1978.
[13] 林海丹,Wong K H,焦红,黄文健,奚星林,梁公壁,黄健豪.热带雨林博罗霍果多糖的单糖组成分析.现代食品科技,2010,26(11):1264-1266.
[14] 于荣敏,马文霞,张辉,姚新生.银杏细胞培养物多糖与银杏叶多糖的研究.中国生化药物杂志,1999,20(5):217-220.
[15] 张凯,戴玲,郑子瑞.仙鹤草多糖的分离纯化及理化性质研究.中国生化药物杂志,2008,29(3):171-174.
[16] 华允芬,陈云龙,张铭.三种药用石斛多糖成分的比较研究.浙江大学学报:工学版,2004,38(2):249-252.
[17] 王志远,戴玲,张凯.半枝莲多糖的提取纯化及抗氧化活性研究.中国生化药物杂志,2008,29(2):96-103.
[18] 商澎,杨铁虹,贾敏,梅其炳,赵文明,曹之宪,赵德化.当归多糖的分离、纯化及分析鉴定.第四军医大学学报,2001,22(14):1311-1314.
[19] 郝桂堂,陈尚卫,朱松,尹鸿萍,戴军,曹玉华.对氨基苯甲酸衍生化高效液相色谱法分析多糖中的单糖及糖醛酸组成.色谱,2007,25(1):75-79.
[20] 朱星宇,陈勇强.SPSS多元统计分析方法及应用.北京:清华大学出版社,2011.
[22] 莫基浩.拟南芥根细胞壁中的果胶含量对植物抗镉胁迫的影响[D].杭州:浙江大学,2010.
——α-葡萄糖醛酸酶的研究进展*

