大气氮沉降对森林土壤甲烷吸收和氧化亚氮排放的影响及其微生物学机制
方华军,程淑兰 ,于贵瑞,王永生,徐敏杰,党旭升,李林森,王 磊
(1.中国科学院地理科学与资源研究所/生态系统观测与模拟重点实验室,北京 100101;2.中国科学院大学,北京 100049)
大气中温室气体浓度急剧增加是全球气候变暖的主要原因[1]。甲烷(CH4)和氧化亚氮(N2O)是两种重要的温室气体,百年尺度上其单位质量的全球增温潜势(GWP)分别是CO2的25倍和298倍,对全球变暖的贡献超过25%[1]。另一方面,CH4具有较强的化学活性,能参与对流层中许多重要的大气化学过程,而N2O不仅参与大气中的光化学反应,还会间接破坏平流层中的臭氧层[2]。近10年来,大气中CH4和N2O浓度分别以每年0.9% 和0.25% 的速率持续增加,将直接和间接地对未来全球气候变化产生巨大的影响[1]。目前大气中CH4和N2O的源与汇收支并不平衡。据估计,全球大气CH4和N2O的源分别为525 Tg CH4/a和55.6 Tg N2O/a,汇分别为 560Tg CH4/a 和 39.6 Tg N2O/a[3-4]。虽然水分非饱和的自然土壤(森林、草地)CH4吸收和N2O排放只占CH4总汇的9%(36Tg CH4/a)和N2O总源的4%(20.7Tg N2O/a),却是陆地土壤CH4和N2O源汇估算中最大不确定性之处[5-6]。
此外,全球碳循环研究中一个关键的科学问题是已知的碳汇与碳源不平衡,数量上存在2—4 Pg C/a的“漏失汇(missing sink)”,主要分布在中高纬度森林地区[7]。自工业革命以来,大气中活性氮(Reactive N)增加了11.5倍,导致全球大气氮沉降量增加了2.5倍[8-9]。长期缓慢的氮沉降输入显著增加受氮限制的陆地生态系统的碳储量,是正确解释“漏失汇”的重要途径之一[10-11]。目前对碳、氮循环的相互作用机理还缺乏深入的认识,有关氮沉降驱动的陆地生态系统固碳率还存在很大分歧[12-13]。例如,Magnani等[10]报道氮沉降导致温带和北方森林生态系统固碳率高达726 kg C/kg N,平均为400 kg C/kg N;而De Vries等[12]从树种个体尺度和林分尺度分析了400个欧洲森林样地,发现每沉降1 kg N 可增加碳固定 30—70 kg C,与 Högberg[14]的研究结果基本一致(40kg C/kg N),因此 Magnani等[10]人可能高估了大气氮沉降的增汇效应。虽然大气氮沉降增加能够提高陆地生态系统的生产力,但是会显著抑制土壤 CH4吸收和促进 N2O 排放[15-16],反过来又增加了温室气体总的GWP[17]。如果综合考虑氮沉降对土壤CH4和N2O通量的影响,由氮沉降产生的固碳潜力将被抵消53%—76%[17]。由此可见,深入理解水分非饱和土壤CH4吸收和N2O排放过程及其对氮沉降增加的响应特征,是准确量化陆地生态系统固碳潜力的前提和基础。
森林是陆地生态系统的主体,在全球碳循环尤其在固定大气 CO2方面具有举足轻重的作用[18]。据估计,全球森林面积约41亿hm2,包括北方森林、温带森林和热带森林3个森林群区(Biome),面积分别为13.72亿 hm2,10.38亿 hm2和17.55亿hm2[18];植被和土壤碳储量为1240 Pg C,其中2/3 储存在土壤中[19]。其中北方森林土壤有机碳(SOC)密度平均为296 Mg C/hm2,显著高于温带和热带森林群区(122 Mg C/hm2)[18]。此外,森林土壤 CH4吸收和N2O排放速率显著高于草地土壤,分别是大气CH4和N2O重要的汇与源。热带森林群区土壤每年排放N2O 1.34Tg N/a,吸收 CH46.2Tg C/a,成为继农田之后最大的 N2O 排放源[20]。Cai[21]研究也发现,中国区域森林平均每年吸收CH4的数量为4.94 kg C hm-2a-1,排放 N2O 的量为 2.41 kg N hm-2a-1,均显著高于草原。此外,低温导致北方森林土壤氮素周转较慢,土壤有效氮素处于匮乏状态;而热带和亚热带森林土壤风化作用较强,土壤氮素周转快,土壤有效氮素呈富集状态[22]。土壤碳储量和有效氮数量的显著差异导致贫氮的北方森林和富氮的热带亚热带森林土壤碳氮气体交换通量对外源性氮素输入的响应截然不同[23]。
近年来,有关森林土壤CH4吸收和N2O排放及其对增氮的响应开展了大量的研究,但仍然存在许多问题尚未解决。本文分别综述了森林土壤CH4吸收和N2O排放通量之间的耦合作用,森林土壤CH4和N2O的产生与消耗过程、关键驱动因子以及对增氮响应的生物化学和微生物学机制,分析各个研究领域中存在的问题和薄弱环节,提出未来的可能研究方向和拟解决的途径,以期对该领域的研究起到推波助澜的作用。
1 森林土壤CH4吸收和N2O排放之间的耦合作用
水分非饱和的森林土壤通常是大气CH4的吸收汇和N2O的排放源。在好氧条件下,自养氨氧化菌将NH+4-N 氧化为 NO-2-N,异构亚硝酸盐还原酶利用NO-2作为电子受体产生N2O[24];异养硝化细菌通过羟胺氧化酶(HAO)的催化作用,将氨氧化过程的中间产物羟胺转化为亚硝酸盐和N2O[24]。与此同时,在好氧条件下,甲烷氧化菌利用土壤中的O2将土壤中产生的CH4和从大气中扩散进入土壤的CH4氧化成CO2,然后释放到大气中[25]。虽然甲烷氧化菌和氨氧化菌都能氧化CH4和NH3,但两者的专一性和氧化能力不同。在大气CH4浓度下,甲烷单氧酶(MMO)倾向于选择CH4而非NH3,土壤剖面中高浓度的CH4也可以显著抑制土壤氨的氧化[26]。相反,在土壤无机氮含量增加的情景下,土壤中高浓度的NH3可以把CH4从结合点上驱赶下来,降低CH4的氧化量;由于甲烷氧化菌只能以CH4为唯一的碳源和能源,从而降低甚至抑制甲烷氧化菌的生长[25]。可见,土壤-大气界面CH4和N2O净交换通量是土壤甲烷氧化菌和N2O产生菌耦合作用的结果,两者之间存在协同[27]、消长[28]和随机[29]的关系(图 1),很大程度上取决于环境条件、土壤类型和氮素有效性[30]。Steudler等[31]最早报道水分非饱和土壤 CH4吸收和N2O排放之间呈消长关系,发现森林砍伐后增加了土壤氮素的可利用性,导致土壤N2O排放增加了2倍,但却显著抑制了土壤CH4的吸收。类似的消长关系也常见于其它森林和草地生态系统[32-34]。Maljanen 等[27]研究发现,大气氮沉降增加不但促进了北方云杉林土壤N2O排放,而且也显著促进了土壤CH4的氧化和吸收,两者之间呈明显的协同关系。而Carter等[35]研究表明,多因子(温度升高、夏季干旱延长和CO2浓度富集)联合作用倾向于促进欧石南荒原土壤CH4的吸收,但对土壤N2O排放无显著影响,两者之间表现为随机关系。虽然我们对水分非饱和的森林土壤CH4吸收和N2O排放过程的耦合现象有了一定的了解,但是有关土壤CH4吸收和N2O排放的耦合作用在时间和空间上的变化特征及其主控因子尚不明确。
2 森林土壤CH4和N2 O通量对大气氮沉降增加的响应
2.1 森林土壤CH4吸收和N2 O排放对增氮的响应特征
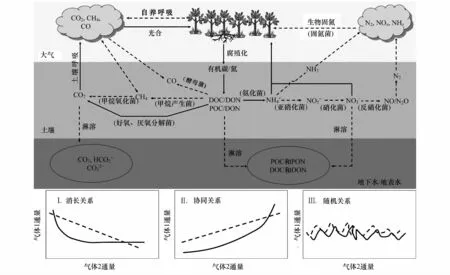
图1 森林土壤碳氮气体通量产生与消耗过程及其主要耦合关系类型Fig.1 The generation and consum ption of CO2,CH4 and N2O in forest soils aswell as the coup ling between three fluxes
施氮对水分非饱和的森林土壤CH4吸收和N2O排放的影响存在促进、抑制和无显著影响等3种结论,同步观测数据表明施氮倾向于抑制土壤CH4吸收而促进N2O排放[17]。就森林生态系统而言,施氮倾向于促进土壤N2O排放,抑制或不影响土壤CH4吸收。Macdonald等[36]发现大气氮沉降输入降低云杉林土壤CH4氧化速率,土壤N2O高排放通量与高氮沉降相对应;土壤N2O通量、土壤温度、土壤NH+4-N含量与土壤CH4吸收通量显著相关。Butterbach-Bahl等[32]研究表明高氮沉降促进欧洲赤松林土壤N2O排放,而低、中剂量氮沉降的影响不显著;中氮处理的CH4吸收是高氮处理的2—5倍。Jassal等[34]研究表明冬季施氮显著降低花旗松林土壤CH4吸收,土壤N2O由弱吸收转变为显著排放,施氮对CH4吸收的抑制作用要低于对N2O排放的促进作用。Kim 等[28]研究发现施氮(50 kg N hm-2a-1)迅速增加日本北部落叶松人工林土壤NH+4和NO-3浓度,土壤CH4吸收下降48%,而土壤N2O排放增加69%;土壤CH4吸收通量和NH+4浓度负相关,而土壤N2O通量与土壤NO-3浓度正相关,据此认为氮沉降引起土壤无机氮含量的增加,进而影响寒温带森林土壤CH4吸收和N2O排放过程。类似的施氮效应在草地生态系统也十分常见。例如,Mosier等[37]研究发现美国科罗拉多短草草原土壤CH4吸收峰与土壤N2O排放谷相对应,施氮早期抑制CH4吸收而促进N2O排放,而长期施氮对CH4无显著影响但急剧增加土壤N2O排放。Rees等[33]研究表明短期内施加NH4NO3能够促进欧洲草地土壤N2O排放和抑制土壤CH4吸收。也有研究表明施氮显著促进草地土壤N2O排放,但对土壤 CH4吸收无显著影响,土壤N2O和CH4通量之间的关系表现为随机性和对增氮响应的非同步性[38-39]。综上所述,水分非饱和土壤CH4和N2O净交换通量对施氮剂量和持续时间的响应并非一成不变。目前,我们并不清楚施氮如何影响土壤N2O和CH4的产生与消耗过程及其关键环节,以及氮素有效性增加如何调控土壤CH4和N2O通量之间的耦合关系,因此有必要开展多形态、低剂量的增氮控制实验来探讨土壤CH4吸收和N2O排放对大气氮沉降增加的响应特征。
2.2 森林土壤CH4吸收和N2O排放对增氮的响应机制
施氮对森林土壤CH4吸收的影响机制可以概括为4个方面:①竞争甲烷单氧酶(MMO);②渗透压引起的微生物生理性缺水;③代谢产物的毒害作用和④氮周转产生的抑制作用。土壤甲烷氧化菌和氨氧化菌都具有单氧酶,氨氧化菌的单氧酶(AMO)和甲烷氧化菌的颗粒状单氧酶(pMMO)具有较高的相似性[40]。施氮直接增加土壤 NH+4或 NO-3的含量,土壤CH4吸收速率通常与土壤 NH+4浓度负相关[22,41]。NH+4对土壤CH4氧化的抑制作用可归因于甲烷单氧酶对底物NH3和CH4的竞争,但该理论一直备受质疑[42-44]。NO-除了能够直接抑制甲烷氧
3化菌活性外,与NO-3结合的阳离子对甲烷氧化菌活性的抑制作用更强[45]。最近,Bodelier[46]总结性地认为,土壤NH+4-N 和 NO-3-N累积也可增加土壤CH4吸收,这与土壤氨氧化细菌增加有关,其内在的机理尚不清楚。许多研究表明施氮过程中附加的盐离子( 如 Cl-,SO24-,K+等)强烈抑制草地和森林土壤CH4吸收,归因于盐离子增加了土壤水的渗透压,造成甲烷氧化菌生理性缺水,从而降低其活性[5,45]。施氮产生的毒性效应包括土壤酸化[47-48]、Al3+浓度增加[49-50]、氮矿化的中间产物羟胺和 NO-2累积[51]以及乙烯、单萜类物质的生成[2,52]等。另外,土壤氮周转是氮素能够长期抑制CH4吸收的关键,土壤CH4氧化速率通常与硝化速率以及N2O排放通量负相关[25,53]。施氮倾向于促进土壤N2O排放,但是支配其产生的过程并不确定,取决于土壤水分、温度和无机氮含量。在中度湿润、温暖和NH+4富集的土壤中,硝化作用是N2O排放的主要过程[54]。相反,在水分饱和、寒冷和NO-3富集的土壤条件下,反硝化是N2O主要的产生过程[55]。然而,过去有关土壤CH4吸收和N2O排放对增氮的响应研究多是独立进行的,没有同步分析增氮对土壤CH4氧化、硝化和反硝化过程的影响,难以准确地揭示水分非饱和土壤CH4吸收和N2O排放之间的耦合作用及其对增氮的响应特征,稳定性碳氮同位素示踪技术可为解决该问题提供新的契机。
从微生物学角度来看,水分非饱和土壤CH4吸收和N2O排放的耦合作用及其对增氮的响应在一定程度上与甲烷氧化菌群落和N2O产生菌群落的活性和结构变化有关。甲烷氧化菌可分为低亲和力的Ⅰ型甲烷氧化菌(MOBⅠ)和高亲和力的Ⅱ型甲烷氧化菌(MOBⅡ),施氮倾向于抑制MOBⅡ的活性,但对MOBⅠ的活性无影响甚至表现为促进作用[56-57]。Menyailo等[58]发现由于不同类型甲烷单氧酶对NH3的亲和力不同,抵制毒性物质的能力也不同,导致了土壤 CH4氧化对增氮响应的多样性和复杂性。Nyerges和Stein[51]研究也发现,不同甲烷氧化菌群落对施氮的耐受力不同,森林土壤中MOBⅠ和MOBⅡ的相对丰富度可以用来指示微生物对NH+4和NO-2毒性效应的耐受力。最近,Maxfield等[59]利用13CH4-PLFA-SIP技术研究草地和农田土壤CH4吸收机制,发现施加有机肥导致土壤甲烷氧化菌群落向Ⅰ型甲烷氧化菌转变,高剂量施氮反而增加土壤甲烷氧化菌生物量,说明非甲烷氧化菌(如硝化细菌)对其具有潜在的调节作用。水分非饱和土壤中氨氧化细菌(AOB)主要包括亚硝化单胞菌属(Nitrosomonas)、亚硝化球菌属(Nitrosococcus)和亚硝化螺菌属(Nitrosopira)等,进一步可分成9个不同的进化簇[60]。通过对β变形菌纲氨氧化菌16S rRNA和氨单加氧酶(amoA)基因的克隆、测序和变形梯度凝胶电泳(DGGE)分析,Schmidt等[24]对比研究氮沉降对苏格兰氮限制和氮饱和两种森林土壤氨氧化菌群落的影响时发现,氮沉降没有显著改变氮限制云杉林土壤氨氧化菌群落丰富度,包括亚硝化单胞菌和亚硝化螺菌属;而氮饱和的云杉林土壤以非氨氧化菌群落为主,没有检测到amoA基因序列;这些结果表明即使在高氮沉降区氨氧化菌对土壤N2O产生的贡献较小。Kandeler等[61]研究发现移除氮沉降不影响土壤总细菌、硝酸还原菌和反硝化细菌群落活性,N2O还原酶(nosZ)/16S rRNA基因和nosZ/nirK的比率随着土壤深度增加,表明矿质土壤中反硝化细菌的比例高于有机层。除了硝化细菌外,甲基营养菌对好氧环境下土壤硝化来源N2O的贡献也比较显著。Acton和Baggs[30]发现施氮抑制了土壤 CH4氧化,促进了N2O排放,主要是甲基营养菌转变其功能来氧化NH3所致。由于甲烷氧化菌和氨氧化菌在生理学和生物化学方面十分相似,任何抑制CH4氧化的过程均能促进NH3的氧化,施氮潜在地改变了甲基营养菌氧化大气CH4的功能。综上所述,提出以下两点假设:(1)低剂量施氮或施氮初期,大部分外源性氮素被植物吸收和被土壤微生物固持,施氮可能不改变甚至促进土壤甲烷氧化菌和N2O产生菌群落活性,不改变或轻微促进贫氮森林土壤CH4吸收和N2O排放。(2)高氮输入或长期施氮可能会显著抑制富氮森林土壤高亲和力的Ⅱ型甲烷氧化菌群落活性,提高一些N2O产生菌群落(尤其是甲基型营养菌和反硝化细菌)活性,进而抑制CH4吸收和促进N2O排放。然而,有关水分非饱和土壤甲烷氧化菌和氨氧化菌的竞争程度及其重要性知之甚少,甲基营养菌在土壤氨氧化或N2O产生过程中的作用尚不确定,分子生物学技术可以准确评价施氮对甲烷氧化菌和氨氧化菌群落活性和多样性的影响。
3 现有研究不足与未来研究展望
目前,围绕森林土壤CH4吸收和N2O排放对大气氮沉降的响应这一前沿科学命题已做了大量的研究,但仍然存在很多研究不足和不确定性。例如,有关氮素对森林土壤CH4吸收的调控机制假说众说纷纭,并且许多假说无法合理地解释森林生态系统施氮初期和后期土壤CH4吸收的转变,在解释氮限制和磷限制森林土壤CH4吸收格局时也常常自相矛盾[62]。关于水分非饱和森林土壤N2O排放,存在以硝化作用和反硝化过程贡献为主两种结论,相应地增氮对硝化和反硝化过程的促进作用及其对N2O排放的相对贡献难以准确量化[55]。主要原因包括:(1)现有的增氮控制试验网络多集中在大气氮沉降较高的温带森林生态系统,没有区分氮素形态(氧化态NO-3、还原态 NH+4和有机态DON)影响的差异,难以解释北方森林、温带森林、热带/亚热带森林土壤碳氮通量对增氮的响应机理[63]。(2)森林土壤CO2,CH4和N2O通量来源的研究多为独立进行的,忽视了不同通量组分对增氮响应的差异,无法阐明土壤CO2,CH4和N2O通量之间的耦合关系及其对增氮的响应机制[4]。(3)虽然微生物分子生态学方法日新月异,但是每种方法均存在一定的局限性,相关研究基本上停留在某类微生物功能群活性和群落组成的评价上,依然未能将微生物功能群落动态与土壤碳氮通量真正地联系起来[64]。在未来几年内,关于土壤CH4和N2O通量耦合作用及其对增氮的响应研究应该在以下3个方面亟待加强:(1)流域尺度森林土壤碳氮通量、氮流失与生态系统生产力之间的耦合关系。在小流域尺度上,通过高频率测定土壤-大气界面碳氮气体净交换通量,同步测定土壤、渗漏液和地表径流中有效碳氮含量和生态系统生产力,重点研究流域尺度森林土壤气体通量时空分异特征、氮迁移对气体交换的影响及其自然因素的驱动机制。(2)生态系统尺度土壤 CH4氧化和N2O产生的交互作用及其氮素调控作用。基于多形态、多水平的氮沉降模拟控制试验,集合野外监测和13C和15N双同位素示踪技术,测定不同处理下森林土壤CH4氧化和N2O产生速率,区分土壤N2O的主要来源,探讨CH4氧化过程和N2O产生过程之间的交互作用。(3)分子尺度上探讨施氮对土壤甲烷氧化菌、氨氧化菌活性和群落组成的影响。采用常规培养法测定不同施氮处理土壤甲烷氧化菌和氨氧化菌数量,利用基于PCR的分子生态学方法(如TRFLP、基因芯片、克隆测序等),对比分析不同处理表层和亚表层土壤甲烷氧化菌和氨氧化菌群落物种丰富度和多样性指数的差异,阐明典型森林土壤甲烷氧化菌和氨氧化菌群落活性和群落组成对增氮的响应。期望通过该项研究,能够比较全面地理解典型森林土壤CH4吸收和N2O排放的耦合作用及其氮素调控机制。
4 结论
森林土壤CH4吸收和N2O排放对大气氮沉降的响应十分复杂,包括促进、抑制和不变3种截然不同的结论;低氮倾向于促进贫氮森林土壤CH4吸收,不改变土壤N2O排放,而高氮显著抑制富氮森林土壤CH4吸收以及促进N2O排放。相应地,森林土壤CH4吸收和N2O排放通量之间也存在协同、消长和随机等多种复杂的耦合形式。有关氮素对森林土壤CH4吸收的调控作用机制相对清晰,主要包括竞争抑制和毒性抑制两个方面。但是,关于增氮对土壤N2O排放的促进作用却存在硝化作用和反硝化贡献之争,促进机理至今不明晰,归因于土壤N2O产生和消耗过程的复杂性。在微生物学机理探讨方面,结合生物化学和微生物分子生态学诸多手段,近年来我们大量探讨了甲烷氧化菌、氨氧化菌和反硝化细菌等功能群落在土壤CH4氧化和N2O排放过程中作用,但是依然未能将微生物功能群落演变与土壤碳氮通量动态真正地联系起来。而且,过去关于森林土壤CH4吸收和N2O排放过程对增氮响应多为独立进行的,对其不同耦合关系背后的微生物学机制研究尚未系统地开展。
[1] IPCC. Climate Change 2007: Impacts, Adaptation and Vulnerability//Parry M L,CanzianiO F,Palutikof JP,van der Linden P J,Hanson C E.Contribution of Working GroupⅡ to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge:Cambridge University Press,2007.
[2] Degelmann D M,Borken W,Kolb S.Methane oxidation kinetics differ in European beech and Norway spruce soils.European Journal of Soil Science,2009,60(4):499-506.
[3] Dutaur L,Verchot L V.A global inventory of the soil CH4sink.Global Biogeochemical Cycles, 2007, 21(4), doi: 10.1029/2006GB002734.
[4] Cai Z C,Xu H,Ma J.Methane and Nitrous Oxide from Rice-Based Ecosystems.Hefei:University of Science and Technology of China Press,2009:1-375.
[5] Borken W,Brumme R.Methane uptake by temperate forest soils//Functioning and Management of European Beech Ecosystems.Ecological Studies.Berlin Heidelberg:Springer,2009,208:369-385.
[6] Wolf K,Veldkamp E,Homeier J,Martinson G O.Nitrogen availability links forest productivity,soil nitrous oxide and nitric oxide fluxes of a tropical montane forest in southern Ecuador.Global Biogeochemical Cycles, 2011, 25(4), doi:10.1029/2010GB003876.
[7] Myneni R B,Dong J,Tucker C J,Kaufmann R K,Kauppi P E,Liski J,Zhou L,Alexeyev V,Hughes M K.A large carbon sink in the woody biomass of northern forests.Proceedings of the National Academy of Sciences of the United States of America,2001,98(26):14784-14789.
[8] Lamarque J F,Kiehl J T,Brasseur G P,Butler T,Cameron-Smith P,CollinsW D,CollinsW J,Granier C,Hauglustaine D,Hess P G,Holland E A,Horowitz L,Lawrence M G,McKenna D,Merilees P,Prather M J,Rasch P J,Rotman D,Shindell D,Thornton P.Assessing future nitrogen deposition and carbon cycle feedback using a multimodel approach:Analysis of nitrogen deposition.Journal of Geophysical Research: Atmospheres,2005,110(D19):doi:10.1029/2005JD005825.
[9] Galloway JN,Townsend A R,Erisman JW,Bekunda M,Cai Z C,Freney J R,Martinelli L A,Seitzinger S P,Sutton M A.Transformation of the nitrogen cycle:recent trends,questions,and potential solutions.Science,2008,320(5878):889-892.
[10] Magnani F,MencucciniM,BorghettiM,Berbigier P,Berninger F,Delzon S,Grelle A,Hari P,Jarvis P G,Kolari P,Kowalski A S,Lankreijer H,Law B E,Lindroth A,Loustau D,Manca G,Moncrieff JB,Rayment M,Tedeschi V,Valentini R,Grace J.The human footprint in the carbon cycle of temperate and boreal forests.Nature,2007,447(7146):848-851.
[11] Luyssaert S,Schulze E D,Börner A,Knohl A,Hessenmöller D,Law B E,Ciais P,Grace J.Old-growth forests as global carbon sinks.Nature,2008,455(7210):213-215.
[12] de Vries W,Solberg S,Dobbertin M,Sterba H,Laubhahn D,Reinds G J, Nabuurs G J, Gundersen P, Sutton M A.Ecologically implausible carbon response?Nature,2008,451(7180):E1-E3.
[13] de Vries W,Solberg S,Dobbertin M,Sterba H,Laubhann D,van Oijen M,Evans C,Gundersen P,Kros J,Wamelink G W W,ReindsG J,Sutton M A.The impactof nitrogen deposition on carbon sequestration by European forests and heathlands.Forest Ecology and Management,2009,258(8):1814-1823.
[14] Högberg P.Environmental science:Nitrogen impacts on forest carbon.Nature,2007,447(7146):781-782.
[15] Aronson E L,Helliker B R.Methane flux in non-wetland soils in response to nitrogen addition:ameta-analysis.Ecology,2010,91(11):3242-3251.
[16] Lu M,Yang Y H,Luo Y Q,Fang CM,Zhou X H,Chen JK,Yang X,Li B.Responses of ecosystem nitrogen cycle to nitrogen addition:a meta-analysis.New Phytologist,2011,189(4):1040-1050.
[17] Liu L L,Greaver T L.A review of nitrogen enrichment effects on three biogenic GHGs:the CO2sink may be largely offset by stimulated N2O and CH4emission.Ecology Letters,2009,12(10):1103-1117.
[18] Lal R.Forest soils and carbon sequestration.Forest Ecology and Management,2005,220(1/3):242-258.
[19] Dixon R K,Solomon A M,Brown S,Houghton R A,Trexier M C,Wisniewski J. Carbon pools and flux of global forest ecosystems.Science,1994,263(5144):185-190.
[20] Davidson E A,Nepstad D C,Ishida F Y,Brando PM.Effects of an experimental drought and recovery on soil emissions of carbon dioxide,methane,nitrous oxide,and nitric oxide in a moist tropical forest. Global Change Biology, 2008, 14(11):2582-2590.
[21] Cai Z C.Greenhouse gas budget for terrestrial ecosystems in China.Science China Earth Sciences,2012,55(2):173-182.
[22] Fang H J,Yu G R,Cheng SL,Zhu T H,Wang Y S,Yan JH,Wang M,Cao M,Zhou M.Effects of multiple environmental factors on CO2emission and CH4uptake from old-growth forest soils.Biogeosciences,2010,7(1):395-407.
[23] Powers JS,Schlesinger W H.Relationships among soil carbon distributions and biophysical factors atnested spatial scales in rain forests of northeastern Costa Rica.Geoderma,2002,109(3/4):165-190.
[24] Schmidt C S,Hultman K A,Robinson D,Killham K,Prosser J I.PCR profiling of ammonia-oxidizer communities in acidic soils subjected to nitrogen and sulphur deposition.FEMSMicrobiology Ecology,2007,61(2):305-316.
[26] Schnell S, King G M.Mechanistic analysis of ammonium inhibition of atmospheric methane consumption in forest soils.Applied and Environmental Microbiology, 1994, 60(10):3514-3521.
[27] Maljanen M,Jokinen H,Saari A,Strömmer R,Martikainen P J.Methane and nitrous oxide fluxes,and carbon dioxide production in boreal forest soil fertilized with wood ash and nitrogen.Soil Use and Management,2006,22(2):151-157.
[28] Kim Y S,ImoriM,Watanabe M,Hatano R,Yi M J,Koike T.Simulated nitrogen inputs influence methane and nitrous oxide fluxes from a young larch plantation in northern Japan.Atmospheric Environment,2012,46:36-44.
[29] Lam SK,Lin E,Norton R,Chen D L.The effect of increased atmospheric carbon dioxide concentration on emissions of nitrous oxide,carbon dioxide and methane from a wheat field in a semiarid environment in northern China.Soil Biology& Biochemistry,2011,43(2):458-461.
[30] Acton SD,Baggs E M.Interactions between N application rate,CH4oxidation and N2O production in soil.Biogeochemistry,2011,103(1/3):15-26.
[31] Steudler P A,Melillo JM,Bowden R D,Castro M S,Lugo A E.The effects of natural and human disturbances on soil nitrogen dynamics and trace gas fluxes in a Puerto Rican wet forest.Biotropica,1991,23(4):356-363.
[32] Butterbach-Bahl K,Breuer L,Gasche R,Willibald G,Papen H.Exchange of trace gases between soils and the atmosphere in Scots pine forest ecosystems of the northeastern German lowlands:1.Fluxes of N2O,NO/NO2and CH4at forest siteswith different N-deposition.Forest Ecology and Management,2002,167(1/3):123-134.
[33] Rees R,Jones S,Thorman R E,McTaggart,Ball B,Skiba U.The effect of organic and mineral nitrogen fertilisers on emissions of NO,N2O and CH4from cutgrassland//Hatch D J,Chadwick D R,Jarvis S C,Roker J A.Controlling Nitrogen Flows and Losses.UK:University of Exeter,2004:268-276.
[34] Jassal R S,Black T A,Roy R,Ethier G.Effect of nitrogen fertilization on soil CH4and N2O fluxes,and soil and bole respiration.Geoderma,2011,162(1/2):182-186.
[35] Carter M S,Ambus P,Albert K R,Larsen K S,Andersson M,PrieméA,van der Linden L,Beier C.Effects of elevated atmospheric CO2,prolonged summer drought and temperature increase on N2O and CH4fluxes in a temperate heathland.Soil Biology and Biochemistry,2011,43(8):1660-1670.
[36] Macdonald JA,Skiba U,Sheppard L J,Ball B,Roberts JD,Smith K A,Fowler D.The effect of nitrogen deposition and seasonal variability on methane oxidation and nitrous oxide emission rates in an upland spruce plantation and moorland.Atmospheric Environment,1997,31(22):3693-3706.
[37] Mosier A R,Parton W J,Valentine DW,Ojima D S,Schimel D S,Delgado JA.CH4and N2O fluxes in the Colorado shortgrass steppe:1.Impact of landscape and nitrogen addition.Global Biogeochemical Cycles,1996,10(3):387-399.
[38] Mori A,Hojito M,Kondo H,Matsunami H,Scholefield D.Effects of plant species on CH4and N2O fluxes from a volcanic grassland soil in Nasu,Japan.Soil Science and Plant Nutrition,2005,51(1):19-27.
[39] Ambus P,Robertson G P.The effectof increased n deposition on nitrous oxide,methane and carbon dioxide fluxes from unmanaged forest and grassland communities in Michigan.Biogeochemistry,2006,79(3):315-337.
[40] Ding W X,Cai ZC.Mechanismsof nitrogen fertilizer suppressing atmospheric methane oxidation by methanotrophs in soils.Rural Eco-Environment,2001,17(3):30-34.
[41] Jang I,Lee S,Hong JH,Kang H J.Methane oxidation rates in forest soils and their controlling variables:a review and a case study in Korea.Ecological Research,2006,21(6):849-854.
[42] Saari A,Rinnan R,Martikainen P J.Methane oxidation in boreal forest soils:kinetics and sensitivity to pH and ammonium.Soil Biology and Biochemistry,2004,36(7):1037-1046.
[43] Chan A SK,Steudler P A.Carbon monoxide uptake kinetics in unamended and long-term nitrogen-amended temperate forest soils.FEMSMicrobiology Ecology,2006,57(3):343-354.
[44] Tate K R,Ross D J,Saggar S,Hedley C B,Dando J,Singh B K,Lambie S M.Methane uptake in soils from Pinus radiata plantations,a reverting shrubland and adjacent pastures:Effects of land-use change,and soil texture,water and mineral nitrogen.Soil Biology and Biochemistry,2007,39(7):1437-1449.
[45] Whalen SC,Reeburgh W S.Methane oxidation,production,and emission at contrasting sites in a boreal bog.Geomicrobiology Journal,2000,17(3):237-251.
[46] Bodelier P L E.Interactions between nitrogenous fertilizers and methane cycling in wetland and upland soils.Current Opinion in Environmental Sustainability,2011,3(5):379-388.
[47] Le Mer J, Roger P.Production, oxidation, emission and consumption ofmethane by soils:A review.European Journal of Soil Biology,2001,37(1):25-50.
[48] Xu X, Inubushi K.Responses of ethylene and methane consumption to temperature and pH in temperate volcanic forest soils.European Journal of Soil Science,2009,60(4):489-498.
[49] Nanba K, King G M.Response of atmospheric methane consumption by Maine forest soils to exogenous aluminum salts.Applied and Environmental Microbiology, 2000, 66(9):3674-3679.
[50] Tamai N,Takenaka C,Ishizuka S.Water-soluble Al inhibits methane oxidation at atmospheric concentration levels in Japanese forest soil.Soil Biology and Biochemistry,2007,39(7):1730-1736.
[51] Nyerges G,Stein L Y.Ammonia cometabolism and product inhibition vary considerably among species of methanotrophic bacteria.FEMSMicrobiology Letters,2009,297(1):131-136.
[52] Xu X,Inubushi K.Production and consumption of ethylene in temperate volcanic forest surface soils.European Journal of Soil Science,2007,58(3):668-679.
[53] Mosier A R.Exchange of gaseous nitrogen compounds between agricultural systems and the atmosphere.Plant and Soil,2001,228(1):17-27.
[54] Morishita T,Aizawa S,Yoshinaga S,Kaneko S.Seasonal change in N2O flux from forest soils in a forest catchment in Japan.Journal of Forest Research,2011,16(5):386-393.
[55] Zhang W,Mo JM,Zhou G Y,Gundersen P,Fang Y T,Lu X K,Zhang T,Dong S F.Methane uptake responses to nitrogen deposition in three tropical forests in southern China.Journal of Geophysical Research: Atmospheres, 2008, 113(D11):D11116,doi:10.1029/2007JD009195.
[56] Bodelier P L E,Laanbroek H J.Nitrogen as a regulatory factor of methane oxidation in soils and sediments.FEMS Microbiology Ecology,2004,47(3):265-277.
[57] Shrestha M,Shrestha P M,Frenzel P,Conrad R.Effect of nitrogen fertilization on methane oxidation, abundance,community structure,and gene expression ofmethanotrophs in the rice rhizosphere.The ISME Journal,2010,4(12):1545-1556.
[58] Menyailo O V,Hungate B A,Abraham W R,Conrad R.Changing land use reduces soil CH4uptake by altering biomass and activity but not composition of high-affinity methanotrophs.Global Change Biology,2008,14(10):2405-2419.
[59] Maxfield P J,Brennand E L,Powlson D S,Evershed R P.Impact of land management practices on high-affinity methanotrophic bacterial populations:evidence from long-term sites at Rothamsted.European Journal of Soil Science,2011,62(1):56-68.
[60] Lin X G.Principles and Methods of Soil Microbiology Research.Beijing:Higher Education Press,2010:1-430.
[61] Kandeler E,Brune T,Enowashu E,Dörr N,Guggenberger G,Lamersdorf N, Philippot L. Response of total and nitratedissimilating bacteria to reduced N deposition in a spruce forest soil profile. FEMS Microbiology Ecology, 2009, 67(3):444-454.
[62] Cheng SL,Fang H J,Yu G R,Xu M J,Zhang P L,Zheng JJ,GaoW L,Wang Y S.The primary factors controlling methane uptake from forest soils and their responses to increased atmospheric nitrogen deposition:a review.Acta Ecologica Sinica,2012,32(15):4914-4923.
[63] Fang H J,Cheng SL,Yu GR,Cooch J,Wang Y S,Xu M J,Li L S, Dang X S, Li Y N.Low-level nitrogen deposition significantly inhibitsmethane uptake from an alpine meadow soil on the Qinghai-Tibetan Plateau. Geoderma, 2014, 213:444-452.
[64] He J Z,Hu H W,Zhang L M.Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils.Soil Biology and Biochemistry,2012,55:146-154.
参考文献:
[4] 蔡祖聪,徐华,马静.稻田生态系统CH4和N2O排放.合肥:中国科学技术大学出版社,2009:1-375.
[40] 丁维新,蔡祖聪.氮肥对土壤氧化大气甲烷影响的机制.农村生态环境,2001,17(3):30-34.
[60] 林先贵.土壤微生物研究原理与方法.北京:高等教育出版社,2010:1-430.
[62] 程淑兰,方华军,于贵瑞,徐敏杰,张裴雷,郑娇娇,高文龙,王永生.森林土壤甲烷吸收的主控因子及其对增氮的响应研究进展.生态学报,2012,32(15):4914-4923.

