饲粮结构性碳水化合物与非结构性碳水化合物比例对肉兔生长性能和肠黏膜免疫的影响
陈 杰 周勤飞 周述俊 张 敬 王永才*
(1.西南大学荣昌校区动物科学系,荣昌 402460;2.重庆梁平县畜牧技术推广站,重庆 405200)
碳水化合物分为结构性碳水化合物(SC)和非结构性碳水化合物(NSC)。以纤维素、半纤维素、木质素及不溶性果胶等纤维为主的SC对肉兔具有特殊的营养生理功能,在维持肠道菌群[1-2]、促进养分的消化吸收[3]、增强免疫[4]等方面具有重要作用;而以淀粉、可溶性糖和果胶为主的NSC易于消化吸收,是肉兔能量的主要来源,若其水平过高,前肠不能完全消化吸收而大量到达盲肠后,易被大肠杆菌、魏氏梭菌等致病微生物利用产生毒素,导致腹泻等疾病。不同SC/NSC对牛羊的能量供应和瘤胃发酵报道较多[5-7],国内外研究表明,饲粮中以纤维为主的SC和以淀粉为主的NSC比例不同,会显著影响肉兔的消化率和生长性能[3,8]。然而目前对具有小型瘤胃(即盲肠)的肉兔免疫性能的影响尚未见报道,鉴于SC对肉兔肠道免疫的重要性,本试验拟给肉兔饲喂不同SC/NSC饲粮,通过对其生长性能、健康状况和肠黏膜免疫的研究,确定适宜的饲粮SC/NSC,为肉兔饲粮中适宜的碳水化合物比例提供科学依据。
1 材料与方法
1.1 试验设计
选择180只体重(760±20)g的25日龄健康新西兰肉兔,随机分为5组,每组36个重复,每个重复 1只。各组分别饲喂 SC/NSC为 22∶38、25∶35、28∶32、31∶29、34∶26 的试验饲粮。
1.2 试验饲粮
参照NRC(1977)肉兔饲养标准配制试验饲粮,试验饲粮组成及营养水平见表1。

表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.3 饲养管理
仔兔25~31日龄为预试期,32日龄开始正式饲养试验,至60日龄结束,试验期29 d。每组试验兔单笼饲养,全程自由采食和饮水,饲养管理及免疫程序按兔场日常操作程序进行。
1.4 测定指标与方法
1.4.1 生长性能指标
正试期始末晨饲前称重,记录为试验始重和末重,正试期内每天记录试验兔的采食量,采食量之和即总采食量。
平均日增重(ADG,g/d)=(末重-始重)/天数;
平均日采食量(ADFI,g/d)=总采食量/天数;
料重比(F/G)=ADFI/ADG。
1.4.2 健康状况指标
试验兔32日龄断奶后,记录腹泻试验兔数量和时间以及因腹泻而导致的死亡试验兔数量。

1.4.3 小肠黏膜免疫指标
于 32、39、46、53 及 60 日龄时,选取各试验组中健康、采食稳定且接近该组平均体重的试验兔4只,于当日晨饲后45~60 min内采用颈部移位法处死,立即分离空肠后用4℃的生理盐水冲洗内容物,吸水纸轻轻吸干表面多余生理盐水,用洁净的手术刀钝面刮取空肠肠道黏膜放入EP管,液氮冷冻1 min以上后置于-70℃冰箱保存,委托北京华英生物技术研究所用于肠黏膜白细胞介素2(IL-2)、白细胞介素 6(IL-6)、肿瘤坏死因子 α(TNF-α)及分泌型免疫球蛋白A(SIgA)含量的测定。
1.5 统计分析
采用SPSS 16.0的GLM模型进行单因素方差分析,多重比较用LSD法,数据以平均值或平均值±标准差表示。
2 结果
2.1 饲粮SC/NSC对肉兔生长性能的影响
由表2可知,随着饲粮SC/NSC的增加,试验兔ADFI逐渐升高,34∶26组极显著高于其他各组(P<0.01),31∶29 组极显著高于 22∶38、25∶35 和28∶32组(P<0.01),28∶32 组极显著高于 22∶38 和25∶35 组(P<0.01),25∶35 组显著高于 22∶38 组(P<0.05)。试验兔 ADG 先升高后降低,28∶32 组极显著高于 22∶38 和 25∶35 组(P<0.01),显著高于 34∶26 组(P<0.05),与 31∶29 组差异不显著(P>0.05)。试验兔 F/G先降低后升高,28∶32组极显著低于 22∶38、34∶26 和 31∶29 组(P<0.01),与25∶35组差异不显著(P>0.05)。

表2 饲粮SC/NSC对肉兔生长性能的影响Table 2 Effects of dietary SC/NSC on growth performance of meat rabbits
2.2 饲粮SC/NSC对肉兔健康状况的影响
由表3可知,试验兔的腹泻率、死亡率、健康风险指数和平均腹泻时间均随着饲粮SC/NSC的升高而降低。22∶38组的健康风险指数分别是25 ∶35、28∶32、31∶29 和 34∶26 组的 1.23、2.00、5.33和 7.99 倍,而平均腹泻时间分别是 1.26、1.58、2.15和 5.38 倍。
2.3 饲粮SC/NSC对肉兔肠黏膜免疫的影响
2.3.1 饲粮 SC/NSC对肉兔肠黏膜IL-2含量的影响
由表4可知,32~60日龄,试验兔肠黏膜IL-2含量随着饲粮SC/NSC升高而增加。32日龄,31∶29和 34∶26 组均显著高于 22∶38 和 25∶35 组(P<0.05),28∶32 组与其余各组差异不显著(P>0.05)。39 日龄,31∶29 和 34∶26 组均极显著高于22∶38 和 25∶35 组(P<0.01),31∶29 组显著高于28∶32组(P<0.05),28∶32 组极显著高于 22∶38 和25∶35 组(P<0.01)。46 日龄,22∶38 和 25∶35 组极显著低于 28∶32、31∶29 和 34∶26 组(P<0.01),28∶38组显著低于 31∶29 和 34∶26 组(P<0.05)。53日龄,31∶29 和 34∶26 组极显著高于 22∶38、25∶35和22∶38 组(P<0.01);28∶32 组显著高于25∶35组(P<0.05),极显著高于 22∶38 组(P<0.01),其余各组差异不显著(P>0.05)。60 日龄,22∶38 组和 25∶35组差异不显著(P>0.05),随着饲粮SC/NSC的上升,其余各组呈极显著增大(P<0.01)。
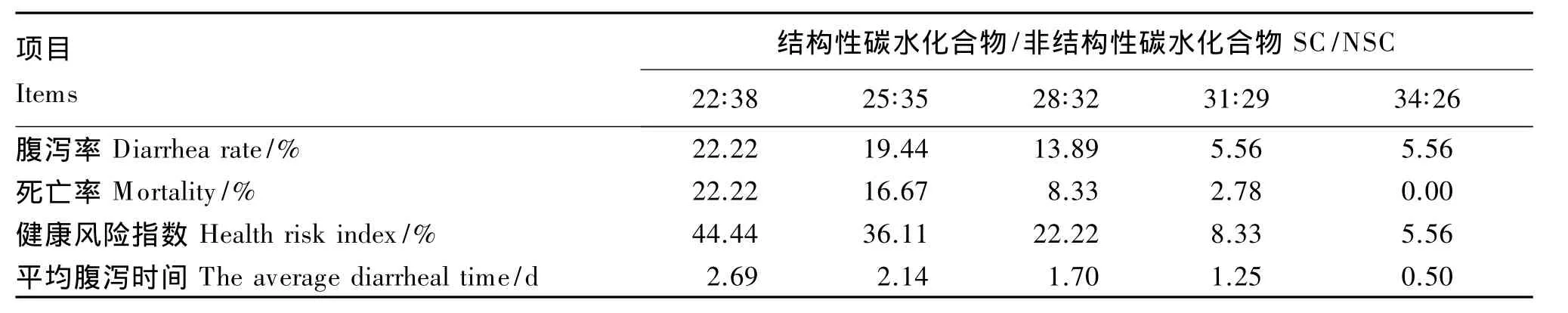
表3 饲粮SC/NSC对肉兔健康状况的影响Table 3 Effects dietary SC/NSC on the state of health of meat rabbits
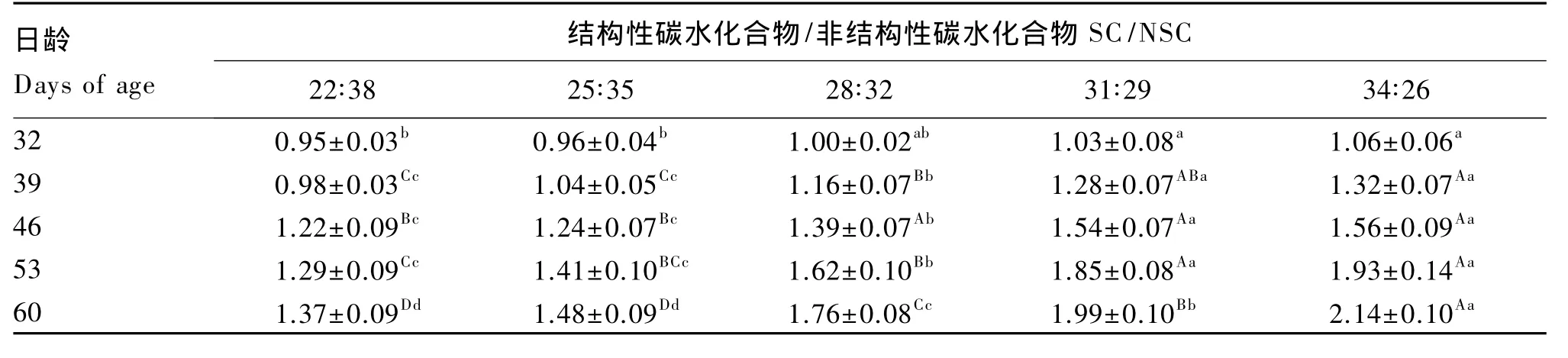
表4 饲粮SC/NSC对肉兔肠黏膜IL-2含量的影响Table 4 Effects dietary SC/NSC on intestinal mucosa IL-2 content of meat rabbits ng/mg
2.3.2 饲粮 SC/NSC对肉兔肠黏膜IL-6含量的影响
由表5可知,试验兔肠黏膜IL-6含量随着饲粮SC/NSC升高先降低后升高。32日龄,各组间差异不显著(P>0.05)。39日龄,28∶32 组极显著低于其余各组(P<0.05),其余各组间差异不显著(P>0.05)。46 日龄,22∶38 和 25∶35 组均显著高于 28∶32 组(P<0.05),其余各组差异不显著(P>0.05)。53日龄,28∶32 组极显著低于其余各组(P<0.01),25∶35 组极显著低于 22∶38 组(P<0.01),31∶29 组显著低于 34∶26 组(P<0.05)。60日龄,28∶32组极显著低于其余各组(P<0.01),25∶35组极显著低于 22∶38 组(P<0.01),31∶29 组极显著低于 34∶26 组(P<0.01)。

表5 饲粮SC/NSC对肉兔肠黏膜IL-6含量的影响Table 5 Effects dietary SC/NSC on intestinal mucosa IL-6 content of meat rabbits pg/mg
2.3.3 饲粮SC/NSC对肉兔肠黏膜TNF-α 含量的影响
由表 6可知,32~60日龄,试验兔肠黏膜TNF-α含量随着饲粮SC/NSC升高而先降低后升高。32日龄,28∶32组显著低于其余各组(P<0.05),其余各组间差异不显著(P>0.05)。39日龄,22∶38 组显著高于 34∶26 组(P<0.05),极显著高于28∶32 和 31∶29 组(P<0.01)。46 日龄,22∶38 组显著高于 28∶32 和 31∶29 组(P<0.05),其余各组间差异不显著(P>0.05)。53、60日龄,各组之间差异不显著(P>0.05)。

表6 饲粮SC/NSC对肉兔肠黏膜TNF-α含量的影响Table 6 Effects dietary SC/NSC on intestinal mucosa TNF-αcontent of meat rabbits ng/mg
2.3.4 饲粮SC/NSC对肉兔肠黏膜SIgA含量的影响
由表7可知,32~60日龄,试验兔肠黏膜SIgA含量随着饲粮SC/NSC升高而增加。32日龄,各组间差异不显著(P>0.05),以 34∶26组最高。39日龄,34∶26组显著高于 31∶29和 28∶32组(P<0.05),极显著高于 25∶35 和 22∶38 组(P<0.01);31∶29 和 28∶32 组均极显著高于 25∶35 和 22∶38 组(P<0.01);31∶29 组和 28∶32 组间、25∶35 组和22∶38组间差异不显著(P>0.05)。46日龄,22∶38组极显著低于其余各组(P<0.01);25∶35组显著低于 28∶32、31∶29 和 34∶26 组(P<0.05),其余各组差异不显著(P>0.05)。53日龄,22∶38 组显著低于其余各组(P<0.05),其余各组间差异不显著(P>0.05)。60 日龄,22∶38 组显著低于 28∶32 组(P<0.05),极显著低于 31∶29 和 34∶26 组(P<0.01);25∶35 和 28∶32 组均显著低于 31∶29 组(P<0.05),极显著低于 34∶26 组(P<0.01);其余各组差异不显著(P>0.05)。

表7 饲粮SC/NSC对肉兔肠黏膜SIgA含量的影响Table 7 Effects dietary SC/NSC on intestinal mucosa SIgA content of meat rabbits μg/mg
3 讨论
3.1 饲粮SC/NSC对肉兔生长性能的影响
碳水化合物作为肉兔能量的主要来源,其比例(SC/NSC)主要通过影响消化道的发育和酶活[8-11]以及刺激肠道蠕动等方式促进肉兔采食和养分消化吸收,从而提高生长性能。Gutierrez等[9]研究表明,随着纤维(主要是SC)含量增加和淀粉(主要是NSC)含量降低,能显著提高ADG和降低F/G,但对ADFI没有显著影响。这与本试验结果有些偏差,其原因是富含纤维的饲粮具有较大的容重,相同采食量下食糜的体积更大,而且SC对饲粮能量的低能值效应会刺激动物采食量代偿性增加,从而导致肉兔消化道体积的增大和消化道黏膜的增生,促进了肉兔消化道的发育,增加采食和促进营养物质的吸收;但是当SC过高时,纤维以其较大的粒子片段和粗糙的表面刺激胃肠蠕动,加速食糜向下部移行和排出体外,不利于养分的消化吸收。
3.2 饲粮SC/NSC对肉兔健康状况及肠黏膜免疫的影响
仔兔断奶后,腹泻是制约肉兔养殖的一道瓶颈,而且死亡率极高,主要是肠道免疫机能不完善,抵抗力较低,易感染细菌和寄生虫,引起肠黏膜免疫屏障损坏,肠道免疫功能下降,肠道细菌及毒素增加,菌群失调,增加肠道的感染,同时上皮细胞更新及修复减慢,消化及吸收功能受损,营养物质减少,促进疾病的恶化。在肠黏膜通透性增加的前提下,细菌及内毒素引起胰腺的继发感染,激发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的发生,并通过一系列级联反应最终可引发多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[12]。而由B淋巴细胞活化为浆细胞分泌的SIgA在肠道免疫系统中起核心作用,SIgA能中和酶、毒素、病菌和其他生物活性抗原,削弱细菌表面疏水性,与细菌结合形成抗原抗体复合物,包被和封闭细菌与肠上皮细胞结合的特异部位,阻止其与肠上皮细胞吸附,防止细菌移位,并刺激肠道黏液分泌,加速黏液在黏膜表面的移动,从而有助于细菌和内毒素的排出,增强肠道免疫机能,减少腹泻的发生。研究表明,IL-2能刺激 SIgA的分泌[13-14],TNF-α通过增加SC分泌片段而增加 SIgA含量[15],IL-6被赋予B细胞刺激因子,可诱导 B细胞分化为浆细胞分泌 SIgA[16]。María 等[4]研究表明,纤维有增强细胞免疫反应的趋势,能影响IL-2的生成,增强黏膜的功能和完整性。彭全辉[17]和王金利[18]研究表明,饲粮纤维能增加肠道淋巴细胞数量,促进IL-2分泌,以刺激SIgA的分泌,来增强肉兔免疫功能,改善肉兔健康。Zhu等[19]研究表明,72日龄时,随着淀粉与纤维比例的升高,肠道SIgA含量逐渐降低。上述报道与本试验研究结果基本一致,但随饲粮SC/NSC的升高,IL-6和TNF-α含量先下降后升高,其机理有待进一步研究。
4 结论
饲粮SC/NSC会通过影响肠黏膜IL-2含量,刺激SIgA的分泌,提高肠道免疫机能。从提高黏膜免疫力,降低腹泻率和死亡率的角度看,以饲粮中SC/NSC为34∶26最佳。
[1] RODRÍGUEZ-ROMERO N,ABECIA L,FONDEVILA M,et al.Microbial ecosystem and fermentation traits in the caecum of growing rabbits given diets varying in neutral detergent soluble and insoluble fibre levels[J].Anaerobe,2013,20:50-57.
[2] RODRÍGUEZ-ROMERO N,ABECIA L,FONDEVILA M.Bacterial profile from caecal contents and soft faeces in growing rabbits given diets differing in soluble and insoluble fibre levels[J].Anaerobe,2012,18(6):602-607.
[3] TROCINO A,FRAGKIADAKIS M,MAJOLINI D,et al.Soluble fibre,starch and protein level in diets for growing rabbits:effects on digestive efficiency and productive traits[J].Animal Feed Science and Technology,2013,180(1/2/3/4):73-82.
[4] GÓMEZ-CONDE M S,GARCÍA J,CHAMORRO S,et al.Neutral detergent-soluble fiber improves gut barrier function in twenty-five-day-old weaned rabbits[J].Journal of Animal Science,2007,85(12):3313-3321.
[5] 谭支良,卢德勋,胡明,等.绵羊日粮中不同碳水化合物比例对瘤胃内环境参数的影响[J].动物营养学报,2000,12(1):42-47.
[6] 余群莲,王之盛,薛白,等.饲粮中结构性碳水化合物与非结构性碳水化合物的不同比例对降解后白酒糟体外发酵特性的影响[J].动物营养学报,2010,22(4):956-963.
[7] 吴秋珏,郝正里,李发弟,等.饲粮结构与非结构性碳水化合物比例对绵羊瘤胃代谢参数的影响[J].畜牧兽医学报,2011,42(2):196-202.
[8] 周勤飞,鲍新宇,周述俊,等.不同易消化纤维和淀粉比对肉兔生产性能、消化道酶活的影响[J].粮食与饲料工业,2013,12(1):53-56.
[9] GUTIÉRREZ I,ESPINOSA A,GARCÍA J,et al.Effect of levels of starch,fiber,and lactose on digestion and growth performance of early-weaned rabbits[J].Journal Animal Science,2002,80(4):1029-1037.
[10] CHAO H Y,LI F C.Effect of level of fibre on performance and digestion traits in growing rabbits[J].Animal Feed Science and Technology,2008,144(3/4):279-291.
[11] GÓMEZ-CONDE M S,DE ROZAS A R,BADIOLA I,et al.Effect of neutral detergent soluble fibre on digestion,intestinal microbiota and performance in twenty five day old weaned rabbits[J].Livestock Science,2009,125(2/3):192-198.
[12] WALAER E M,NEALON W H,MARROQUIN S,et al.Sterile fluid collections in acute pancreatitis:catheter drainage versus dimple aspirations[J].Cardio Vascular and Interventional Radiology,2006,29(1):102-107.
[13] 张怀,裴淑丽,赵珊珊,等.IL-2对免疫新城疫疫苗的固始鸡十二指肠(SIgA)分泌的增强作用[J].江西农业学报,2010,22(1):122-125.
[14] 赵珊珊,张怀,徐亚平,等.重组白细胞介素2对固始鸡空肠黏膜免疫增强作用的研究[J].中国畜牧兽医,2010,37(3):60-64.
[15] 刘冬妍,苗佳宁,丁鹏.TNF-α对肠上皮细胞PIgR、NF-κB亚单位表达影响[J].中国免疫学杂志,2011,27(2):107-109.
[16] 包士三.细胞因子在肠道黏膜免疫中的重要作用[J].上海免疫学杂志,2001,21(3):133-135.
[17] 彭全辉.不同ADF水平饲粮对肉兔生产性能、肠道黏膜免疫及盲肠发酵的影响[D].硕士学位论文.雅安:四川农业大学,2008.
[18] 王金利.日粮NDF水平对断奶獭兔生长性能、肠道免疫和盲肠微生物数量的影响[D].硕士学位论文.杨凌:西北农林科技大学,2012.
[19] ZHU Y L,WANG C Y,WANG X P,et al.Effects of dietary fiber and starch levels on the non-specific immune response of growing rabbits[J].Livestock Science,2013,155(2/3):285-293.

